姜黄素对肝细胞癌耐药细胞上皮间质转化的影响及分子机制研究
练维生 姚征 曹非 郑屹峰
肝细胞癌(hepatocellular carcinoma,HCC)具有高复发、易转移的特性[1]。尽管HCC的诊断与治疗取得了重大进展,但癌细胞在抗癌药物治疗后敏感性和反应各不相同,多种抗癌药物对耐药细胞(如耐阿霉素的人HCC细胞HepG2/ADM)均表现出较差的抗肿瘤活性[2]。上皮间质转化(epithelial-mesenchymal transition,EMT)是上皮细胞向间充质表型转变的重要过程,与癌症的转移过程、耐药性有密切关系[3]。姜黄素是一种多酚类化合物,具有抗炎、抗氧化、调节细胞生存等作用[4]。已有研究证明,姜黄素可以通过NF-κB通路抑制癌细胞的侵袭[5],还具有抑制HCC发展和改善耐药性的作用[6-7]。然而,目前关于姜黄素对HepG2/ADM细胞作用的相关分子机制研究尚不多见。因此,本研究就姜黄素对HCC耐药细胞EMT的影响及分子机制作一探讨,以期为改善HCC治疗方式及耐药现状提供理论基础。
1 材料和方法
1.1 细胞 人HCC耐药细胞HepG2/ADM购自广州吉妮欧生物有限公司。
1.2 主要试剂 锌指蛋白(Snail)过表达载体购自上海吉凯基因医学科技股份有限公司;Lipofectamine 3000试剂购自美国Invitrogen公司;RPMI 1640培养基及FBS购自美国Gibco公司;姜黄素、二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma公司;阿霉素购自深圳万乐药业有限公司;噻唑蓝溴化四唑(MTT)、胰蛋白酶、多聚甲醛、PBS、Triton X-100、Hoechst 33342染色液均购自北京索莱宝公司;兔抗人E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、NF-κB p65、Snail、活化因子蛋白-1(AP-1)、信号转导因子和转录激活因子3(STAT-3)、cMyc、甘油醛-3-磷酸脱氢酶(GAPDH)等一抗以及异硫氰酸荧光素偶联的二抗均购自美国CST公司;4',6-二脒基-2-苯基吲哚(DAPI)购自上海碧云天公司。
1.3 方法
1.3.1 细胞培养及转染 将HepG2/ADM细胞培养置于含0.5 nmol/ml阿霉素的RPMI 1640培养基中,37℃、5%CO2环境中培养,2~3 d传代1次。按1.5×106个细胞/孔的浓度接种于6孔板,取1.5 ml EP管依次加入250 μl Opti-MEM I、4 μg Snail过表达载体或空载;再取 1.5 ml EP 管,加入 250 μl Opti-MEM I、8 μl lipofectamine 3000转染剂混匀,根据产品说明书进行后续操作。
1.3.2 细胞增殖能力检测 采用MTT法。取对数生长期的细胞接种至96孔板(5×103个细胞/孔)培养24 h后,加入不同浓度(10、20、30、40、50、60、70、80 μmol/L)姜黄素孵育48 h。在黑暗环境下,加入20 μl/孔MTT(5 mg/ml)处理4 h,加入150 μl DMSO处理10 min,记录各孔细胞在490 nm处的吸光度值,计算细胞存活率。此步骤为预实验,为了避免对后续实验造成较大影响,本研究选择姜黄素浓度20 μmol/L进行以下细胞功能学检测。
1.3.3 细胞迁移能力检测 采用划痕实验。将细胞用胰蛋白酶处理后接种至6孔板中(5×105个细胞/孔)进行培养,并通过20 μl无菌枪头划痕。洗去漂浮细胞后,加入无血清RPMI 1640培养基继续培养24 h。在显微镜下观察、拍照,记录24 h前后的划痕距离。
1.3.4 细胞侵袭能力检测 采用Transwell实验。将细胞接种至包被有基质胶的8 μm Transwell上室,下室添加含姜黄素的15%FBS培养基。48 h后,通过棉签刮擦上室残留的细胞,下室内细胞通过4%多聚甲醛固定、0.1%结晶紫染色,在光镜下观察并记录细胞侵袭个数。
1.3.5 EMT标志物及NF-κB/Snail通路相关蛋白表达检测 采用Western blot法。经聚丙烯酰胺凝胶电泳后转膜封闭2 h;4℃过夜孵育一抗,二抗孵育90 min。通过化学发光显影,利用凝胶图像处理系统分析光密度值。以GAPDH为内参,计算EMT标志物E-cadherin、N-cadherin、Vimentin和Snail通路相关蛋白Snail、NF-κB p65、AP-1、STAT-3、cMyc等蛋白相对表达量。
1.4 统计学处理 采用Graphpad Prism 8.0统计软件。计量资料以表示,两组比较采用两独立样本t检验,多组比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度姜黄素对HepG2/ADM细胞增殖的影响 随着姜黄素浓度的升高,HepG2/ADM细胞存活率明显降低(P<0.05);20 μmol/L为姜黄素处理的合适浓度,见图1。

图1 不同浓度姜黄素对HepG2/ADM细胞增殖的影响
2.2 姜黄素对HepG2/ADM细胞迁移和侵袭能力的影响 与HepG2/ADM组比较,HepG2/ADM+姜黄素组细胞迁移和侵袭能力均明显减弱,差异均有统计学意义(均P<0.05),见图2。
2.3 姜黄素对HepG2/ADM细胞EMT标志物蛋白表达的影响 与HepG2/ADM组比较,HepG2/ADM+姜黄素组E-cadherin蛋白表达明显上调,N-cadherin、Vimentin蛋白表达均明显下调,差异均有统计学意义(均P<0.05),见图3。

图3 姜黄素对HepG2/ADM细胞中上皮-间质转化标志物蛋白表达的影响
2.4 姜黄素对HepG2/ADM细胞NF-κB/Snail通路相关蛋白表达的影响 与HepG2/ADM组比较,HepG2/ADM+姜黄素组NF-κB p65、Snail蛋白表达均明显下调(均P<0.05),AP-1、STAT-3、cMyc蛋白表达差异均无统计学意义(均P>0.05),见图4。
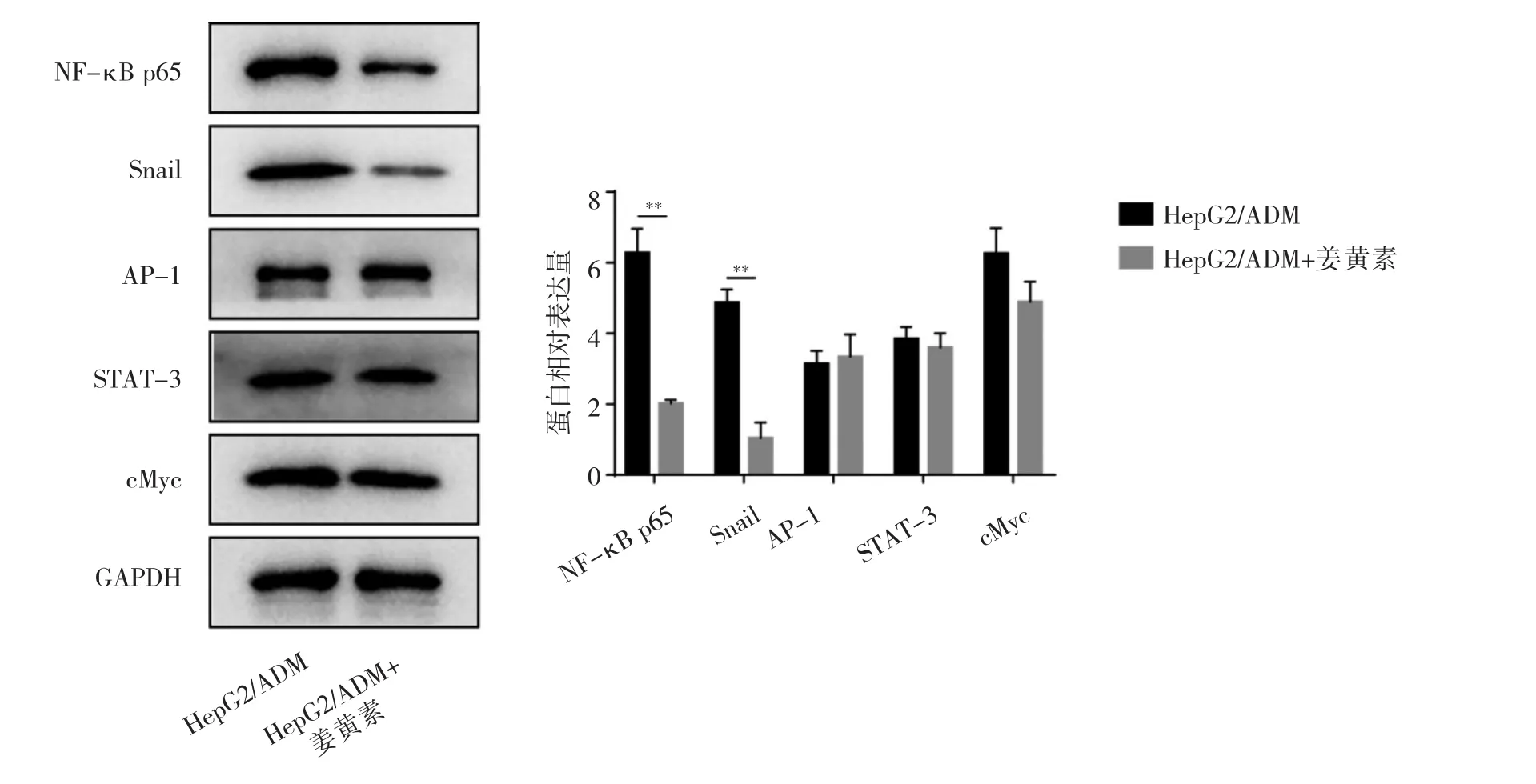
图4 姜黄素对NF-κB/Snail通路相关蛋白表达的影响
2.5 姜黄素通过NF-κB/Snail通路抑制HepG2/ADM细胞EMT的验证结果 在20 μmol/L姜黄素处理HepG2/ADM细胞的基础上过表达Snail后,由姜黄素诱导的E-cadherin表达上调、N-cadherin和Vimentin表达下调均被逆转(均P<0.05),见图5a;HepG2/ADM细胞增殖、迁移和侵袭能力均明显增强(均P<0.05),见图5b-d。

图5 姜黄素通过NF-κB/Snail通路抑制HepG2/ADM细胞上皮间质转化的验证结果(a:Western blot结果;b:噻唑蓝溴化四唑法检测细胞增殖能力;c:划痕实验检测细胞迁移能力,×40;d:Transwell实验检测细胞侵袭能力,×200)
3 讨论
HCC已成为全球癌症相关死亡的主要原因。目前HCC的治疗策略仍以手术、放疗和化疗为主,但患者的预后较差,尤其是对化疗产生耐药性的患者[8]。阿霉素是HCC的常规化疗药物,但肿瘤细胞对其产生的耐药性严重影响了化疗的效果[9]。因此,需要更深入研究HCC耐药细胞的潜在分子机制。
EMT是一种可逆的细胞过程,通常伴随细胞黏附破坏、迁移侵袭和转移增加以及化疗耐药等现象出现[10]。经历EMT的细胞会表现出上皮基因如E-cadherin、紧密连接蛋白1和闭合蛋白表达下调,而间充质基因如N-cadherin、Vimentin和纤维粘连蛋白表达上调。在大多数情况下,E-cadherin的丢失是EMT的标志[11]。EMT已被确定在包括HCC在内的癌细胞转移和复发中发挥重要作用[12]。姜黄素是一种由姜黄根茎产生的化学物质,多项研究表明,姜黄素对肝、肺和肾纤维化等多种病理状态具有潜在治疗作用[13]。并有证据表明姜黄素对EMT有着潜在的调控作用,例如姜黄素可以通过上调miR-200c表达,进而下调细胞外信号调节激酶5来抑制结直肠癌的EMT过程[14];通过ERK5/AP-1通路负调控香烟烟雾诱导的肾细胞癌EMT过程[15]。本研究结果显示,姜黄素可以抑制HepG2/ADM细胞的增殖、迁移和侵袭。此外,姜黄素
还能抑制N-cadherin和Vimentin蛋白表达,促进E-cadherin蛋白表达,对HepG2/ADM细胞的EMT具有显著抑制作用。
研究表明,在参与EMT进展的几个关键因素中,NF-κB至关重要。在此过程中,NF-κB可以诱导多种促进肿瘤EMT和转移的转录因子,包括Snail、Twist和ZEB2[16]。其中,第一个发现的E-cadherin转录抑制因子是Snail[17]。由NF-κB介导的Snail转录激活在调节癌细胞中的EMT过程起重要作用,例如NF-κB/Snail信号通路被发现在芹菜素对人结肠癌细胞的EMT抑制过程中发挥作用[18]。肠内酯调节三阴性乳腺癌细胞中NF-κB/Snail信号通路以恢复TGF-β诱导的EMT[19]。本研究也证实姜黄素作用于HepG2/ADM细胞后会引起NF-κB/Snail信号通路中相关蛋白表达下调。此外,在HepG2/ADM细胞中过表达Snail后,可部分逆转姜黄素对EMT的抑制作用,促进HepG2/ADM细胞增殖、迁移和侵袭,提示姜黄素可能通过影响NF-κB/Snail通路来抑制HepG2/ADM细胞的EMT过程。
综上所述,本研究证实了姜黄素对HepG2/ADM细胞增殖、迁移和侵袭的抑制作用,同时细胞EMT过程在一定程度上也被抑制,可能与姜黄素对NF-κB/Snail通路的抑制有关。本实验仅为细胞层面的验证,具有一定的局限性,后续拟从动物实验对该分子机制进行更深一步的验证。

