右美托咪定在减轻脂多糖诱导人肾小管上皮细胞损伤中的作用研究
林宗斌 朱静文 朱峥 邵自强 刘景全 孙仁华
重症监护病房超过50%的急性肾损伤(acute kidney injury,AKI)与脓毒症有关[1]。脂多糖(lipopolysaccharide,LPS)引起的肾小管上皮细胞损伤是脓毒症AKI发生的关键病理生理学环节,但其损伤机制不明[2]。干扰素调节因子1(interferon regulatory factor 1,IRF1)是一种重要的核转录因子,近年来的研究发现,IRF1可以对细菌感染产生响应,调控一系列与炎性反应、细胞增殖、凋亡相关的基因表达[3]。有研究显示,IRF1在LPS及缺血-再灌注等原因导致的器官损伤过程中发挥着一定的作用[4]。右美托咪定(dexmedetomidine,DEX)是一种镇痛、镇静药物,广泛应用于手术麻醉。近期研究表明,DEX还具有减轻炎症及调控免疫功能的作用。一些研究发现,DEX可以减轻包括脓毒症引起的多种器官损伤[5]。但是DEX对脓毒症患者脏器功能保护作用的机制尚不明确。本研究通过分析LPS及DEX处理后肾小管上皮细胞RNA测序的结果,探讨DEX在减轻LPS诱导肾小管上皮细胞损伤中的作用,现报道如下。
1 材料和方法
1.1 细胞培养 人肾小管上皮细胞(human kidney-2,HK-2)购自武汉普诺赛生命科技有限公司。细胞培养采用添加10%FBS及1%青-链霉素的最低必需培养基(minimum essential medium,MEM),培养基购自武汉普诺赛生命科技有限公司(批号:PM150410P,规格:500 ml),培养环境为湿度恒定的37℃、5%CO2培养箱。2~3 d使用胰酶消化传代1次,胰酶购自美国Gibco公司(批号:25200-056,规格:250 ml),取对数生长期细胞进行后续实验。
1.2 方法
1.2.1 高通量RNA测序 使用10 μmol DEX(扬子江药业集团有限公司,批号:H20183220,规格:0.1 mg)或10 μg/ml LPS(上海 MedChemExpress公司,批号:HYD1056,规格:5 mg)处理HK-2 24 h,以未经任何处理的细胞作为对照细胞。使用Trizol试剂(美国Thermofisher公司,批号:15596018,规格:200 ml)提取细胞总RNA样本,通过HiSeq 2500系统进行RNA测序。
1.2.2 细胞转染 为上调细胞中的IRF1,以pcDNA3.0为骨架构建IRF1过表达质粒,命名为pcDNA3.0-IRF1。使用pcDNA3.0空质粒作为阴性转染对照。转染时质粒浓度为2 μg/ml。为下调细胞中的IRF1,设计合成针对IRF1的小干扰RNA(siRNA),命名为siRNAIRF1,使用不针对任何序列的siRNA作为阴性转染对照。转染试剂采用Lipofectamine 3000转染试剂(美国ThermoFisher公司,批号:L3000015,规格:1.5 ml)。
1.2.3 细胞分组 为探讨IRF1在DEX减轻LPS诱导的HK-2损伤过程中的作用,根据不同转染或药物处理方案将细胞分组:转染过表达阴性对照质粒为pcDNA3.1组、转染IRF1过表达质粒为pcDNA3.1-IRF1组、未经任何处理的细胞为空白对照组、转染siRNA对照同时LPS处理24 h为LPS+siRNA组、转染IRF1 siRNA同时LPS处理24 h为LPS+siRNA-IRF1组、LPS处理同时PBS处理为LPS+PBS组、转染过表达阴性对照质粒同时接受LPS及DEX处理24 h为LPS+DEX+pcDNA3.1组、转染IRF1过表达质粒同时接受LPS及DEX处理24 h为LPS+DEX+pcDNA3.1-IRF1组。
1.2.4 IRF-1 mRNA水平检测 采用实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)法,使用Trizol试剂提取各种处理后细胞的总RNA样本,利用Hifair®Ⅱ1st Strand cDNA Synthesis Kit试剂盒(上海翌圣生物科技股份有限公司,批号:11119ES60,规格:100次)进行反转录以合成cDNA。将合成的cDNA使用Hieff UNICON®Power qPCR SYBR Green Master Mix试剂盒(上海翌圣生物科技股份有限公司,批号:11195ES03,规格:1 ml)进行定量扩增。所有PCR反应体系及反应条件参照试剂盒说明书。IRF1的正向引物序列为5'-ATGCCCATCACTCGGATGC-3',反向引物序列为5'-CCCTGCTTTGTATCGGCCTG-3'。以GAPDH为内参,其正向引物为5'-GGAGCGAGATCCCTCCAAAAT-3',反向引物为5'-GGCTGTTGTCATACTTCTCATGG-3'。使用 2-ΔΔCT法计算靶基因的相对表达量。
1.2.5 IRF-1蛋白水平检测 采用蛋白质印迹法,使用含有蛋白酶抑制剂的RIPA裂解液(上海碧云天生物技术有限公司,批号:P0013B,规格:100 ml)提取细胞的总蛋白样本。使用BCA蛋白定量试剂盒(上海碧云天生物技术有限公司,批号:P0012S,规格:200次)定量后,与上样缓冲液混合,98℃变性10 min。将样品等量上样于SDS-PAGE胶,100 V恒压电泳1 h。将蛋白转膜至PVDF膜,转膜条件为90 V恒压45 min。转膜后,使用5%脱脂牛奶室温封闭1 h,然后与1∶1 000稀释的兔抗人IRF1多克隆抗体(美国Cell Signaling Technology公司,批号:8478S,规格:20 μl)室温孵育4 h。使用1∶5 000的GAPDH一抗作为内参一抗(美国Cell Signaling Technology公司,批号:5174S,规格:20 μl)。PBST洗去一抗后,与1∶2 000辣根过氧化物酶标记的抗兔lgG二抗(美国Cell Signaling Technology公司,批号:7074S,规格:1 ml)室温孵育2 h,ECL超敏显色液(上海碧云天生物技术有限公司,批号:P0018FS,规格:100 ml)显影、拍照。
1.2.6 细胞活性检测 将各组细胞种植于96孔板,密度为5 000个/孔。贴壁24 h后,进行对应的各种转染或药物处理,使用细胞计数试剂盒-8(cell counting Kit-8,CCK-8)细胞活性试剂(上海碧云天生物技术有限公司,批号:C0037,规格:100次)检测细胞活性,检测时间点为0、24、48、72 h。0 h为细胞贴壁后未处理时。检测时弃去原有培养基,加入100 μl 1∶10稀释的CCK-8试剂,孵育1 h后使用酶标仪(美国BioTech公司,型号:ELX808)检测450 nm处吸光度。相对细胞活性=其他时间点吸光度/0 h吸光度,计算各组细胞活性。
1.2.7 细胞增殖检测 将各组细胞种植于96孔板,密度为5 000个/孔。贴壁24 h后使用BeyoClick EdU-488试剂盒(上海碧云天生物技术有限公司,批号:C0071s,规格:100次)进行EdU染色并拍照,EdU染色阳性细胞为增殖细胞。
1.2.8 细胞凋亡检测 将各组细胞种植于96孔板,密度为5 000个/孔。贴壁24 h后使用RealTime-Glo Apoptosis试剂盒(北京普洛麦格生物技术有限公司,批号:JA1000,规格:100次)检测凋亡情况。反应体系和方案按照试剂盒说明书,使用化学发光检测仪(瑞士Tecan公司,型号:SPARK 10M)以凋亡信号值记录各组读数。
1.3 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,多组比较采用单因素方差分析,组间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 LPS及DEX处理后HK-2细胞的RNA测序结果LPS处理后共测出1 934个显著上调的基因(表达倍数>1.5,P<0.05),463个显著下调的基因(表达倍数<-1.5,P<0.05),见图1a;按照显著性排名前10位的mRNA见图1b。DEX处理后的HK-2细胞共测出3 712个显著上调的基因(表达倍数>1.5,P<0.05),1 179个显著下调的基因(表达倍数<-1.5,P<0.05),见图1c;按照显著性排名前10位的mRNA见图1d。其中IRF1在LPS处理后的细胞中上调(表达倍数=6.65,P<0.05),在DEX处理后的细胞中下调(表达倍数=-4.18,P<0.05),见图1e。
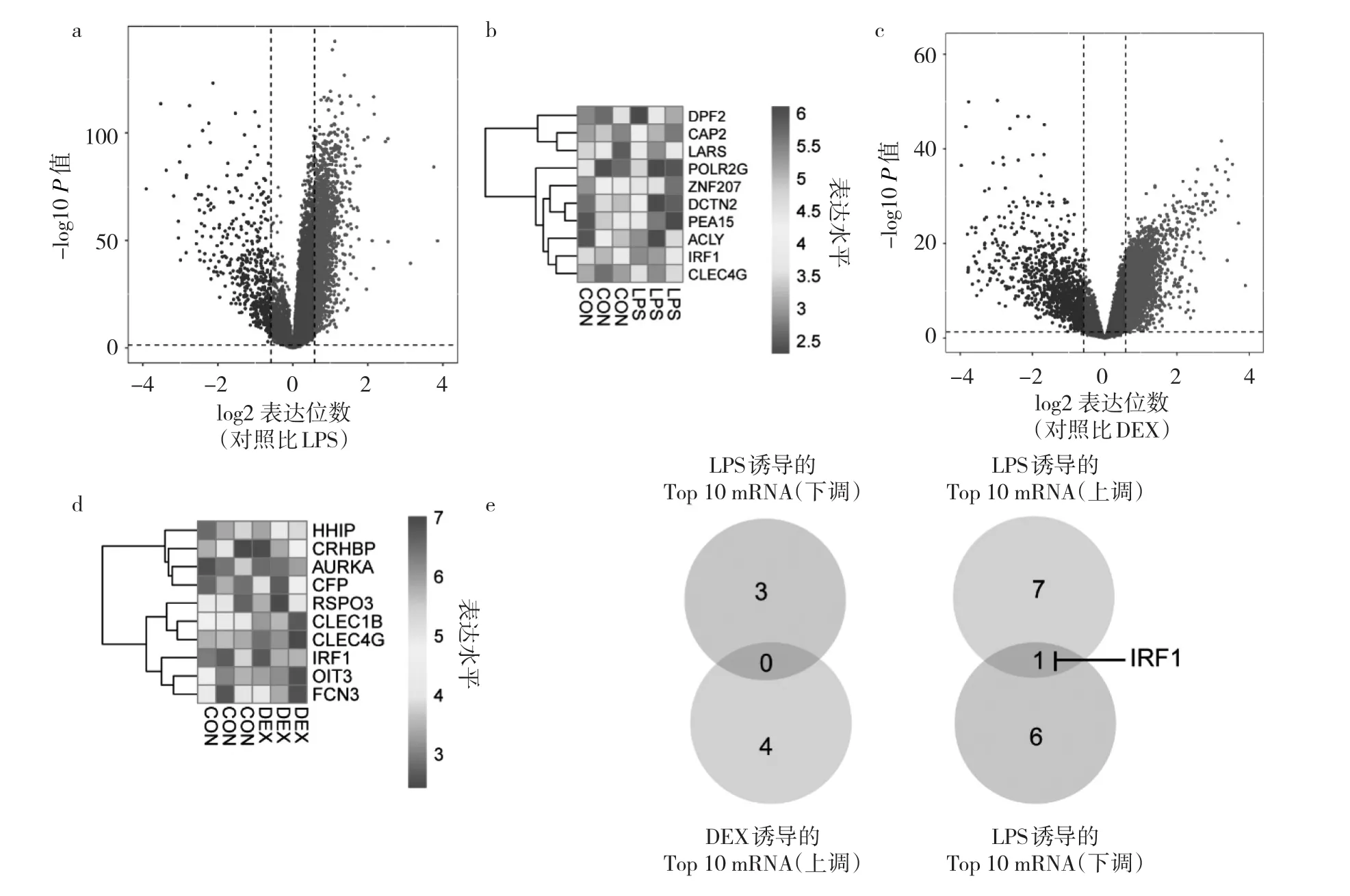
图1 LPS及DEX处理后HK-2的RNA测序结果(a:LPS处理后HK-2的mRNA表达谱;b:LPS处理后变化显著性排名前10位的mRNA;c:DEX处理后HK-2的mRNA表达谱;d:DEX处理后变化显著性排名前10位的mRNA;e:LPS及DEX处理后的共同差异表达基因为IRF1)
2.2 LPS及DEX处理后HK-2细胞IRF1 mRNA表达水平比较 LPS处理后的IRF1 mRNA水平为2.69±0.33,高于对照组的1.00±0.12(P<0.05),而DEX处理后的IRF1 mRNA水平为0.51±0.09,低于对照组的1.00±0.11(P<0.05)。蛋白质印迹法检测结果显示,LPS促进IRF1的蛋白表达,而DEX抑制IRF1的蛋白表达,见图2。

图2 LPS及DEX处理后HK-2的IRF1 mRNA表达水平比较(a:LPS处理后IRF1 mRNA水平与对照组比较;b:DEX处理后IRF1 mRNA水平与对照组比较;c:LPS及DEX处理后IRF1蛋白表达电泳图)
2.3 HK-2转染过表达质粒及siRNA后IRF1 mRNA水平及蛋白水平比较 转染IRF1过表达质粒后,HK-2细胞IRF1 mRNA水平由1.00±0.12升高至22.00±3.61(P<0.05)。转染IRF1的siRNA后,细胞内IRF1 mRNA水平由1.00±0.14降低至0.12±0.02(P<0.05)。转染IRF1过表达质粒后,IRF1的蛋白水平升高,转染IRF1的siRNA后,IRF1的蛋白水平降低,见图3。

图3 HK-2转染过表达质粒及siRNA后IRF1 mRNA水平及蛋白水平比较(a:HK-2转染过表达质粒后IRF1 mRNA水平;b:HK-2转染siRNA后IRF1 mRNA水平;c:转染后IRF1蛋白表达电泳图;与阴性转染对照组比较,*P<0.05)
2.4 改变IRF1水平后HK-2细胞活性、增殖及凋亡指标的比较 与pcDNA3.1组比较,pcDNA3.1-IRF1组72 h细胞活性降低(2.10±0.02比 1.56±0.16,P<0.05),见图4a。EdU染色显示,pcDNA3.1-IRF1组24 h细胞增殖减少,见图4b。pcDNA3.1-IRF1组24 h的凋亡信号值为62 183.26±7 585.39,高于pcDNA3.1组的20 523±2 051(P<0.05),见图4c。LPS+siRNA组72 h细胞活性为0.65±0.08,低于空白对照组的1.91±0.21(P<0.05),LPS+siRNA-IRF1组 72 h细胞活性为1.23±0.13,高于LPS+siRNA组(P<0.05),见图4d。Edu染色显示,LPS+siRNA组24 h的细胞增殖减少,LPS+siRNA-IRF1细胞增殖高于LPS+siRNA组,见图4e。LPS+siRNA组24 h的细胞凋亡信号值为85 233.59±7 952.23,高于空白对照组的32 100.02±4 253.63(P<0.05),LPS+siRNA-IRF1组的24 h细胞凋亡信号值(62 187.24±8 742.68)低于LPS+siRNA组(P<0.05),见图4f。

图4 改变IRF1水平后HK-2细胞增殖及凋亡指标的比较(a:IRF1过表达后不同时间点细胞活性比较;b:IRF1过表达后细胞增殖比较的EdU染色荧光图;c:IRF1过表达后细胞凋亡比较;d:LPS及IRF1敲减后的细胞活性比较;e:LPS及IRF1敲减后细胞增殖比较的EdU染色荧光图;f:LPS及IRF1敲减后细胞凋亡的比较;与对照组比较,*P<0.05;与阴性转染对照组比较,△P<0.05)
2.5 DEX及LPS处理后HK-2细胞活性、增殖及凋亡指标的比较 空白对照组72 h细胞活性为2.53±0.23,LPS+PBS组为0.87±0.12;LPS+DEX+pcDNA3.1组72 h细胞活性为1.78±0.20,高于LPS+PBS组(P<0.05);LPS+DEX+pcDNA3.1-IRF1组72 h细胞活性为1.22±0.12,低于LPS+DEX+pcDNA3.1组(P<0.05),见图5a。EdU染色结果显示,LPS+PBS组细胞增殖受到抑制,而LPS+DEX+pcDNA3.1组增殖得以部分恢复,LPS+DEX+pcDNA3.1-IRF1组增殖再次被抑制,见图5b。空白对照组24 h细胞凋亡信号值为29 000.68±3 212.55,LPS+PBS组24h细胞凋亡信号值为98 521.00±456.8.73;LPS+DEX+pcDNA3.1组24h细胞凋亡信号值为55254.64±6 211.53,低于LPS+PBS组(P<0.05);LPS+DEX+pcDNA3.1-IRF1组24 h细胞凋亡信号值为74 524.63±8 563.66,高于LPS+DEX+pcDNA3.1组(P<0.05),见图5c。

图5 DEX及LPS处理后HK-2细胞增殖及凋亡指标的比较(a:LPS处理条件下,DEX及IRF1过表达后不同时间点细胞活性比较;b:LPS处理条件下,DEX及IRF1过表达后细胞增殖的EdU染色荧光图;c:LPS处理条件下,DEX及IRF1过表达后细胞凋亡比较;与对照组比较,*P<0.05;与PBS对照组比较,△P<0.05;与pcDNA3.1空质粒相比较,▲P<0.05)
3 讨论
目前对于脓毒症AKI的防治提倡“提高预防意识”“提高整体观念”“动态评估”及“早期干预”[6]。肾小管上皮细胞是肾脏结构和功能的基础,探讨脓毒症过程中肾小管上皮细胞损伤的分子机制对脓毒症AKI的防治具有较大的临床应用价值[7]。越来越多的证据表明,DEX具有应用于脓毒症器官保护的潜力[8],但在实现其在脓毒症AKI治疗的临床应用之前,需要揭示DEX减轻脓毒症引起的肾小管上皮细胞损伤的机制。本研究围绕上述科学问题进行了研究,结果发现DEX通过介导IRF1的表达变化减轻脓毒症过程中LPS对肾小管上皮细胞的损伤。
IRF1编码的蛋白质是一种转录调节因子,参与先天性和获得性免疫应答的基因激活;同时参与机体对病毒和细菌反应的基因转录,在细胞增殖、凋亡、免疫反应和DNA损伤反应中发挥作用[9]。近期的证据提示过高的IRF1参与LPS引起的细胞损伤。比如Yan等[10]发现IRF1调控LPS诱导的血管细胞粘附分子-1表达,引起内皮细胞的损伤;Yokota等[11]的研究发现IRF1通过产生IL-15/IL-15Rα促进肝移植后肝细胞的缺血/再灌注损伤。Deng等[12]的研究提出IRF1的过度激活参与LPS诱导的巨噬细胞线粒体损伤和氧化应激反应。还有研究发现,胡椒碱可以降低巨噬细胞中的IRF1水平,从而降低LPS造成的损伤[13];本研究发现IRF1的过表达可以抑制细胞增殖,诱导凋亡,提示过高的IRF1可以引起细胞损伤。敲减IRF1后,LPS引起的肾小管上皮细胞损伤得以减轻。因此,本研究认为LPS可能通过上调IRF1来发挥肾小管上皮细胞损伤功能。
DEX对呼吸功能无抑制作用,并能保持患者的易唤醒状态,除镇痛、镇静外,还能抗焦虑、稳定循环等作用。如能将该药用于脓毒症器官保护,势必能扩大其临床价值。DEX对脓毒症器官保护的作用已经在心脏、肝脏等器官中得到了证实[14-15]。DEX对脓毒症条件下肾脏的保护作用机制主要包括DEX能够减轻炎症反应,减轻氧化应激、抑制细胞凋亡以及促进细胞自噬。如Zhao等[16]发现DEX通过抑制PI3K/AKT/mTOR通路增强自噬抑制LPS介导的AKI。Feng等[5]的团队指出DEX通过GSK-3β/Nrf2信号通路抑制炎症和氧化应激,改善LPS诱导的大鼠AKI。Yang等[17]基于患者的研究发现DEX灌注保护了脓毒症休克患者的肾功能。这些研究多关注肾功能整体水平,较少有研究基于肾小管上皮细胞这个层面。本研究利用体外细胞模型发现DEX抑制IRF1水平,而过表达IRF1抵消了DEX的保护功能。所以DEX可以通过抑制IRF1的水平发挥对肾小管上皮细胞的保护作用。尽管本研究发现IRF1在DEX及LPS处理后肾小管上皮细胞中存在表达变化,并初步分析了IRF1扮演的功能角色,证实了IRF1介导了DEX的肾小管上皮细胞保护作用,但是本研究未能揭示IRF1发挥作用的分子机制,有待未来进一步研究。
综上所述,LPS诱导的肾脏上皮细胞损伤过程中存在IRF1的表达上调,IRF1对肾小管上皮细胞增殖和凋亡具有调控作用。DEX处理可以降低小管上皮细胞中的IRF1表达,其可通过抑制IRF1减轻脓毒症诱导肾小管上皮细胞损伤的作用。本研究对DEX的器官保护作用做出了分子机制上的解释,对DEX应用于脓毒症导致的器官损伤的防治提供了依据。
——一道江苏高考题的奥秘解读和拓展

