miRNA-27a 对实验性肺结核大鼠免疫功能的调控作用及其机制
韩 娜, 刘凡平, 田彦卿, 郑志清, 郎伟明, 王 倩, 刘亚涛, 朱建光
(1.河北大学附属医院结核科,河北 保定 071000;2.中国人民解放军陆军第八十二集团军医院耳鼻喉科,河北 保定 071000)
肺结核是因结核分枝杆菌(结核杆菌) 感染引起的一种慢性传染病,其传染性强、传播速度快且范围广,患者常出现咳嗽、胸痛、肢体乏力和免疫力低下等临床症状,严重时还会累及其他器官,严重威胁患者的生命健康[1]。目前对肺结核的临床治疗以化学治疗和药物干预为主,但在治疗过程中常出现化学治疗方案不合理、药物剂量不足或用药不规律等问题,导致结核杆菌获得耐药性,影响治疗效果[2]。因此,从分子生物学角度寻找治疗肺结核的有效靶点迫在眉睫。研究[3-5]表明: Toll 样受体4 (Toll-like receptor 4,TLR4) /核因子κB(nuclear factor kappa-B,NF-κB) 信号通路活化后,通过介导炎症因子释放,破坏机体免疫应答,参与肺结核的发病过程。微小RNA (microRNA,miRNA) 是一类由内源基因编码的长度约为22 个核苷酸的非编码单链RNA 分子,其中miR-27a 可通过降低TLR4 表达,抑制脂多糖诱导的小胶质细胞炎症因子的产生[6]。同时JU 等[7]研究发现:miR-27a 可通过阻断TLR4/髓样分化因子88(myeloid differentiation factor 88,MyD88) /NF-κB通路,减轻急性肺损伤小鼠的机体炎症反应,减少细胞凋亡。推测miR-27a 可能会通过调控TLR4/NF- κB 信号通路改善肺结核大鼠肺损伤,但miR-27a 对肺结核的具体作用机制目前鲜有报道。本研究通过建立肺结核大鼠模型,探讨miR-27a 对肺结核大鼠免疫功能的影响及其可能机制,以期为肺结核的临床治疗提供有效的治疗靶点。
1 材料与方法
1.1 实验动物、菌株、主要试剂和仪器SPF 级雄性SD 大鼠48 只,6 周龄,体质量200~250 g,购自北京生命科学研究所动物实验中心,动物生产许可证号: SCXK (京) 2019-0002。大鼠于室温22 ℃~24 ℃和相对湿度50%~70% 环境下饲养,定时更换垫料,自由饮水摄食。结核杆菌标准株H37RV 购自美国ATCC 公司,采用几何稀释法对结核杆菌标准株H37RV 菌液进行稀释,于培养皿内用罗氏培养基培养H37RV,待菌落生长良好,加入0.5% Tween 80 轻轻摇动,与无菌生理盐水混合后,使用菌液浓度标准比浊管比浊,配制成浓度为5 g·L-1的结核杆菌悬液。miR-27a 激动剂(miR-27a agomir) 和激动剂对照(agomir-NC) 购自苏州吉玛基因股份有限公司,TLR4、NF-κB 抑制蛋白α (inhibitor α of NF- κB ,IκB α)、 磷酸化IκB (p-IκB,Ser32/36)、 NF- κB p65、 β -actin 及CD3、 CD4 和CD8 抗体均购自英国Abcam 公司,HE 染色试剂盒和BCA 试剂盒购自北京索莱宝科技有限公司,大鼠白细胞介素1β (interleukin-1β,IL-1β)、白细胞介素6 (interleukin-1,IL-6) 和肿瘤坏死因子α (tumor necrosis factor-α,TNF-α) 酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA) 试剂盒购自武汉赛培生物科技有限公司,GenEluteTM总RNA 纯化试剂盒购自德国默克公司,RNA 反转录试剂盒和SYBR Premix Ex Taq 试剂盒购自日本TaKaRa 公司。CytoFLEX 流式细胞仪和DTX 880/800 多功能酶标仪购自美国贝克曼库尔特有限公司,Veriti 7500 实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR) 仪购自美国Applied Biosystems 公司。
1.2 实验动物模型制备和分组按照参考文献[8] 中的方法,经大鼠尾静脉注射200 μL 结核杆菌悬液(5 g·L-1) 建立肺结核大鼠模型,血液检查及结核菌素试验确认造模成功后进行分组,剔除尾部苍白肿胀或局部坏死大鼠。将造模成功的大鼠随机分为模型组、agomir-NC 组和agomir 组,另取正常大鼠设为对照组,每组12 只。agomir-NC 组和agomir 组大鼠分别经尾静脉注射25 mg·kg-1的agomir-NC 或miR-27a agomir 干预,对照组和模型组大鼠注射等量溶剂,每天1 次,连续5 d,3 周后进行后续实验。
1.3 各组大鼠胸腺指数和脾脏指数计算取各组大鼠脾脏和胸腺组织,剔除脂肪,经PBS 缓冲液漂洗后滤纸吸干表面液体,于电子天平上精密测量,计算大鼠胸腺和脾脏指数。腺胸(脾脏) 指数=胸腺(脾脏) 质量(mg) /大鼠体质量(g)。
1.4 HE 染色观察各组大鼠肺组织病理形态表现取各组大鼠肺组织,于4% 中性甲醛中固定24 h,酒精浓度由低至高对组织进行脱水,二甲苯透明,随后进行石蜡包埋,并于切片机上作厚度为5 μm 的连续切片,脱蜡后苏木精染色6 min,流水冲洗至返蓝,随后伊红染色4 min,中性树胶封片,于光学显微镜下观察各组大鼠肺组织病理形态表现。
1.5 流式细胞术检测各组大鼠外周血中T 淋巴细胞亚群百分率取2 mL 全血于肝素钠溶液中抗凝,分别加入CD3、CD4 和CD8 抗体混匀后室温孵育20 min,然后加入溶血素继续孵育20 min,于流式细胞仪下检测大鼠外周血中T 淋巴细胞亚群中CD4+T 淋巴细胞(CD3+CD4+ 双阳性细胞亚群) 和CD8+T 淋巴细胞(CD3+CD8+双阳性细胞亚群) 绝对数,计算CD4+T 细胞和CD8+T 细胞百分率。
1.6 ELISA 法检测各组大鼠肺组织中IL-1β 、IL-6 和TNF-α 水平取各组大鼠肺组织,加入适量生理盐水匀浆,4 ℃、4 500 r·min-1离心10 min,取上清液,严格按照试剂盒说明书要求操作后,采用酶标仪于波长405 nm 处测定吸光度(A) 值,并计算大鼠肺组织中IL-1β、IL-6 和TNF-α 水平。
1.7 RT-qPCR 法检测各组大鼠肺组织中miR-27a表达水平取各组大鼠肺组织,采用RNA 提取试剂盒提取总RNA,并测定纯度及浓度,按照反转录试剂盒操作,将RNA 反转录为cDNA,采用SYBR Premix Ex Taq 试剂盒进行扩增,扩增体系包括cDNA 1 μL、 上下游引物各0.5 μL 和SYBR 10 μL,再用无RNA 酶水补足至20 μL。引物序列:miR-27a,上游引物5′-TTCACAGTGGCTAAGTTCCGC-3′,下游引物5′-GCGGAACTTAGCCACTGTGA-3′,21 bp; U6,上游引物5′-CTC GCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′,92 bp。反应条件: 95 ℃预变性30 s,60 ℃退火30 s,60 ℃延伸30 s,40 个循环。以U6 为内参,采用2-ΔΔCT法计算各组大鼠肺组织中miR-27a 表达水平。
1.8 Western blotting 法检测大鼠肺组织中TLR4、IκB、p-IκB 和NF-κB p65 蛋白表达水平取各组大鼠肺组织,加入RIPA 裂解液提取总蛋白,采用BCA 试剂盒进行蛋白定量,取20 μg 总蛋白于10%聚丙烯酰胺凝胶(SDS-PAGE) 恒压电泳,湿转法转至聚偏二氟乙烯(PVDF) 膜,随后脱脂奶粉封闭1 h,加入一抗(TLR4、IκB、p-IκB、NF-κB p65 和β-actin 抗体,均以1∶1 000 稀释) 稀释液,4 ℃孵育过夜,加入二抗(1∶10 000 稀释) 稀释液,室温孵育2 h,ECL 显色后,采用Image J 进行条带分析,以β-actin 为内参,计算大鼠肺组织中TLR4、 IκB、 p-IκB 和NF-κB p65 蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.9 统计学分析采用SPSS 20.0 统计软件进行统计学分析。各组大鼠胸腺和脾脏指数,外周血中CD4+T 淋巴细胞和CD8+T 淋巴细胞百分率,肺组织中IL-1β、IL-6和TNF-α水平,肺组织中miR-27a表达水平和TLR4、IκB、p-IκB 及NF-κB p65 蛋白表达水平,均符合正态分布,以x±s 表示。多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t法。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠胸腺和脾脏指数对照组、模型组、agomir-NC 组和agomir 组大鼠胸腺指数分别为(1.46±0.08)、(0.81±0.03)、(0.86±0.05) 和(1.50±0.02) mg·g-1,脾脏指数分别为(2.73±0.06)、(2.04±0.05)、(2.17±0.03) 和(2.76±0.05) mg·g-1,组间比较差异有统计学意义(P<0.05)。与对照组比较,模型组大鼠胸腺和脾脏指数明显降低(P<0.05); 与模型组比较,agomir 组大鼠胸腺和脾脏指数明显升高(P<0.05),agomir-NC 组大鼠胸腺和脾脏指数差异无统计学意义(P>0.05)。
2.2 各组大鼠肺组织病理形态表现对照组大鼠肺组织中肺泡清晰可见,结构正常,未见炎性细胞浸润;模型组和agomir-NC 组大鼠肺组织中肺泡变形,大量炎性细胞浸润,出现部分实变结节;agomir 组大鼠肺组织结构趋于正常,炎性细胞浸润和实变结节明显改善。见图1。

图1 各组大鼠肺组织病理形态表现(HE,×200)Fig.1 Pathomorphology of lung tissue of rats in various groups(HE,×200)
2.3 各组大鼠肺组织中miR-27a 表达水平对照组、模型组、agomir-NC 组和agomir 组大鼠肺组织中miR-27a 表达水平分别为1.00±0.02、 0.43±0.04、 0.41±0.03 和6.98±0.24,组间比较差异有统计学意义(P<0.05)。与对照组比较,模型组大鼠肺组织中miR-27a 表达水平明显降低(P<0.05); 与模型组比较,agomir 组大鼠肺组织中miR-27a 表达水平明显升高(P<0.05),agomir-NC 组大鼠肺组织中miR-27a 表达水平差异无统计学意义(P>0.05)。
2.4 各组大鼠外周血中不同T 淋巴细胞亚群百分率对照组、模型组、agomir-NC 组和agomir 组大鼠外周血中CD4+T 淋巴细胞百分率分别为(35.29±5.23) %、(21.57±3.82) %、(23.01±4.29) % 和(32.92±3.66) %,CD8+T 淋巴细胞百分率分别为(22.04±3.16) % 、(45.52±6.30)%、(44.17±5.48)%和(26.09±4.15)%,各组大鼠外周血中不同T 淋巴细胞百分率比较差异有统计学意义(P<0.05)。与对照组比较,模型组大鼠外周血中CD4+T 淋巴细胞百分率明显降低(P<0.05),CD8+T 淋巴细胞百分率明显升高(P<0.05);与模型组比较,agomir 组大鼠外周血中CD4+T 淋巴细胞百分率明显升高(P<0.05),CD8+T 淋巴细胞百分率明显降低(P<0.05),agomir-NC 组大鼠外周血中不同T 淋巴细胞百分率差异无统计学意义(P>0.05)。
2.5 各组大鼠肺组织中IL-1β、IL-6 和TNF-α 水平与对照组比较,模型组大鼠肺组织中IL-1β、IL-6 和TNF-α 水平明显升高(P<0.05);与模型组比较,agomir 组大鼠肺组织中IL-1β、 IL-6 和TNF-α 水平明显降低(P<0.05),agomir-NC 组大鼠肺组织中IL-1β、IL-6 和TNF-α 水平差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠肺组织中IL-1β、IL-6 和TNF-α 水平Tab.1 Levels of IL-1β, IL-6 and TNF-α in lung tissue of rats in various groups (n=12,±s,ρB/(ng·L-1)]

表1 各组大鼠肺组织中IL-1β、IL-6 和TNF-α 水平Tab.1 Levels of IL-1β, IL-6 and TNF-α in lung tissue of rats in various groups (n=12,±s,ρB/(ng·L-1)]
*P<0.05 compared with control group;△P<0.05 compared with model group.
G r o u p C o n t r o l M o d e l A g o m i r-N C A g o m i r I L-1 β 3 7.5 2±5.0 7 1 0 9.3 3±1 4.6 5*1 0 4.5 8±1 1.4 2 5 0.9 2±9.1 7△I L-6 2 9.0 4±4.3 6 7 4.3 5±1 1.0 5*7 2.6 0±9.2 8 4 1.4 2±7.3 1△T N F-α 8 3.7 7±6.4 5 1 6 8.1 3±1 3.3 0*1 7 1.4 9±1 2.4 9 9 6.8 2±9.3 6△
2.6 各组大鼠肺组织中TLR4/NF-κB 信号通路相关蛋白表达水平与对照组比较,模型组大鼠肺组织中TLR4、p-IκB 和NF-κB p65 蛋白表达水平明显升高(P<0.05),IκB 蛋白表达水平明显降低(P<0.05);与模型组比较,agomir 组大鼠肺组织中TLR4、p-IκB 和NF-κB p65 蛋白表达水平明显降低(P<0.05),IκB 蛋白表达水平明显升高(P<0.05),agomir-NC 组大鼠肺组织中上述各蛋白表达水平差异无统计学意义(P>0.05)。见图2和表2。
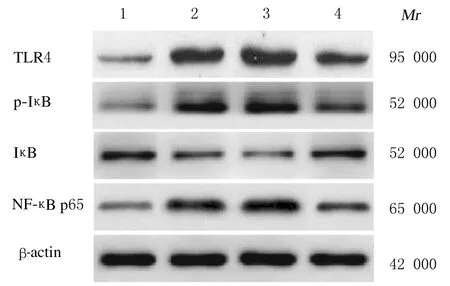
图2 各组大鼠肺组织中TLR4、IκB、p-IκB 和NF-κB p65 蛋白表达电泳图Fig.2 Electrophoregram of expressions of TLR4,IκB, p-IκB and NF- κB p65 proteins in lung tissue of rats in various groups
表2 各组大鼠肺组织中TLR4/NF-κB 信号通路相关蛋白表达水平Tab.2 Expression levels of TLR4/NF- κB signaling pathway related proteins in lung tissue of rats in various groups(n=12,±s)

表2 各组大鼠肺组织中TLR4/NF-κB 信号通路相关蛋白表达水平Tab.2 Expression levels of TLR4/NF- κB signaling pathway related proteins in lung tissue of rats in various groups(n=12,±s)
*P<0.05 compared with control group;△P<0.05 compared with model group.
G r o u p C o n t r o l M o d e l A g o m i r-N C A g o m i r T L R 4 0.1 2±0.0 3 0.7 4±0.0 8*0.7 7±0.0 6 0.4 3±0.0 4△p-I κ B 0.0 5±0.0 1 0.8 3±0.0 4*0.8 5±0.0 3 0.2 8±0.0 2△I κ B 0.5 8±0.0 2 0.1 8±0.0 2*0.1 5±0.0 1 0.6 1±0.0 3△N F-κ B p 6 5 0.1 1±0.0 6 0.6 7±0.0 2*0.7 1±0.0 2 0.3 2±0.0 3△
3 讨 论
肺结核是一种免疫性疾病,机体免疫水平的高低是影响其发病率的重要因素之一,人体靠固有免疫和适应性免疫抵抗结核杆菌的侵袭[9]。在结核杆菌刺激下,大量炎症因子释放,导致机体损伤加重,部分细胞因子通过免疫调节和抑制炎症反应发挥作用,改善肺结核导致的组织损伤[10]。miRNA因相对分子质量较小,可通过结合靶基因的3′非翻译区调节相关蛋白的表达水平,部分miRNA 在代谢和免疫调节方面发挥重要作用,同时参与结核病中的结核杆菌调控[11-12]。LIU 等[13]研究发现:miR-27a 在结核病患者体内高表达,同时miR-27a可通过靶向调节钙离子(Ca2+) 相关自噬,控制结核杆菌在细胞内的生存。然而,关于miR-27a 对肺结核的机体免疫调节能力和对组织的保护作用及其机制尚未见报道。本研究通过miR-27a agomir 干预肺结核模型大鼠,RT-qPCR 检测结果显示: 经miR-27a agomir 干预后,大鼠肺组织中miR-27a 表达水平明显升高。
以T 淋巴细胞为主、其他细胞因子为辅参与的免疫应答,在肺结核的发展过程中发挥重要作用,其中CD4+T 淋巴细胞在肺结核患者体内表达水平较非结核人群明显降低,其通过激活巨噬细胞对抗结核杆菌的生长[14]。CD8+T 淋巴细胞被称为细胞毒性T 淋巴细胞,可识别被感染的吞噬细胞,通过生成穿孔素,使细胞内的结核杆菌被附近的巨噬细胞吞噬[15]。CD4+T 淋巴细胞通过识别细胞外感染促进细胞免疫,CD8+T 淋巴细胞通过识别细胞内感染抑制结核杆菌繁殖,共同维持着机体的免疫水平稳定。同时,胸腺和脾脏作为人体内的重要免疫器官,其指数高低反映机体的免疫水平[16]。本研究结果显示:与对照组比较,模型组大鼠胸腺和脾脏指数及外周血中CD4+T 淋巴细胞百分率明显降低,CD8+T 淋巴细胞百分率明显升高,说明肺结核大鼠免疫水平降低,结核杆菌大量繁殖导致CD8+T 淋巴细胞聚集;经miR-27a agomir 干预后,大鼠胸腺和脾脏指数及外周血中CD4+T 淋巴细胞百分率明显升高,CD8+T 淋巴细胞百分率明显降低,说明过表达miR-27a 可通过调节机体免疫应答,改善肺结核大鼠机体免疫水平。
Toll 样受体(Toll-like receptor,TLR) 是连接非特异性免疫和特异性免疫的重要蛋白分子,参与类风湿性关节炎和溃疡性结肠炎等免疫性疾病的发生发展[17-18]。其中TLR4 位于NF-κB 信号通路的上游,可通过激活下游的NF-κB 促进IL-1β、IL-6和TNF-α 等炎症因子释放,加重机体炎症损伤[19]。有研究[20-21]表明: miR-27a 可通过抑制TLR4 表达,减轻肾缺血再灌注和脊髓损伤过程中的炎症反应。推测miR-27a 可能通过靶向沉默TLR4 基因表达,抑制TLR4/NF-κB 信号通路活化,从而减轻肺结核导致的肺组织炎症损伤。NF-κB 由p50 和p65 2 个亚基组成,存在于机体内的多种细胞中,在炎症反应和免疫应答中起关键作用。正常生理状态下,NF-κB 与其抑制蛋白IκB 结合,以非活性形式存在于胞浆中,当受到外界细胞因子刺激时IκB被磷酸化,与活化的p50/p65 异源二聚体分离,发生核移位,p50/p65 异源二聚体进入细胞核后引起相关基因转录,从而导致炎症因子的释放[22]。本研究结果显示:模型组大鼠肺组织损伤严重,肺组织中IL-1β、 IL-6、 TNF- α 水平和TLR4、 p-IκB、NF-κB p65 蛋白表达水平明显升高,而IκB 蛋白表达水平明显降低,标志着TLR4/NF-κB 信号通路的激活导致了肺组织中炎症因子的释放;经miR-27a agomir 干预后,大鼠肺组织损伤得到明显改善,肺组织中IL-1β、IL-6、TNF-α 水平和TLR4、p-IκB、NF-κB p65 蛋白表达水平明显降低,而IκB蛋白表达水平明显升高,说明过表达miR-27a 可通过抑制TLR4/NF-κB 信号通路活化,减少炎症因子释放,改善肺结核大鼠肺组织损伤。
综上所述,过表达miR-27a 可保护肺结核大鼠肺组织,减轻肺组织损伤,其机制是通过抑制TLR4/NF-κB 信号通路,减少炎症因子释放,同时调节机体免疫反应实现的,本研究结果为肺结核临床治疗的靶向药物研究提供了依据。

