中子俘获剂RGD-PEI-AON-(157Gd-DTPA)n治疗荷人甲状腺未分化癌裸鼠模型的研究
王舰 权友琼 章步程 李俊江 高美佳 楼岑
目前,中子俘获治疗的国内研究主要应用于脑肿瘤,俘获剂的摄取主要是通过破坏的血脑屏障进入肿瘤组织,因此在其他肿瘤中的应用受到限制。但国外俘获剂的研究方向已向靶向性和DNA 结合特性发展,比如有用单抗作为携带剂以提高靶向性[1],也有用配体连接脂质体作为转运载体以提高转运效率[2,3]。本次研究完成中子俘获剂RGD-PEIAON-(157Gd-DTPA)n 在体内生物学分布、治疗甲状腺未分化癌(anaplastic thyroid carcinoma,ATC)裸鼠模型的疗效分析,如肿瘤抑制率等指标评估,并观察俘获剂组治疗后肿瘤局部皮肤及病理学变化情况。现报道如下。
1 资料与方法
1.1 一般资料 选择2021 年1 月至2021 年6 月期间浙江大学医学院附属邵逸夫医院中心实验室的雄性Balb/c 裸鼠27 只,年龄约5~6 周龄,体质量约18~20 g。ATC 细胞株均购于中国科学院上海药物研究所。
1.2 方法 首先进行动物模型的制备。收集ATC细胞株,按照5×107个/ml 悬浮于DMEM 培养基中,待裸鼠适应1 周后,注射0.1 ml(5×107个/ml)瘤细胞液于裸鼠的甲状腺组织中,接种2 周后,瘤体长至平均直径1.0~1.5 cm,无自然消退现象。此时表明裸鼠植瘤模型制备成功,可进一步进行体内治疗实验。取实验用荷瘤鼠27 只,并随机分为:俘获剂组、γ 射线组及未照射组三个组,每组9 只。将RGD-PEI-AON-(157Gd-DTPA)n 行裸鼠静脉注射后进入肿瘤瘤体内,并单独饲养。给予相关治疗后,通过放射免疫显像仪器SPECT/CT,高能通用型准直器,放大倍数,预置计数1×105。画取全鼠、瘤体和除瘤体外全鼠的感兴趣区,计算瘤体与周围不同组织的靶/非靶摄取比值(target to nontarget ratio,T/N)。观察俘获剂注入后第1、3、7 天的T/N比值,并在治疗前及治疗后7 d,分别测肿瘤瘤体长径、瘤体体积变化及肿瘤抑制率。最后脱颈椎处死裸鼠,分离瘤体、心脏、肝脏、肾脏等,并分别将其在10%福尔马林溶液中常规脱水、固定、石蜡包埋级苏木精-伊红染色,观察各组肿瘤局部皮肤及病理学变化。如:荷瘤局部外部皮肤是否出现红肿、水泡、破溃及瘢痕等情况。病理学变化则由2 名资深病理科医师独立判定。在染色区域随机选择5 个视野,每个视野计数80 个细胞,并电镜检查细胞及组织的结构变化。
1.3 统计学方法 采用SPSS 19.0 统计学软件进行数据分析。呈正态分布的计量资料以均数±标准差()表示。组间计量资料比较采用t检验;计数资料比较采用χ2检验。设P<0.05 为差异有统计学意义。
2 结果
2.1 俘获剂在荷人ATC 裸鼠模型中的T/N 比值见表1
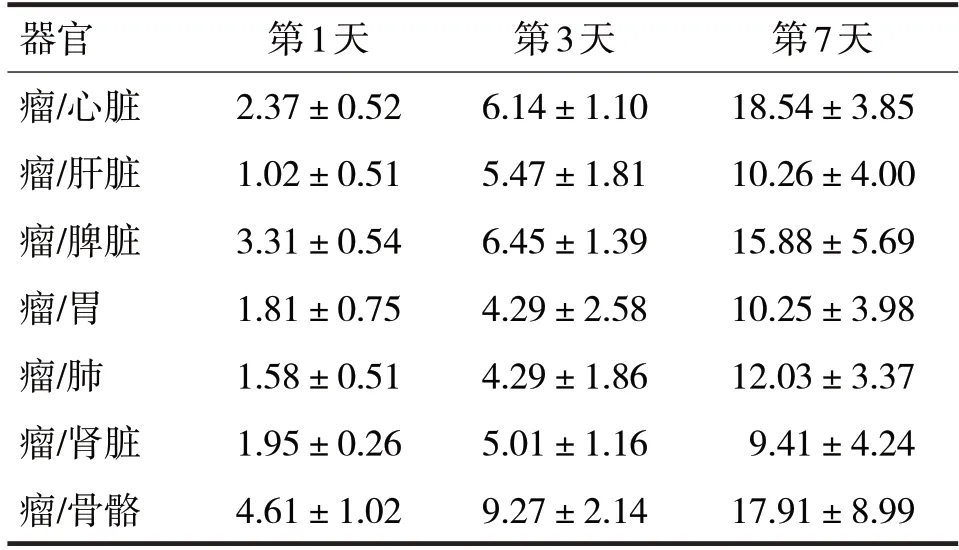
表1 俘获剂在荷人ATC裸鼠模型中的T/N比值
由表1 可见,静脉给药后,俘获剂除在甲状腺瘤体分布之外,尚有部分分布在其他正常组织中,如:心脏、肝脏、肺部及胃部等。但随时间推移,ATC 瘤体与非瘤体组织的T/N 比值会逐渐偏高,实验追踪至第7 天,T/N 比值仍维持在较高水准,表明俘获剂在正常组织中并没有较高的特异性吸收。
2.2 各组治疗前后的肿瘤长径及体积比较见表2
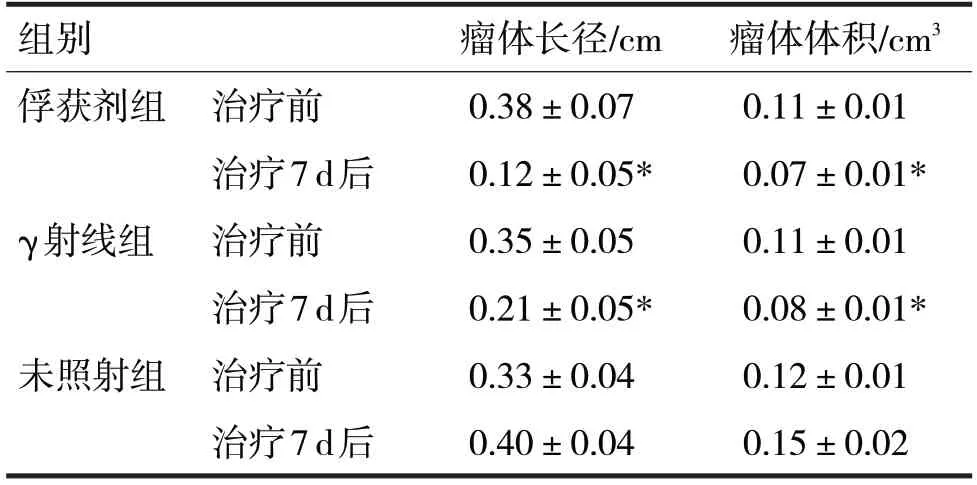
表2 各组治疗前后的肿瘤长径及体积比较
由表2 可见,在治疗7 d 后,俘获剂组及γ 射线组患者的肿瘤长径较未照射组明显缩小,差异均有统计学意义(t分别=18.39、17.21,P均<0.05)。俘获剂组及γ 射线组患者治疗后瘤体体积较未照射组明显缩小,差异均有统计学意义(t分别=15.18、14.32,P均<0.05)。未照射组患者治疗后肿瘤长径及体积高于治疗前,差异均无统计意义(t分别=0.56、0.98,P均>0.05)。
2.3 治疗后肿瘤抑制率 俘获剂在荷人ATC 裸鼠经俘获剂及γ射线分别治疗7 d后,肿瘤抑制率分别为(0.97±0.01)%和(0.93±0.02)%,俘获剂组肿瘤抑制率高于γ 射线组,差异有统计学意义(t=10.21,P<0.05)。
2.4 肿瘤局部皮肤及病理学变化 各组小鼠经连续观察7 d,俘获剂组及未照射组小鼠肿瘤局部皮肤未出现明显红、热等炎症相关反应,γ 射线组小鼠则在第7 天时出现较为明显的红、热等炎症相关反应。γ 射线组肿瘤组织处皮肤出现局部溃疡征象,而俘获剂组及未照射组仍无此反应。病理结果显示:俘获剂组切片出现一系列的相关性病理变化,肿瘤细胞破坏严重,可见大片凝固样坏死区,伴有少数凋亡细胞,肿瘤细胞核染色质固缩、破裂,并存在凋亡小体;未照射组未见水肿、纤维化等相关变化,肿瘤细胞呈增殖性增长。
3 讨论
中子俘获治疗肿瘤的设想于1936 年由Locher首次提出,其原理是将无放射性的亲肿瘤化合物注入体内,尽可能使其高度浓聚在肿瘤组织中,然后用中子线局部照射肿瘤,使化合物中核素吸收中子后产生核反应,其次级辐射直接作用于肿瘤细胞达到杀伤肿瘤细胞的治疗目的。
中子俘获治疗涉及多种新兴学科,采用多种高技术,具有极强的综合性与复杂性。迄今虽在脑胶质瘤与黑色素瘤的治疗中取得一定进展,但无论机理或是临床技术都仍处于不断的探究中,包括输送核反应靶元素进入肿瘤的化合物、提供照射的中子束及其能域,以及体现综合疗效的体内辐射剂量分布等都是影响中子俘获治疗成败的关键要素[4~6]。
放射生物学研究证实,影响肿瘤放疗后形态学改变的主要因素包括治疗方式(射线能量及剂量率)、剂量、肿瘤组织类型、分化程度及其血供情况等。因中子俘获治疗肿瘤具备上述优势,如:靶向性及局部辐射剂量大、适用范围广、易防护及副作用小等优点,且有研究表明中子俘获治疗能抑制癌前期病变的进一步发展[7],因此,中子俘获治疗已被认为是肿瘤治疗最具潜力的二元放疗方法[8]。目前国外的中子俘获治疗研究主要集中在脑胶质细胞瘤、恶性黑色素瘤及结肠癌转移性肝癌患者,对于ATC患者的治疗鲜有报道。
本次研究得到的阶段性结论表明,RGD-PEIAON-(157Gd-DTPA)n 在荷人ATC 裸鼠模型中,其正常组织器官中没有特异性吸收。T/N 比值维持在较高水准,说明俘获剂明显强化了ATC 的局部控制率,且副作用却未见明显增加,故可以达到优化及靶向治疗肿瘤的作用。这为临床应用其治疗肿瘤提供了依据。
本次研究通过肉眼、光镜及病理学观察与分析,俘获剂RGD-PEI-AON-(157Gd-DTPA)n 可以通过促使细胞凋亡、直接杀伤肿瘤细胞及抑制肿瘤细胞增殖的方式,对荷人ATC 裸鼠肿瘤细胞的线粒体、内质网、核酸等造成损伤,抑制其能量、蛋白质、核酸代谢,导致肿瘤细胞凋亡,且俘获剂组较γ 射线组肿瘤抑制率明显增高(P<0.05)。另外,RGD-PEI-AON-(157Gd-DTPA)n 在ATC 裸鼠体内的生物学分布特点,亦有可能为该肿瘤的治疗提供帮助。
综上所述,RGD-PEI-AON-(157Gd-DTPA)n 治疗ATC 是一种安全、有效、可行的方法。本次研究存在样本量较少、观察指标较少及观察时间较短等不足之处,且在临床应用的安全性及治疗效果、以及对其他类型的肿瘤的亲和力方面仍需进一步研究与观察,后续将进一步扩大样本量及观察指标、延长观察时间,以便开展更为严格的相关研究。

