血液抽吸联合射频消融治疗肝血管瘤患者疗效研究*
任文妍,赵 森,庄 琰,杜 森,李秋实
肝血管瘤(hepatic hemangioma,HCH)是一种因先天发育异常、激素刺激等因素导致的良性肝脏肿瘤,临床发病类型以单发为主,多发较少,大部分HCH患者无明显的临床症状,往往于体检或其他原因就诊时被发现[1,2]。针对HCH患者,临床多采取门诊随访的方法予以观察处理,但对于症状明显或短期内增长明显的患者则需要采取医学干预,如射频消融(radiofrequency ablation,RFA)、肝动脉插管栓塞(transcatheter arterial embolization,TAE)等治疗。在既往的研究中,已有相关学者指出对于单发较大瘤体的HCH患者行外科手术治疗是一种安全有效的方法,但外科手术治疗也会对正常肝组织产生损伤,且术中术后均有出血的风险[3,4],而RFA和TAE则是现阶段治疗HCH的常用方法,治疗效果也较好[5-7]。为寻找治疗HCH的新方案,本研究结合既往临床治疗经验,依据HCH的血供和组织结构特征对RFA治疗方案予以改进,即通过血液抽吸减轻瘤体张力后再行RFA,并与TAE治疗方案进行对照研究,以探讨RFA与血液抽吸联合治疗HCH患者的效果,旨在为HCH的治疗提供经验依据,现报道如下。
1 资料与方法
1.1 病例来源 2018年10月~2020年10月我科收治的HCH患者102例,男43例,女59例;平均年龄为(44.5±8.2)岁。均经影像学检查诊断为HCH[8,9]。排除标准:①肿瘤直径<5 cm或>10 cm;②既往有肝脏手术治疗史;③凝血功能异常;④合并严重的心脑血管疾病或肾功能异常;⑤Child-Pugh C级;⑥合并肝硬化等其他肝脏疾病;⑦合并恶性肿瘤。将患者分为TAE治疗组56例和血液抽吸联合RFA治疗组46例,两组基线资料比较,差异无统计学意义(P>0.05)。患者及其家属签署知情同意书,本研究开始前获得我院医学伦理委员会审核同意(伦理批号:2018-11号)。
1.2 治疗方法 在行TAE治疗时,患者取仰卧位,行局部麻醉,以Seldinger技术穿刺右侧股动脉,插管至病灶。经肘静脉快速团注造影剂声诺维(Sono Vue,Bracco公司)1.2~2.4 mL,明确血管瘤的大小、部位、数目和血供等信息。注入平阳霉素碘油乳剂8 mg栓塞。在此期间,及时行造影检查,评估栓塞效果,至瘤体周边门静脉小分支显影时停止栓塞,拔出导管,止血包扎;在行血液抽吸联合RFA治疗时,先行血液抽吸。使用Siemens Sequoia 512和Es-aota Mylab Twice型超声诊断仪行超声造影,造影剂为声诺维。全身麻醉,行常规消毒、铺巾,于超声引导下将18 G PTC针刺入瘤体,连接延长管后缓慢抽吸血窦腔内血液,同时送入17 G射频电极,于富血供血管和血窦腔放置射频电极和PTC针。待完成抽吸血液后,依据血管瘤初始大小和抽吸血液后血管瘤大小确定射频电极针分布点数和位置,再使用Cool-Tip冷循环射频消融仪行RFA治疗。初始功率设置为30 w,随后依据瘤体增温程度增加功率至100 w时止,单次消融时间<12 min。在消融时,依据血管瘤大小、血供情况行多次、多点消融,直至瘤体被完全消融后结束治疗。在消融期间,避免瘤体周围正常肝组织损伤。
1.3 疗效评估 使用超声诊断仪或CT检查观察肿瘤大小,计算瘤体容积和瘤体缩小率。瘤体容积(mL)=瘤体上下径(cm)×左右径(cm)×前后径(cm)×0.523;瘤体缩小率(%)=(治疗前瘤体容积-治疗后瘤体容积)/治疗前瘤体容积×100%
2 结果
2.1 治疗前后典型病例影像学变化 见图1。
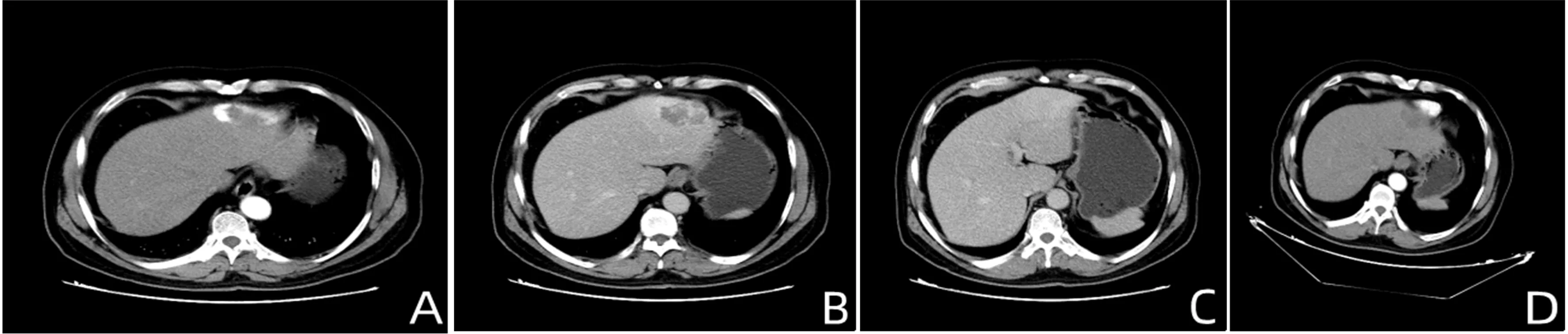
图1 HCH患者腹部CT表现A:CT增强扫描动脉期显示肝左叶血管瘤;B:静脉期病灶呈低密度灶;C:延迟期病灶几乎不显示;D:RFA治疗后
2.2 两组围术期相关临床指标比较 在行RFA治疗时,抽吸血液量为(128.6±59.8)ml。TAE组手术时间显著短于血液抽吸联合RFA治疗组(P<0.05),而术中出血量显著多于血液抽吸联合RFA治疗组,住院时间显著长于血液抽吸联合RFA治疗组(P<0.05,表1)。

表1 两组围术期相关指标比较
2.3 两组治疗后瘤体容积和瘤体缩小率比较 治疗后,两组瘤体容积和瘤体缩小率比较差异无统计学意义(P>0.05,表2)。

表2 两组瘤体容积和瘤体缩小率比较
2.3 两组术后并发症发生率比较 术后,血液抽吸联合RFA组并发症发生率显著地于TAE治疗(P<0.05,表3)。

表3 两组术后并发症发生率(%)比较
3 讨论
在既往的流行病学调查中显示,HCH发生率达0.4%~7.0%,可在任意年龄段发病,且女性群体发病占比要高于男性[10]。目前,临床上依据HCH的病理学类型将其区分为海绵状、毛细状、血管内皮细胞和硬化性血管瘤4类,而在临床诊治过程中则以海绵状血管瘤最为常见。既往治疗HCH多采取肝脏切除法,虽能有效去除病灶,但此种治疗方法可对患者造成较大的创伤,还会损伤正常肝组织。随着微创技术的快速发展,TAE和RFA开始逐渐应用于HCH的治疗,并获得了较好的治疗效果。由于它们具有微创的优势,日益受到青睐。然而不足的是TAE和RFA治疗后仍会有并发症的发生,如TAE治疗后可出现疼痛和发热等,而在RFA治疗后可出现出血、腹腔感染、肾功能损伤等并发症[11-13]。因此,为减轻并发症的发生,仍需积极寻找其他有效的治疗方法。本研究结合既往的治疗经验,采用先行瘤体内血液抽吸再进行RFA治疗,经对患者围术期相关指标及瘤体容积、瘤体缩小率和术后并发症发生率进行观察,以期寻找治疗HCH的方法改进。本研究结果显示,TAE组手术时间显著短于血液抽吸联合RFA组,术中出血量显著多于血液抽吸联合RFA组,住院时间显著长于血液抽吸联合RFA组,提示RFA治疗前行血液抽吸会延长手术时间,但在减少术中出血,缩短术后住院时间方面具有一定的优势。TAE是一种操作简单、微创的治疗HCH的方法,可通过导管将平阳霉素碘油乳剂送至瘤体,对血管内皮细胞产生破坏,在持续栓塞血管腔后使瘤体因缺乏营养而坏死、萎缩,最终促使瘤体闭塞。关于TAE治疗HCH的具体作用及机制在国内外已有较多学者研究报道,与本研究结果能相互印证[14-16]。RFA则是在超声造影的帮助下将射频针刺入瘤体,通过计算机控制射频波,使目标区域的组织凝固、坏死,在治疗期间完成1次射频消融治疗能够使5~7 cm的组织坏死。采用RFA治疗肝占位性病变具有微创、可重复操作的特点,且治疗效果确切,是治疗HCH、肝腺瘤、肝囊肿等疾病的有效方法[17]。观察不同方法治疗HCH的疗效发现,采用RFA和TAE均为治疗HCH的有效方法,可避免手术切除给患者带来的较大创伤,是无手术指征患者治疗的有效方案[18]。同时,本研究在RFA治疗前先行瘤体内血液抽吸,在减少瘤体内的血液后有利于增强射频电极的导热性,使能量更好地向周围传播,从而促使瘤体组织固化和坏死,并在血液抽吸结束后行RFA治疗过程中将起始功率调整为30 w,随后依据瘤体增温程度增加功率至100 w时止,能够避免温度快速升高造成的瘤体内压力增加而引起瘤体破裂的风险,从而减少了血液抽吸联合RFA治疗术中出血量。至于本研究中血液抽吸联合RFA治疗组手术时间明显延长可能与RFA实施前开展了血液抽吸有关。
在两组治疗后的疗效评估中发现两组瘤体容积和瘤体缩小率比较无显著性差异,但两组术后3个月瘤体容积和瘤体缩小率显著小于术后即刻,表明HCH患者经TEA或RFA治疗后能够缩小瘤体容积。肝动脉是血管瘤的主要供血动脉,在TAE治疗过程中能够使瘤体栓塞,形成血栓,在血栓机化和纤维化后能够使瘤体成为纤维瘤样结构,达到缩小血管瘤的作用,进而缩小瘤体容积[19]。RFA治疗可利用高频电磁波的热效应损毁瘤体,促使瘤体组织凝固、坏死,随后再通过机体的消化、吸收达到缩小瘤体容积的作用[20]。
在患者住院期间的观察过程中发现TAE治疗组术后并发症发生率为17.9%,显著高于血液抽吸联合RFA治疗组的6.5%,可见血液抽吸联合RFA治疗HCH能够减少患者住院期间的并发症发生率,这也是两组患者住院时间出现明显差异的重要原因。同时,由于国内鲜有关于血液抽吸联合RFA治疗HCH的报道,因此对于HCH患者在治疗过程中是否需要进行瘤体内血液抽吸,即其所发挥的实际作用仍有待继续深入探讨。
综上所述,相对于TAE治疗HCH患者,采用先血液抽吸再进行RFA治疗能够减少术中出血量,减少住院期间并发症的发生,进而缩短患者的住院时间,但无论TAE还是RFA治疗HCH患者均能达到缩小瘤体容积的作用,短期效果较好。

