18F-FDG PET/CT双期显像和MRI检查在诊断结直肠癌肝转移的对比研究
杨建峰 张雅萍 赵丽 夏阳 罗周烨 魏建国
结直肠癌患者常发生肝脏转移[1]。影像学是诊断结直肠癌肝脏转移重要的检查方法,MRI 凭借软组织分辨率高和弥散加权成像、动态增强等功能成像方法,被广泛应用于结直肠癌肝转移检查。18F-脱氧葡萄糖(fludeoxyglucose,FDG)PET/CT融合CT 扫描和PET 显像半定量检测病灶葡萄糖摄取,在结直肠癌肝转移诊断与分期及指导治疗具有重要意义[2]。如何合理选择运用MRI 或18F-FDG PET/CT 诊断结直肠癌肝转移尚无明确的参考意见。本次研究旨在比较MRI 检查和18F-FDG PET/CT 诊断结直肠癌肝转移的效能,以供临床选择合理的检查方法提供依据。现报道如下。
1 资料与方法
1.1 一般资料 选择2017 年3 月至2020 年12 月绍兴市人民医院收治的199 例病理确诊结直肠癌患者资料,所有患者均行18F-FDG PET/CT 检查,其中159 例未行肝脏双期显像(常规显像和延迟显像)被排除,剩余40 例中有1 例扫描参数设置错误,2 例同期未行肝脏MRI 检查被排除,最后37 个病灶纳入研究(36 例患者,有同一个患者3 年内检查2 次)。29 个病灶的肝内病灶性质经手术或穿刺病理确诊,8 个病灶经影像随访证实(6 个月至3 年内病灶增大和/或符合转移瘤乏血供环状强化模式提示转移,而长期大小形态及强化模式未有变化,提示良性)。本次研究经医院伦理委员会批准并获得患者知情同意书。最后27 个病灶经病理或随访证实肝内转移被纳入转移瘤组,10 个病灶证实肝内良性病灶被纳入良性组(炎性结节2 个、局灶性结节增生和再生结节5 个、其他术后改变3 个)。转移瘤组中男性14例、女性12 例;平均年龄为(60.40±7.90)岁;良性组中男性5 例、女性5 例;平均年龄为(62.11±9.69)岁。两组间的年龄、性别比较,差异均无统计学意义(P均>0.05)。
1.2 方法
1.2.1 MRI 检查 使用3.0T 和1.5T MR 扫描机和12 通道体部线圈,扫描方案:横断位T2 加权扰相自旋回波,TR/TE 1370/81,层厚6 mm,层间距1.2 mm,矩阵207 × 320,带宽220 kHz,弥散加权成像:TR/TE 7400/73,层厚6 mm,层间距1.2 mm,b值0,600 s/mm2,矩阵99 × 146,带宽180 kHz),T1 加权三维容积内插激励脂肪抑制序列:TR/TE 3.5/1.17 msec,层厚5 mm,间距1 mm,矩阵288×164,视野350 mm ×284 mm。对比剂以2.5 ml/s 的速率注入前臂静脉,随后以2 ml/s 的速度20 ml0.9%氯化钠注射液冲洗。注射对比剂后15 s 开始采集动脉期、门静脉期、平衡期和延迟期图像数据。所有图像传输至PACS工作站行图像分析。
1.2.2 PET/CT 检查 使用128 层GE PET/CT 扫描。患者在检查前血糖水平控制在11 mmol/L 以下,以0.1 mmol/kg 的剂量,静脉注射18F-FDG,60 min 后开始扫描。扫描范围从颅骨顶部到两侧大腿上段,扫描参数为:3.75 mm 层厚(120 kV,80 mAs),0.5 s 旋转时间,螺距0.984;FDG-PET 数据在同一位置上6~7 个床位(每个床位2 min)。从CT 获取的的数据重建为3.75 mm 层厚用于PET 的衰减校正。静脉注射18F-FDG 120 min 后按照早期扫描的参数对肝脏延迟扫描。PET 和CT 图像及融合的PET/CT 图像在工作站上观察。
1.3 病灶评价 两组诊断医师(每组1 位初、中级医师和1 位高级医师)分别在PACS 系统MR 图像和PET/CT 常规显像和延迟显像的图像上寻找病灶,确定病灶后在病灶边缘内约1 mm 画ROI(ROI 大小为1~3 cm2,避开肝内大血管),测量SUVmax 值,病灶SUVmax值>2.5作为诊断良恶性结节参考阈值[3]。最终结论由每组高级医师决定。在MRI 和PET/CT显像中以患者为研究对象,任何一种成像方法有1 个病灶漏诊或误诊既被认为该显像方法漏诊或误诊。评价两种检查诊断结直肠癌肝转移的效能,比较每组病例PET/CT双期显像和MRI的诊断准确率。
1.4 统计学方法 采用SPSS 22.0 统计学软件进行数据分析。计量资料以均数±标准差()表示。计量资料比较采用t检验;计数资料比较采用χ2检验和fisher确切概率法。设P<0.05 为差异有统计学意义。
2 结果
2.1 肝转移瘤组PET/CT 常规显像、延迟显像、MRI分别有5 例(7 个病灶)、2 例(3 个病灶)、3 例(5 个病灶)误诊为良性;在良性组中,常规显像、延迟显像、MRI 分别有2 例(2 个病灶)、1 例(1 个病灶)、8 例(9 个病灶)误诊为转移。
2.2 PET/CT 常规显像与延迟显像和MRI 诊断效能见表1
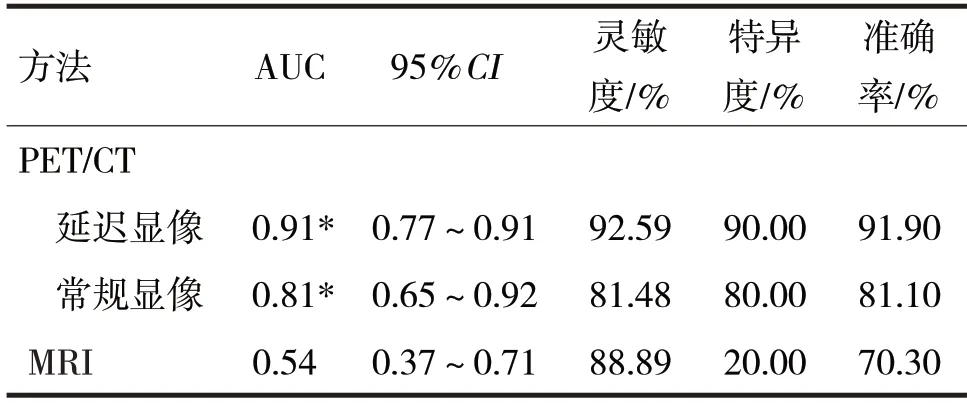
表1 PET/CT常规显像与延迟显像和MRI诊断效能比较
由表1 可见,PET/CT 双期显像在诊断结直肠癌肝转移的AUC 均高于MRI 检查(Z分别=4.44、2.93,P均<0.05),而常规显像与延迟显像之间的AUC 比较,差异无统计学意义(Z=1.80,P>0.05)。
2.3 转移瘤组和良性组的PET/CT 和MRI 诊断准确率比较 转移瘤组病例PET/CT 双期显像的准确率(0.93、0.82)与MRI 检查(0.89)比较,差异均无统计学意义(χ2分别=0.66、0.15,P均>0.05)。在良性组PET/CT 双期显像的准确率(0.90、0.80)明显高于MRI 检查(0.20),差异均有统计学意义(P均<0.05),而常规显像和延迟显像间的诊断准确率比较,差异无统计学意义(P>0.05)。
2.4 直肠癌术后肝内再生结节MRI 和PET/CT 检查示意图见封三图1
由封三图1可见,MRI显示肝IVa段渐进增大结节,诊断直肠癌肝转移瘤,PET/CT 双期显像提示良性结节。手术病理显示肝细胞条索状、梁索状增生,血窦丰富,细胞无异型性,诊断肝再生结节。
3 讨论
影像学在结直肠癌术前或者术后评估肝转移中具有重要作用。MRI凭借软组织分辨率高和弥散加权功能成像被认为是评估结直肠癌肝转移的一线检查方法[4]。据报道,以病灶为研究对象,MRI 检测结直肠癌肝转移的灵敏度为83.8%~89%[4,5],以病例为研究对象的灵敏度为87%[4]。与文献报道基本相似,本次研究中MRI 诊断结直肠癌肝转移的灵敏度为88.89%。结直肠癌患者术后化疗或术前的新辅助化疗会影响肝内微血管结构和渗透性及肝细胞损伤,导致肝细胞结节增生等病变[6]。结直肠癌患者MRI 检查时因为有结直肠癌病史而无肝硬化病史背景,易将化疗后所致肝细胞结节增生等良性病灶误诊为结直肠癌肝转移,导致MRI 检查特异度和阴性预测值较低。
PET/CT 兼具CT 高空间分辨率和PET 功能成像的优势,近年来在恶性肿瘤诊断、分期、疗效评价方面发挥重要作用。18F-FDG 是葡萄糖的同分异构体经已糖激酶磷酸化后的18F-FDG-PO4 不参与糖原合成和糖酵解而滞留在细胞内[7,8]。恶性肿瘤的FDG摄取与缺血缺氧因子1α、葡萄糖转运蛋白1 等代谢因子表达及肿瘤细胞增殖相关[8],一定时间范围内恶性肿瘤的FDG 摄取值逐渐增高。18F-FDG PET/CT对直径>10 mm 的结直肠癌肝转移准确率较高,以病灶为研究对象诊断结直肠癌肝转移的灵敏度为62.0%~72.0%[4],而以患者为研究对象的灵敏度达到88.0%~96.0%,但是对直径<10 mm的结直肠癌肝转移准确率较低[4,5]。本次研究中PET/CT 常规显像和延迟显像诊断结直肠癌肝转移的灵敏度分别为81.48%和92.59%,稍低于文献的报道的灵敏度,可能与本次研究病例中转移瘤直径较小有关。
肝内良性病灶的葡萄糖转运蛋白1 等代谢因子低表达而葡萄糖6磷酸酶含量较高导致FDG摄取相对较低,18F-FDG-PO4 清除相对较快。本次研究结果显示,转移瘤组病例的PET/CT 和MRI 检查准确率无明显差异,但是在良性组PET/CT的准确率明显高于MRI 检查,说明PET/CT 检查特别是延迟显像除具有较高的阳性预测值外,假阴性率较低。
PET/CT 诊断结直肠癌肝转移的效能受到正常肝组织FDG 摄取本底的影响。早期肝脏葡萄糖代谢旺盛,FDG 高摄取的背景下部分肝内病灶易被掩盖,经过一段时间后(约2 h)肝细胞内18F-FDG-PO4逐渐被葡萄糖-6-磷酸酶脱磷酸[6],肝细胞内FDG 含量减低有助于显示肝内高代谢病灶。PET/CT 延迟显像与常规显像的诊断效能虽未见明显差异,但延迟显像的诊断效能AUC值高于常规显像。
本次研究存在一些不足之处:①少部分结直肠癌肝转移和良性结节病例非手术病理证实而是影像学随访评估的临床诊断;②临床实践中提示良性病灶后失访率相对较高导致良性组病例较少,同时由于部分病例PET/CT 检查目的是明确增强CT 或MRI 已发现的肝内结节是否为转移瘤,故研究中主要以患者为对象而非以病灶为研究对象,导致病例数相对较少;③本次研究所有病例同时行PET/CT和MRI增强检查,当MRI检查发现病灶定性困难,但由于结直肠癌病史存在往往倾向于转移灶,导致假阴性率较高,可能存在一定偏倚。
综上所述,PET/CT 诊断结直肠癌肝转移的效能优于MRI 检查。由于化疗后肝细胞损伤等病理变化和早期肝脏本身FDG高代谢特点,PET/CT双期显像是提高诊断准确率和阴性预测值的有效方法。对于结直肠癌化疗后MRI 增强检查怀疑肝脏转移的病例建议行PET/CT双期显像检查。

