代表性二级处理、三级处理和湿地生态修复技术对城镇污水人源干细胞毒性的削减
宋京洋,李泽昌,杨婧,王思予,池勾剑,崔源源,赵静,刘薇
大连理工大学环境学院,工业生态与环境工程教育部重点实验室,大连 116024
污水经处理后回用于农田灌溉、城市景观补给、洗车和工业用水,甚至被用于饮用水,是应对淡水资源稀缺的重要替代水源。目前,污水处理厂通常以传统的活性污泥和膜生物反应器等处理技术为基础,尽管处理后排水的理化参数满足当地或行业相应的排放标准,但仍残留低浓度有毒物质或形成毒性产物[1]。例如,Xue等[2]研究发现,现行的污水处理工艺(例如砂滤、混凝、活性炭吸附和消毒)对内毒素的处理效果较低,再生水的回用使内毒素的人体暴露水平升高。此外,某二级处理排水样品中检测到了遗传毒性作用,而进水并未检测出遗传毒性,可能在处理过程中形成了遗传毒物[3]。再生水中残留的有毒有害污染物可以通过多种暴露途径直接或间接对人体健康产生有害影响。因此,须对再生水回用进行综合毒性评估,有利于保障再生水回用的安全性[4]。欧美许多国家已开始推行毒性评估废水管理法律法规[5]。发光细菌、藻类和鱼类等水生生物毒性评估结果无法直接外推至人体健康,基于大鼠小鼠等哺乳动物实验仍存在种属差异的问题,同时受伦理学和周期成本等限制。
体外生物毒性测试在复合型污染特征下可敏感、准确地量化环境混合物的综合生物效应[6],但目前仍较为缺乏面向人体健康的体外生物毒性模型。本研究选择人骨髓间充质干细胞(hBMSCs)为体外模型,评估典型二级处理、三级处理和湿地修复技术对污水综合毒性的削减。人源干细胞是一种前景良好的体外毒理学模型,目前已应用于典型环境污染物的毒性预测、评估和毒性机制解析,但在环境复合污染毒性评估中的应用极为有限。笔者在前期研究中,利用hBMSCs研究地表水的毒性特征,结果表明基于hBMSCs的测试对水体复合污染在分子和细胞水平造成的有害效应具有良好的灵敏性、重现性及人体健康相关性[7-8]。此外,本研究将基于人源干细胞的综合毒性评价结果与常用的发光菌急性毒性测试进行比较。研究结果有助于更好地了解人源干细胞对水体复合污染的毒性响应特征,为排水的人体健康效应评估以及提升水处理技术的毒性削减效能提供科学依据和参考方法。
1 材料与方法(Materials and methods)
1.1 样品采集及前处理
水样采自大连市、沈阳市和哈尔滨市的4个城镇二级污水处理厂(A~D)、天津某再生水厂(E)和海口市某湿地公园(F)。采集各厂进水、主要工艺出水和最终出水,以超纯水作为流程空白。城镇二级污水处理厂(A~D)主要工艺均由活性污泥法和紫外消毒工艺组成,且进水主要来源为生活污水混有少量的工业废水。再生水厂(E)的进水主要来源为多个城镇二级污水处理厂排水,经混凝、微滤、反渗透和臭氧氧化三级处理工艺再次处理后排放回用。湿地公园(F)的进水主要为生活污水,预处理后经梯级潜流湿地和河流型湿地处理排放。A~F厂最终出水化学需氧量(COD)和氨氮均达到《城镇污水处理厂污染物排放标准》一级A标准,并回用于城市杂用水、景观用水和河道补给(图1)。
采集水样贮存在塑料桶中,立即运回实验室。用0.7 μm(Waters, GF/B, 47 mm)玻璃纤维滤膜过滤水样后,在实验室进行COD和氨氮理化参数的测定[9]。将水样进行富集浓缩,采用HLB(6 mL, 500 mg, OASIS, Waters, USA)萃取柱萃取水中有机物,用二氯甲烷和甲醇进行洗脱,将洗脱液经氮吹后用200 μL二甲基亚砜(DMSO)定容[10]。
1.2 发光菌急性毒性实验
明亮发光杆菌T3小种(PhotobacteriumphosphoreumT3spp)购自浙江清华长三角研究院(浙江,中国)。将1 mL复苏液注入装有冻干粉的安瓿瓶中,充分混匀。2 min后在暗室中可肉眼观察到菌液发光,即复苏完成。采用3% NaCl(m∶m)稀释浓缩菌液至合适浓度,作为后续测试菌液。实验采用3% NaCl作为空白对照,并用3% NaCl稀释水样。根据预实验已确定正式实验浓度范围,设定不同梯度浓度的水样作为实验组。明亮发光杆菌菌液与水样充分混匀15 min后,用原子摩尔冷光检测仪(Lumin Max-C, Maxwell Sensors Inc)测定明亮发光杆菌的发光强度。每个实验组设置3个平行,重复实验结果的相对标准偏差(relative standard deviation, RSD)均<30%。发光菌的发光强度相对抑制率与各工艺出水急性毒性成正比,计算公式如下:

1.3 细胞毒性实验
人骨髓间充质干细胞(human bone marrow mesenchymal stem cells, hBMSCs)购自广州赛业公司(广州,中国)。培养条件控制为37 ℃、5% CO2和饱和湿度,细胞复苏、传代至6代进行实验。细胞生长至汇合度达到85%以上时,进行消化接板。含有0.1% DMSO(V∶V)的培养基设为对照组,根据预实验已确定正式实验浓度范围,用含有0.1% DMSO的培养基将水样萃取物稀释为不同的浓度梯度作为实验组。每个浓度设置3个平行,重复实验结果的RSD均<30%。暴露48 h后吸出暴露液,加入配制的CCK-8工作液,设定仅含有CCK-8工作液的背景空白孔,37 ℃孵育1.5~2 h后,用酶标仪(Spark, Tecan)450 nm波长下测量吸光度,并根据如下公式计算细胞毒性。

图1 代表性城镇二级、三级污水处理厂和湿地修复技术处理流程和采样点分布Fig. 1 Treatment process and sampling points of representative urban secondary and tertiary sewage treatment plants and wetland restoration technique

1.4 数据分析
根据浓度-效应关系计算水样萃取物对发光菌和hBMSCs产生毒性效应强度分别为20%和50%的浓度即EC20和EC50。由于EC20和EC50的大小与急性毒性效应强弱呈反比,为更直观地评价2种模型的急性毒性,故采用1/EC20和毒性单位(toxicity unit, TU)来进行比较。根据如下公式计算TU值:
TU=1/EC50
使用SPSS 16.0的单因素分析法进行数据显著性差异分析。
2 结果与讨论(Results and discussion)
2.1 城镇二级、三级污水厂和湿地修复技术排水的发光菌急性毒性
尽管各个工艺水样在未经富集浓缩条件下(即稀释度100%)对发光菌没有产生显著的急性毒性。进一步将水样富集浓缩后进行暴露,发光抑制效应呈明显的剂量依赖性(图2)。部分水样的有机萃取物在稀释度100%(REF1)时对发光菌产生显著的急性毒性,主要原因可能为水样中的有机萃取物相对于水中的其他组分毒性更强。4个二级城镇污水处理厂中,A、B和C最终排水的发光抑制效应较进水均有所减弱,经二级处理工艺后分别削减了88.9%、57.1%和66.7%。但其中经D厂工艺处理后,发光菌的发光抑制作用显著增强了1倍。这说明尽管大部分二级处理可以有效去除水中毒性物质,但过程中潜在毒性副产物的生成也主要取决于不同的水质特点和处理的工艺条件。与本研究相似,某污水厂排水的生物发光抑制作用在物种敏感度分布模型(SSD)中都超过了影响5%水生生物的危险浓度(HC5)的上限,对水生生物可能造成较高风险[11]。三级城镇污水处理厂(E)进水经混凝、微滤和反渗透处理后,对发光菌无明显毒性。但经臭氧消毒后,毒性较反渗透出水增强,但仍略低于进水。比较1/EC20,再生水E厂对于进水的发光菌急性毒性的削减率为66.8%。湿地公园(F)修复技术对进水的发光菌急性毒性削减了45.6%。
2.2 城镇二级、三级污水厂和湿地修复技术排水对人源干细胞的细胞毒性
城镇二级、三级污水处理厂和湿地公园进水和各主要工艺出水对hBMSCs产生的细胞毒性呈现明显的剂量-效应关系(图2)。4个二级城镇污水处理厂(A~D)主要采用活性污泥法结合紫外消毒工艺,随着工艺的深入,细胞毒性显著降低。大连某污水处理厂A的主要工艺特点为改良A2O工艺结合紫外消毒,A厂各工艺出水的TU分别为0.06、0.03和0.02,出水细胞毒性低于进水。大连某污水处理厂B的主要工艺为序批式活性污泥法(SBR)结合紫外消毒工艺。由B厂各工艺出水的EC50可计算得到进水和出水的TU分别为0.11和0.03,细胞毒性总体削减率为35.0%。哈尔滨某污水处理厂C对细胞毒性的削减率为40.0%。沈阳某污水处理厂D进水和出水的TU分别为0.05和0.02,细胞毒性削减率为60.0%。
天津某再生水厂E的三级处理工艺,主要包括混凝、微滤结合反渗透及臭氧化消毒。经混凝处理后,污水细胞毒性没有显著变化,提示混凝对细胞毒物的削减能力较低。经微滤和反渗透单元处理后,污水的细胞毒性逐渐降低,比较1/EC20,微滤的毒性削减率为29.9%。但是经臭氧消毒后,细胞毒性反而升高了10.8%。与发光菌急性毒性测试结果一致,提示可能在臭氧消毒过程中产生了毒性较强的消毒副产物。与本研究结果相似,有文献报道臭氧消毒处理后,污水对大鼠的急性毒性[12]和细胞遗传毒性升高[13]。但也有研究与本研究结果不同,加拿大蒙特利尔某污水处理厂的臭氧消毒工艺使雌激素活性降低98.0%以上,雄激素活性去除68.0%以上,而抗雌激素活性保持不变[14]。表明废水的特性可能会影响臭氧消毒过程中毒性的变化。
海口某湿地公园F的水样的细胞毒性随着再生水萃取物浓度的升高而降低。进水的细胞毒性(抑制率)范围为42.7%~54.0%,出水用于当地景观湖的生态补给,其细胞毒性为50.4%~84.9%。比较各工艺排水的1/EC20,预处理和人工湿地对水体污染的细胞毒性削减率分别为45.1%和49.4%,总削减率为72.3%。结果表明该生态修复工艺对于二级处理工艺排水中有毒有害物质能够进一步去除。出水用于湖泊和河流生态补给,有利于提高再生水景观回用的安全性。

图2 城镇二级、三级污水厂和湿地修复技术水样有机萃取物对发光菌和人骨髓间充质干细胞(hBMSCs) 毒性效应的浓度-效应关系注:REF表示相对富集倍数,NC表示阴性对照;数据代表平均值±样本标准误差(SE),n=3;*P≤0.05、 **P≤0.01、***P≤0.001,与对照组相比。Fig. 2 Concentration-response relationship of the toxicity caused by organic extractions of water samples from urban secondary and tertiary sewage treatment plants and wetland effluents in luminescent bacteria and human stem cellsNote: REF stands for related fold enrichment; NC stands for negative control; data represents mean±SE, n=3; *P≤0.05, **P≤0.01, ***P≤0.001, compared with the control.
2.3 不同处理工艺对污水发光菌毒性和人细胞毒性的削减
采用A~F进出水的TU值或1/EC20计算削减率,对比城镇二级、三级处理厂和湿地修复技术对发光菌和人源干细胞的综合毒性去除效果(图3)。代表性二级处理、三级处理和湿地生态修复技术的对于人源干细胞毒性的削减率分别为59.8%、-10.8%和49.9%,对发光菌急性毒性的削减率分别为74.6%、66.8%和25.0%。二级处理和三级处理技术对污水hBMSCs细胞毒性的削减率低于发光菌急性毒性,但湿地修复技术对细胞毒性的削减率高于发光菌急性毒性。结果提示,湿地修复技术对污水细胞毒性可能具有良好的削减能力。此外,二级处理技术和湿地生态修复技术对于综合毒性的削减率低于COD和NH3-N的削减率,提示污水中残留的难降解有机污染物毒性相对较强。
2.4 2种受试生物模型的比较
通过比较水样萃取物对于发光菌和人源干细胞的毒性效应强度,分析排水综合毒性评价的物种灵敏度。污水有机萃取物对hBMSCs的毒性高于发光菌,66.7%(14/21)水样品对于hBMSCs细胞毒性的TU值高于发光菌急性毒性测试结果(图4)。因此,在检测排水的毒性效应中,人源干细胞比发光菌更为灵敏。对于反映水处理工艺过程中的毒性削减趋势,发光菌急性毒性监测测定得到的毒性削减率平均是人源干细胞相应剂量值的1.5倍,这说明污水对发光菌的急性毒性相对较容易削减,而残留的难降解有机污染物对人源干细胞毒性较强,提示排水中有毒有害污染物对人体健康的潜在危害。此外,还可能和不同测定方法本身的特点及污水处理工艺的实际运行条件有关[15]。
2.5 水体综合毒性与理化参数的相关性分析
人源干细胞毒性和发光菌毒性的TU和COD、氨氮呈显著正相关关系(图5)。Ma等[16]报道,高浓度废水的COD可能与发光菌毒性存在明显的相关性,而低浓度废水的毒性与COD的相关性则不太明显。Roig等[17]发现,某污水处理厂污水污泥中的总氮与通过水样萃取物的Microtox®试验获得发光菌的EC50值呈显著负相关,与本研究结果相一致。但对比实验结果测定的2种受试生物的1/EC20,发现一般毒性结果与COD、氨氮的结果无相关关系,说明低效应浓度/无效应浓度与理化指标无明显相关性。已有研究结果表明理化参数的降低并不等同于毒性的削减。应结合毒性实验作为水质理化指标监测的重要补充[18],对于保障再生水水质安全具有重要意义。
传统的水处理方法无法有效去除微量污染物[19]。尽管系统中半挥发性有机物(SVOC)的总浓度在μg·L-1或更低水平,但它们对人体的负面影响日益引起人们的关注。人源干细胞和发光菌的TU值与城镇二级、三级中检测到的SVOC组分浓度进行相关性分析,结果表明,hBMSCs的TU值与各工艺排水中SVOC的总浓度呈显著正相关关系(P≤0.01,r=0.45)。单独分析城镇二级和三级的TU与各自的理化参数和SVOC总浓度相关性,毒性指标均与SVOC总浓度呈现显著正相关关系。再一次提示污水中残留的有机污染物会产生较强的细胞毒性。尽管污水中有机微污染物的浓度水平远远低于其效应浓度,但大量不同的污染物之间可能会通过联合作用产生有害影响[20]。

图3 不同处理工艺对发光菌和人源干细胞毒性的削减效果注:a城镇二级污水处理厂(A、B、C)削减率均值; b毒性指标采用“1/EC20”进行削减率计算;COD表示化学需氧量; SVOC表示半挥发性有机物;ND表示由于湿地 水样未进行SVOC浓度测定,所以无SVOC削减率结果。Fig. 3 Removal of toxicity on luminescent bacteria and human stem cells by different treatment processesNote: a indicates average reduction of urban secondary sewage treatment plants (A, B, C); b indicates “1/EC20” is used to calculate the reduction; COD stands for chemical oxygen demand; SVOC stands for semi-volatile organic compounds; ND stands for no SVOC reduction of wetland effluents due to the lack of SVOC concentration measurement.
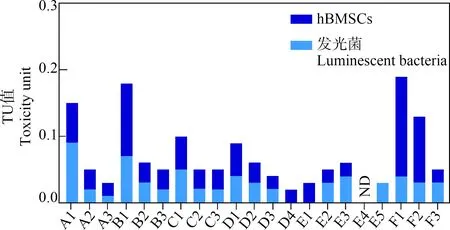
图4 不同处理工艺排水对hBMSCs和发光菌综合 毒性的毒性单位(TU)值的比较注:ND表示未检测出。Fig. 4 Comparison of toxicity unit (TU) for integrate toxicity evaluation of effluent from different treatment processes in luminescent bacteria and human stem cellsNote: ND represents not detected.

图5 污水TU、理化参数及SVOC总浓度相关性分析注:a城镇二级、三级处理工艺排水中SVOC总浓度;*P≤0.05、**P≤0.01、***P≤0.001,与对照组相比。Fig. 5 Correlation analysis of sewage TU, physico-chemical parameters and total concentration of SVOCNote: a means total SVOC concentration of urban secondary and tertiary sewage treatment plants; *P≤0.05, **P≤0.01, ***P≤0.001, compared with the control.
城镇污水再生回用是解决淡水资源危机和水资源污染的重要措施,但再生水中残留的有毒有害污染物在其回用过程中对生态系统和人体健康造成潜在威胁。本研究利用人源干细胞测试典型污水处理技术对污水综合毒性的削减效果,结果提示污水处理厂排水中残留的难降解有机污染物对人源干细胞具有较强的有害效应,细胞毒性强于发光菌急性毒性,二级处理技术对细胞毒性的削减率为74.6%,低于COD和NH3-N的去除率,三级处理过程中经混凝、微滤和反渗透处理后,出水无显著细胞毒性,但经臭氧消毒后最终排水的细胞毒性较进水无显著变化,提示人源干细胞对于消毒副产物形成较为敏感。此外,湿地修复技术对污水细胞毒性削减率为49.4%,对污水综合毒性的削减可能具有良好的前景。初步研究结果表明人骨髓间充质干细胞对水体污染物毒性响应较灵敏,应进一步研究排水对干细胞分化潜能的影响。干细胞的增殖和分化与个体发育密切相关,适于筛查污染物的发育毒性,而发育毒性正是消毒副产物等水体污染物的重要健康危害之一。研究结果为再生水水质安全性评价以及城镇污水资源化技术研发提供参考依据和方法。需要指出的是,本研究所选取的污水处理项目较为有限,毒性指标限于一般毒性,仍需面向更大范围的污水处理厂进行包括遗传毒性和发育毒性等敏感指标的毒性评估。

