城市污水生物处理过程中结合型和游离型胞外抗生素抗性基因的产生特征
梁张岐,李国鸿,黄雅梦,周攀,张一诺,袁青彬
南京工业大学环境科学与工程学院,南京 211816
抗生素在养殖和医疗卫生等行业的过度使用极大加速了抗生素抗性基因的产生及传播[1-2],成为威胁公共健康的全球性重大问题[3-4]。抗生素抗性基因(antibiotic resistance genes, ARGs),以下简称抗性基因,成为一种新型环境污染物,已在水、大气和土壤等各种环境中被检出[5],其中城市污水厂是抗性基因的重要储存库[6-7],已有超过数百种抗性基因被检出[8],抗性基因浓度可高达108copies·L-1[9]。但是受检测方法的制约[10],目前大多数研究仅针对传统胞内抗性基因(intracellular antibiotic resistance genes, iARGs),对胞外抗性基因(extracellular antibiotic resistance genes, eARGs)尚鲜有研究。而越来越多的研究表明,eARGs同样广泛存在于环境中[11-13]。eARGs由细胞主动分泌或死亡后释放产生[14],能够独立存活较长时间而不被降解,并在适宜条件下重新进入胞内表达抗药性,具有同样严峻却更加隐蔽的健康风险[15-17]。并且,eARGs可以游离于水中(f-eARGs,游离型)或附着于介质(a-eARGs,结合型)而存在[11],两者的生存和传播能力可能存在显著差异。如游离型可能传播能力较强[11],而结合型由于附着介质的存在可以在环境中长期存活[18-19]。因此,深入揭示不同类型eARGs的环境风险对于细菌抗药性的研究至关重要。
污水厂是eARGs存在的重要场所,其丰度不低于甚至明显高于iARGs。如Yuan等[10]的报道表明,污水厂出水f-eARGs丰度占总ARGs的(90.3±16.5)%,是iARGs的10余倍。可以推测,污水生物处理过程中强烈的搅拌、活跃的微生物代谢等条件,可能导致eARGs大量产生。然而目前对于a-eARGs和f-eARGs在生物处理过程中的产生特征和机制尚缺乏深入研究。
为了探索上述特征和机制,本研究建立了序批式活性污泥反应器(SBR),考察启动和运行过程中4种典型抗性基因(tetA、sul1、sul2和ermB)在a-eARGs和f-eARGs的时空变化特征。在此基础上,重点考察了曝气强度和污泥负荷对a-eARGs和f-eARGs产生和变化的影响。本研究将为揭示污水处理过程中抗性基因的归趋和风险提供理论和实验支撑。
1 材料与方法(Materials and methods)
1.1 SBR反应器的启动和运行
采用3个有机玻璃材质的圆柱形SBR反应器进行实验,尺寸均为14 cm×30 cm(Φ×h)。反应器进水量为3.96 L·d-1,进水采用模拟配水,配方如表1所示,活性污泥取自南京市某污水处理厂曝气池。启动阶段,将1.5 L活性污泥和2.5 L配水混匀后加入反应器,SBR周期设置为8 h,通过PLC时控开关设置程序全自动运行,程序设置为进水0.5 h,搅拌5 h,静置1 h,出水0.5 h以及闲置排泥1.5 h,一天运行3个周期。每天监测混合液悬浮固体浓度(MLSS)和化学需氧量(COD),待MLSS维持在3 000~4 000 mg·L-1,COD去除率维持在90%以上时,认为启动完成,整个启动阶段用时7 d,在第1、4和7天分别取活性污泥混合液10 mL储存于4 ℃的冰箱中待后续分析。
稳定运行后分别考察曝气强度和污泥负荷对2种eARGs产生的影响。对于曝气强度,SBR反应周期仍维持在8 h,通过调整曝气时间来设置低(3 h)、中(4 h)和高(5 h)3种水平,厌氧搅拌对应为2、1和0 h,其他时间设置不变。对于污泥负荷,通过调整进水COD浓度来设置低(0.1 kg(BOD)·(kg(MLSS)·d)-1)、中(0.2 kg(BOD)·(kg(MLSS)·d)-1)和高(0.3 kg(BOD)·(kg(MLSS)·d)-1)3种水平,其他成分按照比例调整以维持各元素比值恒定。SBR运行期条件和启动期保持一致,反应器保持稳定运行10 d,在第10天分别取出水500 mL和活性污泥10 mL用于后续分析。
1.2 胞内、结合型和游离型胞外DNA的提取
采用课题组开发的胞内和胞外DNA预处理方法进行胞内、结合型和游离型胞外DNA的分离[10]。首先用0.22 μm碳酸酯滤膜(Millipore,美国)将样品过滤,将滤液收集用于提取游离型胞外DNA。滤膜用10 mL磷酸盐缓冲液浸泡,并于涡旋振荡器室温震荡10 min,滤膜和混合液置于新滤膜上再次过滤,滤液收集用于提取结合型胞外DNA,而2次过滤的滤膜用于提取胞内DNA。
胞外DNA采用课题组开发的磁珠法提取,该方法对胞外DNA的提取效率高达85.3%~93.0%[10]。首先将3 mL异丙醇和4 mL的CL buffer(蛋白酶K,在30 mmol·L-1Tris-HCl中20 g·L-1,天根生物科技公司,中国)添加到5 mL的样品滤液中,并充分混合以去除杂质,再加入30 μL的磁珠备用液,颠倒混匀,在快速核酸提取仪涡旋震荡4 min后,将混合物置于磁力架上以沉淀磁珠并弃去上清液。然后用1 mL的Buffer CW1(含有7 mol·L-1盐酸胍的50%异丙醇)洗涤磁珠,再次利用磁力架除去上清液。接着用Buffer CW2(75%的乙醇)洗涤2次,在室温下放置10~15 min使残余的乙醇充分挥发。将30 μL的Elution Buffer(pH 8.5,10 mmol·L-1Tris-HCl,预热至55 ℃)添加至磁珠中震荡5 min。最后将混合物置于磁力架上收集上清液用于DNA分析。将获得的DNA采用Nanodrop和琼脂糖凝胶电泳验证。
对于胞内DNA的提取,将滤膜剪碎放入DNA提取管中,采用DNA试剂提取盒(FastDNA Spin Kit for Soil试剂盒MpBio,美国)进行DNA提取,按照试剂盒操作手册进行提取,将获得的DNA采用Nanodrop和琼脂糖凝胶电泳验证。
1.3 抗性基因的定量检测
使用LightCycler 96 (Roche,瑞士)进行荧光定量PCR[20],对4种污水厂中广泛报道的ARGs[9,21-22]进行定量检测,包括四环类抗性基因(tetA)、磺胺类抗性基因(sul1和sul2)和大环内酯类抗性基因(ermB),同时监测16SrDNA浓度以计算抗性基因的相对丰度,4种抗性基因及16SrDNA基因引物如表2所示[10]。定量PCR的步骤主要包括标准样品的制备、标准曲线的测定和样品中抗性基因绝对丰度的测定、数据分析。
首先,经过PCR得到各个基因片段,经过1%琼脂糖凝胶电泳后用DNA纯化试剂盒(Omega,美国)进行纯化。将纯化的产物克隆至大肠杆菌,挑取阳性克隆,用质粒提取试剂盒提取质粒,测定浓度并计算拷贝数作为标准样品。将标准样品连续10倍梯度稀释后取5个梯度作为模板,进行荧光定量PCR。采用20 μL荧光定量PCR体系,其中正向、反向引物(10 μmol)各0.4 μL、SYBR Premix Ex Taq Ⅱ(天根生物科技有限公司,中国)10 μL、50×ROX Reference Dye (天根生物科技有限公司,中国)2 μL、ddH2O 6.2 μL、模板0.1 μL,反应程序为40个循环(95 ℃ 15 min→62 ℃ 30 s),并生成溶解曲线,每个PCR进行3次平行测定,PCR扩增效率为88%~110%,确保标准曲线的相关系数(r2)>99%。用上述测定标准曲线的方法测定样品,并且每个平行样品之间的偏差<5%。反应结束后根据样品扩增的循环数(CT)计算水样中抗性基因的绝对丰度,并除以同一样品的16SrDNA绝对丰度得到抗性基因的相对丰度。
1.4 数据分析
所有的统计检验均采用t检验,统计显著性在95%的置信水平(P<0.05)且在无假设条件下2个数据集显著差异。
2 结果(Results)
2.1 eARGs的时间分布特征
SBR反应器的污泥中a-eARGs和f-eARGs绝对丰度在启动和运行期间的相对变化如图1所示。由图1(a)可知,在整个运行17 d的周期,a-eARGs呈先增长后下降的趋势。1~4 d,4种a-eARGs的丰度显著增加0.1倍~10倍,第4天后开始降低,稳定运行阶段其浓度低于启动期,为初始的31.2%~80.2%。与此类似,由图1(b)可知,f-eARGs同样呈先增长后降低的趋势,在整个启动阶段(1~7 d)f-eARGs的绝对浓度持续升高,最高提高倍数达110倍~3 116倍,而到运行阶段会出现下降但其绝对浓度仍高于初始值。
2.2 eARGs的空间分布特征
4种抗性基因在不同处理阶段的总丰度如图2(a)所示。从ARGs在所有形态中DNA的总丰度来看,好氧处理时ARGs的浓度最高,达1.0×1010~1.3×1010copies·L-1,厌氧阶段ARGs的浓度有所下降,达4.4×109copies·L-1,到出水时ARGs的总浓度显著下降,为8.0×108~9.8×108copies·L-1。
3类抗性基因的占比情况如图2(b)所示。对比不同形态ARGs的变化趋势发现(图2(b)),在好氧阶段iARGs占比在20.9%~40.6%,不足一半,说明此时活性污泥中ARGs主要以胞外形态存在。从2种eARGs的丰度来看,f-eARGs占据绝对优势,占比均在60%以上,tetA占比甚至达81.1%,相比之下a-eARGs占比较低,在0.3%~5.7%。这表明好氧处理可能导致f-eARGs显著增加。在厌氧处理阶段,iARGs是ARGs的主要存在形态,占比在41.1%~90.4%。相比之下,eARGs的丰度大幅降低,f-eARGs仍是eARGs的主要存在形式,但a-eARGs的比例相比好氧处理显著升高,达到7.5%~31.9%。在最终出水中,iARGs的比例进一步下降至9.8%~20.3%,而eARGs的占比相比好氧阶段有所提高,达79.7%~90.2%,其中f-eARGs仍占据主导地位,比例达66.5%~86.9%,a-eARGs的比例为3.2%~13.3%。
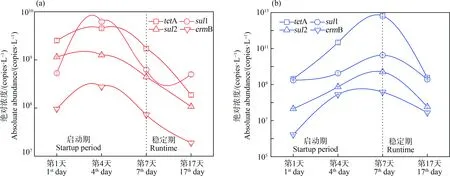
图1 4种抗性基因的结合型(a-eARGs) (a)和游离型(f-eARGs) (b)抗性基因的丰度随运行时间的变化Fig. 1 Changes in the abundance of four adsorbed extracellular antibiotic resistance genes (a-eARGs) (a) and free extracellular antibiotic resistance genes (f-eARGs) (b) with operation period

表1 反应器进水配方Table 1 The composition of the reactor’s influent

表2 抗性基因(ARGs)及16S rDNA基因引物Table 2 Primers of antibiotic resistance genes (ARGs) and 16S rDNA gene
2.3 曝气强度对eARGs产生的影响
3种类型ARGs随曝气强度的变化如图3所示。从总体趋势看,曝气强度的增加均促进了a-eARGs和f-eARGs的丰度增加,如当曝气时间由3 h提高至5 h时,a-eARGs的丰度增加了2.1倍~6.2倍(图3(b)),而f-eARGs的丰度增加了2.2倍~12.2倍(图3(c))。进一步对比iARGs(图3(a))和eARGs随曝气强度的增加百分比,发现eARGs的增长倍数(a-eARGs增长倍数3.1倍~7.2倍;f-eARGs增长幅度4.0倍~13.2倍)显著高于胞内(1.6倍~2.7倍)(P<0.05)。另外,对比2种eARGs随曝气强度的增长趋势,发现f-eARGs丰度增加更为显著,说明曝气增加使得ARGs更容易变成f-eARGs。相关性分析也支持这一结果,曝气时间与f-eARGs的相关性系数(r2=0.83~0.97)大于与a-eARGs的相关性系数(r2=0.77~0.95)。
2.4 污泥负荷对eARGs产生的影响
3种类型ARGs随污泥负荷的变化如图4所示。从总体趋势看,污泥负荷的增加也均促进了2种胞外抗性基因丰度增加,如当污泥负荷由0.1 kg(BOD)·(kg(MLSS)·d)-1增加到0.3 kg(BOD)·(kg(MLSS)·d)-1时,a-eARGs的丰度增加了1.9倍~13.3倍(图4(b)),而f-eARGs的丰度增加了1.3倍~7.8倍(图4(c))。进一步对比胞内和胞外随污泥负荷的增加百分比,发现胞外的增长倍数(a-eARGs增长倍数3.0倍~14.2倍;f-eARGs增长幅度3.6倍~14.3倍)也高于胞内(2.8倍~9.7倍)(P<0.05)。另外对比2种eARGs随污泥负荷的增长趋势,发现a-eARGs丰度增加更为显著,说明污泥负荷的增加更有助于a-eARGs的产生。
3 讨论(Discussion)
3.1 启动期eARGs大量产生而运行期丰度显著下降
在SBR活性污泥启动阶段,2种eARGs均大量产生,可能是由于微生物处于驯化阶段,部分微生物不适应当前环境而死亡裂解,使得iARGs转化为eARGs。此外,一部分eARGs可能会与蛋白质结合[17],或者与颗粒等污泥成分相结合[23]而转化为a-eARGs,导致其丰度增加。值得注意的是在启动阶段f-eARGs的增长倍数和持续时间均显著高于a-eARGs,这可能反映了二者在形成机制上的差异。首先一部分eARGs可能直接以自由态的形式存在,而另一部分ARGs虽然刚到达胞外时可能附着了蛋白质或其他颗粒物,变成a-eARGs,但结合较松散[24],随着曝气搅拌作用重新变为自由态,导致f-eARGs增加的程度更高。
到了启动期末期和稳定运行阶段,反应器内eARGs的浓度显著下降。可能是由于微生物已经完成驯化过程,由于不适应环境而死亡的细菌数量大幅减少,微生物处于稳定生长繁殖阶段。同时启动期产生的大量eARGs通过每日配水被排出,导致eARGs浓度下降。此时样品中的eARGs应主要来源于微生物正常的死亡裂解或主动分泌[14]。值得注意的是,尽管运行期间两者浓度都有明显降低,但f-eARGs降低的程度和持续时间均低于a-eARGs,这表明eARGs在胞外倾向于以自由形态存在。可能是由于本实验采用配水,反应器内可与eARGs结合的颗粒物浓度相对较低。
3.2 好氧处理阶段和出水中f-eARGs占主导
从ARGs总浓度的空间变化发现,好氧阶段的ARGs浓度远高于厌氧阶段和出水。该趋势说明好氧处理是导致ARGs浓度升高的重要原因,由于活性污泥中的大部分微生物为好氧或兼性好氧微生物[25],微生物在有氧的条件下新陈代谢加快,繁殖速率较高,因此产生更多的ARGs。相比之下,厌氧阶段微生物新陈代谢减慢,众多好氧性微生物不能增殖[26],因此ARGs浓度下降。到了出水,ARGs浓度显著低于活性污泥,说明排放的ARGs只占少部分,大部分ARGs仍存留在活性污泥中。

图2 4种抗性基因在不同处理阶段的总丰度(a)和3类抗性基因的比例(b)Fig. 2 Total abundance of four kinds of ARGs (a) and ratios of three forms of ARGs (b) in various treatment stages
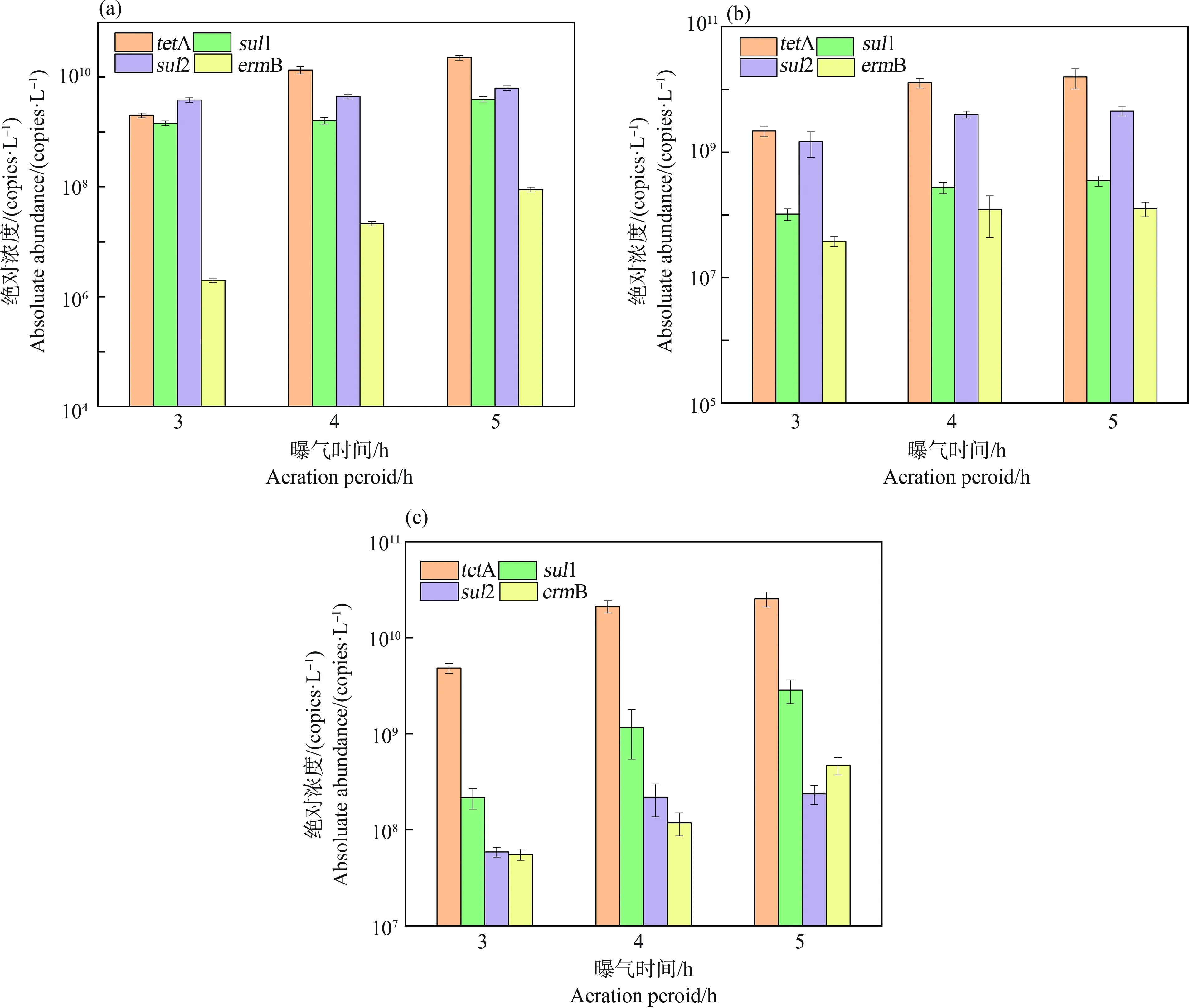
图3 胞内抗性基因(iARGs) (a)、a-eARGs (b)和f-eARGs (c)随曝气强度的变化Fig. 3 Changes in intracellular ARGs (iARGs) (a), a-eARGs (b) and f-eARGs (c) with aeration intensity

图4 iARGs (a)、a-eARGs (b)和f-eARGs (c)丰度随污泥负荷的变化Fig. 4 Changes in iARGs (a), a-eARGs (b) and f-eARGs (c) with sludge loading rate
空间分布特征表明好氧阶段以eARGs为主,且f-eARGs比例较高,而厌氧阶段以iARGs为主,f-eARGs仍是主要的eARGs形态,但a-eARGs比例有所升高;出水中f-eARGs占据绝对优势。这主要是由于f-eARGs只存在于水中,而出水经过与活性污泥沉淀分离,大部分胞内ARGs被截留在污泥中,导致f-eARGs成为ARGs的主要存在形态。该结果表明处理后的污水虽然iARGs浓度显著降低,但仍残存极高浓度的eARGs,这在以往的研究中被极大忽略。eARGs可能通过转化进入受体细胞重新表达耐药性,因而具有相当高的环境健康风险[27]。
3.3 曝气强度和污泥负荷提高使2种eARGs丰度显著提高
2种eARGs丰度随曝气强度提高而显著提高,这和前面ARGs空间分布特征结果相符,说明好氧条件有利于eARGs的产生。eARGs的增长倍数显著高于iARGs,这一现象说明eARGs产生不止来源于细胞衰老死亡,还有部分直接从细胞中主动释放,由于此时曝气强度不会造成细胞直接死亡,因此推测细胞代谢活跃会导致ARGs主动释放,进而eARGs丰度显著增加[10,24]。f-eARGs提高程度高于a-eARGs可能是因为ARGs变成eARGs之后,有一部分在较低曝气强度时倾向于与介质结合形成a-eARGs,但是曝气强度增大后,eARGs与介质的结合变得困难,导致f-eARGs增加多于a-eARGs。
另外一个有意思的现象是曝气强度由4 h增至5 h eARGs的增加幅度显著小于3 h增至4 h(P<0.05)。这可能是由于微生物可利用营养下降,微生物的生长速率难以进一步提高[25]。此时,微生物主动释放ARG的趋势可能在高曝气强度时也有所下降,导致eARGs增长趋势变慢。
2种eARGs丰度也会随污泥负荷提高而提高,这一结果说明污泥负荷的增加也有利于eARGs的产生。显然污泥负荷增加导致细菌繁殖速率加快,因此死亡释放或主动分泌产生的eARGs显著增加。胞外的增长倍数也高于胞内,再次证明eARGs产生来源于细胞衰老死亡和部分直接从未衰老的细胞中释放。f-eARGs提高程度低于a-eARGs,这和曝气强度的结果相反,可能是因为微生物在高营养的环境中产生胞外聚合物(extracellular polymer substance, EPS)增多[28],使DNA本身以复合物的形式存在,或者更容易与EPS等物质结合从而导致a-eARGs的增加。

