府河水体及沉积物细菌群落结构分布特征及其影响因素
刘幸春,王洪杰,王亚利,王英俊,刘玲,#
1. 河北大学雄安生态环境研究院,保定 071002 2. 河北大学生命科学与绿色发展研究院,保定 071002 3. 河北大学生命科学学院,保定 071002 4. 河北雄安新区生态环境局,雄安新区 071000
城市河流水体、沉积物理化性质和营养组分(氮、磷和有机碳等)受人类活动废物排放的影响而发生变化[1]。沉积物是河流生态系统中污染物质重要的“源”和“汇”,上覆水水质变化或环境扰动会影响沉积物中污染物的富集或释放,进而改变河流生态系统的稳定性。微生物是维持河流生态系统平衡的关键,对河流营养组分碳、氮和磷的迁移转化以及污染物降解有一定作用,但是微生物的多样性和群落结构极易受到河流环境变化的影响[2-5],因此,通过研究河流微生物特征可以为解析微生物生态功能和评价河流生态系统健康状况提供基础信息。
随着分子生物学技术的不断发展,高通量测序技术在微生物的群落结构特征研究方面得到了广泛的应用[6],已有许多学者分析了湿地、湖泊、水库、河流和海洋等环境中的微生物群落结构变化[7-10]。河流接纳不同类型的排放废水(如生活污水、农业废水和工业尾水等),造成河流水质空间分布条件变化,进而影响河流微生物群落结构[11]。研究表明,河流微生物优势细菌门为变形菌门、放线菌门、拟杆菌门、蓝藻门和厚壁菌门[12]。水体氮污染严重且碳氮比(C/N)较低的条件下,芽孢杆菌、反硝化细菌等微生物的丰度下降[13-15];此外,刘睿等[16]研究发现渭河枯水期中游水体中的微生物由于受到总悬浮固体(TSS)、总磷(TP)、C/N的影响,微生物多样性下降。除了氮、磷和有机质等营养物质之外,重金属也可能对细菌产生影响,研究发现柘皋河重金属Cu和Cd浓度比南淝河低,而细菌群落多样性相对较高[17],江玉梅等[18]探讨鄱阳湖四大河流河口重金属对底泥微生物群落的影响时得出,重金属Cu和Cd和门、属水平微生物显著相关,且变形菌门(Proteobacteria)对这2种重金属的耐受性最强。也有研究表明,沉积物微生物群落和重金属没有关系,只受到物理指标(pH、温度等)的影响[19-20],袁瑞强等[21]得出引水更容易导致河流沉积物中硫杆菌属(Thiobacillus)、芽孢杆菌(Bacillus)和乳球菌(Lactococcus)的变化,并且引起这种变化的主要因素是有机质、总氮和总钾含量。
保定府河作为白洋淀关键入淀河流之一,干流河长47.1 km,最后在建昌汇入白洋淀西侧的藻苲淀,其水质好坏直接影响白洋淀水生态环境。近些年来,随着城市化进程的加快,工业生产扩大,人口膨胀,农业和工业用水增加,府河接收自然雨水之外的废水类型不断变化,因此在河流不同空间区域内具有不同微生物群落,以维持其生态系统的稳定。对府河的研究主要包括水质评价、有毒有机污染物的筛查、污染源分析、重金属污染分析及潜在污染风险评价等,陈杰[22]研究发现,影响府河水质的环境因子主要为化学需氧量(COD)、TN和氨氮(NH3-N),水质达到劣五类的标准;胡国成等[23]发现保定府河沉积物受到重金属Zn、Pb、Cu和Cd的影响较大,主要是由于生活污水、沿河金属冶炼以及工业废水导致。目前,针对府河微生物优势种群以及影响微生物群落变化主要环境因子有待深入研究。
探索微生物群落结构特征不仅有助于了解府河污染程度和预测河流生态系统变化,而且在发现生态修复功能微生物方面有重要作用。本研究对夏季(7月)府河上、下游水体、沉积物理化性质、微生物空间分布及影响微生物种群的主要环境因子进行分析,为府河环境治理与生态修复提供微生物方面的数据支撑,对深入开展白洋淀流域入淀河流微生物群落多样性的研究具有借鉴意义。
1 材料与方法(Materials and methods)
1.1 采样点分布与样品采集
根据府河自身特点、支流汇入点及收纳污水的特点,沿府河上、下游依次选取16个具有代表性的监测断面进行对比分析,其中上游设F1~F9共9个采样点,下游设F10~F16共7个样点。采样点F1、F6和F7为自然河道-府河交叉口,主要接纳污水处理厂排水,F6为黄花沟汇入府河交叉点,承接鲁岗和银定庄污水处理厂排水,F7为金线河汇入府河交叉点,承接清苑区污水处理厂排水;F2、F4、F5和F9分别为城市和农村排污口;F10为入新区点位;F11和F12点位主要接纳农田废水;F15和F16分别位于白洋淀大桥和入淀河流南刘庄,其他采样点(F3焦庄、F8望亭、F13桥北、F14西向阳)为村庄河流。采样点F1一亩泉河和F3焦庄很难收集到相应的沉积物样本,因此沉积物样本有14个。各采样点分布如图1所示。
水样的采集:府河平均水深<5 m,使用有机玻璃采水器采集水面下0.5 m处水样3 L,并在采样点现场进行温度、pH和溶解氧的测定,之后将水样带回实验室存放置4 ℃冰箱,并在48 h内完成预处理。沉积物的采集:用抓斗式采泥器采集0~20 cm的沉积物约2 kg,放入无菌聚乙烯自封袋带回实验室,将样品分为2个部分,一部分存放于4 ℃冰箱用于理化指标分析,一部分存放于-20 ℃冰箱用于提取DNA[24]。
1.2 分析检测方法
在采样现场分别用便携式溶解氧测定仪(上海雷磁,JPBJ-608)、便携式pH计(上海雷磁,PHBJ-260F)测定水体温度和pH;上覆水TN、NH3-N、COD和TP均采用紫外可见智能多参数水质测定仪(北京连华,LH-3BA)测定[25-26],总有机碳(TOC)采用总有机碳分析仪(上海艾力蒙塔,vario TOC cube)测定。沉积物样品经过冷冻干燥后研磨过筛,用凯氏定氮仪(济南海能,K1160)测定TN,用总有机碳分析仪(上海艾力蒙塔,vario TOC cube)测定有机碳;原子荧光光度计(北京博晖,RGF-6200)测定重金属汞(Hg)和砷(As)[27];用原子吸收分光光度计(北京普析,TAS-990)测定重金属铬(Cr)[28]、铜(Cu)、锌(Zn)[29]、铅(Pb)、镉(Cd)[30]和镍(Ni)[31]。所有样本均经过3次重复分析。

图1 采样点位分布图Fig. 1 Distribution of sampling points
1.3 高通量测序分析
微生物高通量测序送检之前,水样经过孔径为0.22 μm的微孔滤膜过滤,滤膜和沉积物分别放入离心管中,存放在干冰中送测至上海美吉生物医药科技有限公司。用E.Z.N.A.® Soil DNA Kit(Omega Bio-tek公司,美国)土壤试剂盒对过滤后的滤膜和适量沉积物提取DNA,扩增区域为细菌的16S rDNA V4~V5区,引物为515F(5’-GTG CCA GCM GCC GCG G-3’)和907R(5’-CCG TCA ATT CMT TTR AGT TT-3’),引物上会接上特异的barcode用于扩增后序列归类分析,聚合酶链式反应(polymerase chain reaction, PCR)产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,并使用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)对PCR产物进行检测定量。高通量测序由Illumina Miseq PE300测序系统实现[32]。所有样品序列进行OTU划分、多样性分析和主坐标分析(principal co-ordinates analysis, PCoA),采用生态数据处理软件(CANOCO)对样品97%相似性的样品OTU数据与环境因子进行冗余分析。
1.4 数据统计分析
使用R语言制作热图(heatmap)描述群落物种组成及物种的丰度信息。根据beta多样性距离矩阵进行层级聚类(hierarchical clustering)分析,然后使用非加权组平均法聚类分析(unweighted pair-group method with arithmetic mean, UPGMA)构建树状结构呈现不同环境样本中群落组成的相似或差异程度。而对不同样本间的差异程度,则是通过点与点间的距离体现的,非度量多维尺度分析(non-metric multidimensional scaling, NMDS)获得样本的空间定位点图。采用单因素方差分析(one-way ANOVA)进行组间显著差异性检验,并且利用SPSS 24.0对微生物丰富度和多样性与环境因子进行Pearson相关性进行。利用R语言进行方差分解分析(variance partitioning analysis, VPA)、冗余分析(redundancy analysis, RDA)及作图,其他统计分析和作图由Origin 2018完成。
2 结果(Results)
2.1 水体和沉积物的物理化学性质分析
府河流域理化性质调研发现,府河地表水呈弱碱性,pH在7.38~8.06之间(表1);府河水体COD含量整体达到《地表水环境质量标准》(GB 3838—2002)Ⅳ类水标准,但是上游点位COD含量显著高于下游,其中府河桥(F4)COD含量达到(92.77±40.22) mg·L-1。TOC浓度在2.93~5.89 mg·L-1范围之间,与COD结果一致,也是在F4府河桥点位(5.89±0.02) mg·L-1浓度最高。上游TP含量显著高于下游,其中护城河支流(F2)严重超标,TP含量高达(0.96±0.03) mg·L-1。上游NH3-N含量除F6为(1.76±0.06) mg·L-1,其余点位均为劣Ⅴ类水标准,各点位TN含量较高。
府河下游的沉积物理化指标测定结果如表2所示,沉积物中TN含量整体较高,有机质含量在21.58~42.83 g·kg-1范围之间,F13桥北村点位有机质含量显著高于其他点位。与《土壤环境质量标准》(GB 15618—1995)[33]规定的标准值进行比较,下游沉积物重金属Cd、Cr和Ni含量在府河入新区段(F10)点位优于Ⅰ级标准(表3),其他点位优于Ⅱ级标准,各点位As含量均优于Ⅰ级标准,而Pb含量均优于Ⅱ级标准,Cu含量在F10点位优于Ⅰ级标准,膳马庙村北(F11)高于Ⅲ级标准,其他点位属于Ⅱ级标准,Zn在F11和李庄(F12)高于Ⅲ级标准,其他点位均符合Ⅱ级标准。将重金属含量均值与河北省土壤背景值[34]进行比较,可得Cd、Pb、Cr、Cu、Ni和Zn分别是河北土壤背景值的4.50倍、5.23倍、1.36倍、5.62倍、1.40倍和5.13倍。
2.2 水体和沉积物细菌群落多样性和差异性分析
2.2.1 水体和沉积物细菌群落丰富度和多样性
对府河地表水和沉积物样本序列进行OTU聚类分析,并且按照最小样本序列进行抽平,府河地表水中共有3 270个OTU,沉积物中共有5 272个OTU。进一步计算地表水和沉积物α多样性指数,结果如表4所示,水体中Chao和Shannon指数在府河桥(F4)点位最高(分别为2 110.72和4.99),细菌群落和物种有较高的多样性,物种最丰富;Chao指数在桥北村(F13)断面最低(866.26),而望亭(F8)断面Shannon指数最低(3.11)。此外,地表水微生物α多样性指数与环境因子的Pearson相关性分析结果表明,丰富度Chao指数与pH显著负相关(r=-0.515,P<0.05),与TOC(r=0.608,P<0.05)、COD(r=0.680,P<0.01)呈显著正相关关系,与温度(T)也存在正相关。同时,发现丰富度Chao指数和Shannon多样性指数具有显著正相关关系(r=0.748,P<0.01)。
沉积物所有样品Coverage指数均>0.95,说明本次测序结果可以真实反映沉积物样品中微生物的真实情况。Chao指数最高值在新金线河支流(F7)点位(3 740.71),在南刘庄(F16)(1 938.14)群落丰富度最低。Shannon指数最大值和最小值分别位于F2和F15(数值分别为6.62和5.38)。Pearson相关性分析得出Shannon多样性指数与pH显著负相关(r=-0.771,P<0.05),与Cu呈显著正相关(r=0.786,P<0.01),也得出丰富度Chao指数和Shannon多样性指数具有显著正相关关系(r=0.828,P<0.05)。

表1 府河水体理化指标Table 1 Physical and chemical indexes of surface water in Fuhe River
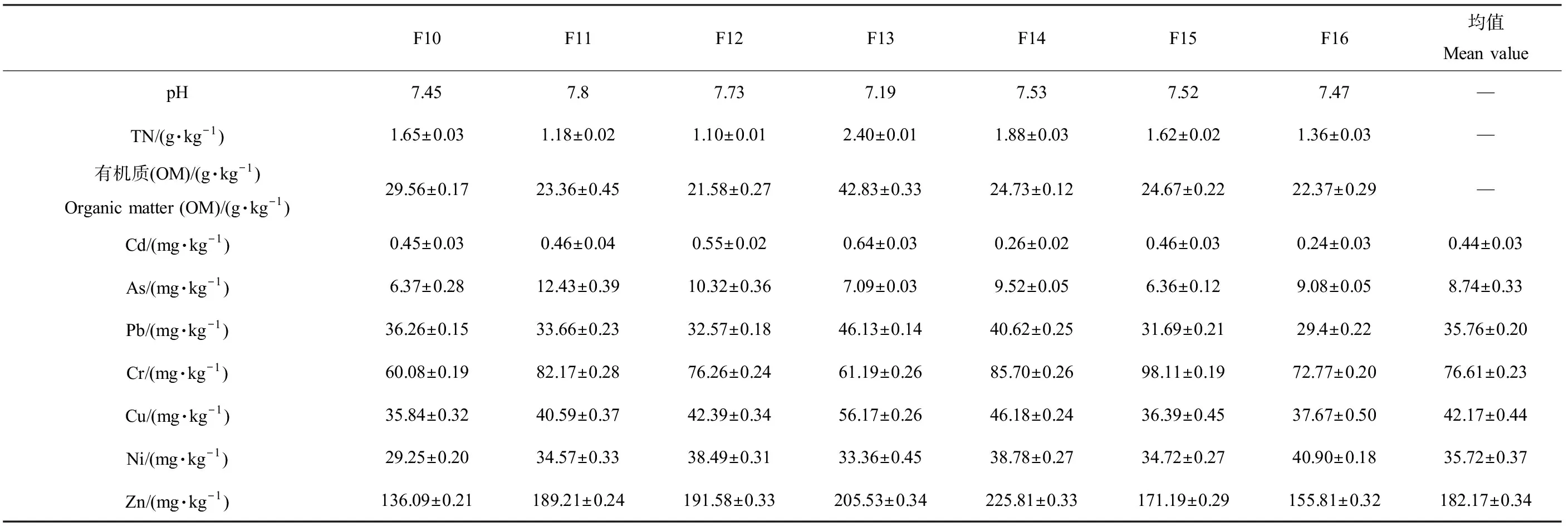
表2 府河下游沉积物各项理化指标Table 2 Physical and chemical indexes of the sediment in the downstream of Fuhe River
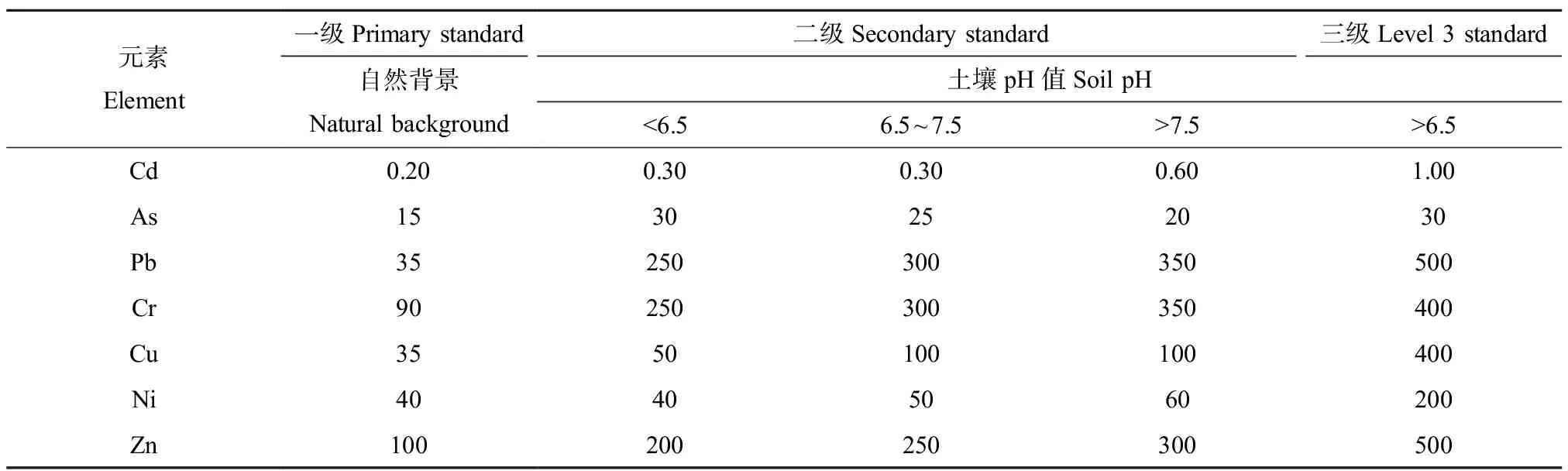
表3 土壤环境质量标准值Table 3 Standard value of soil environmental quality (mg·kg-1)
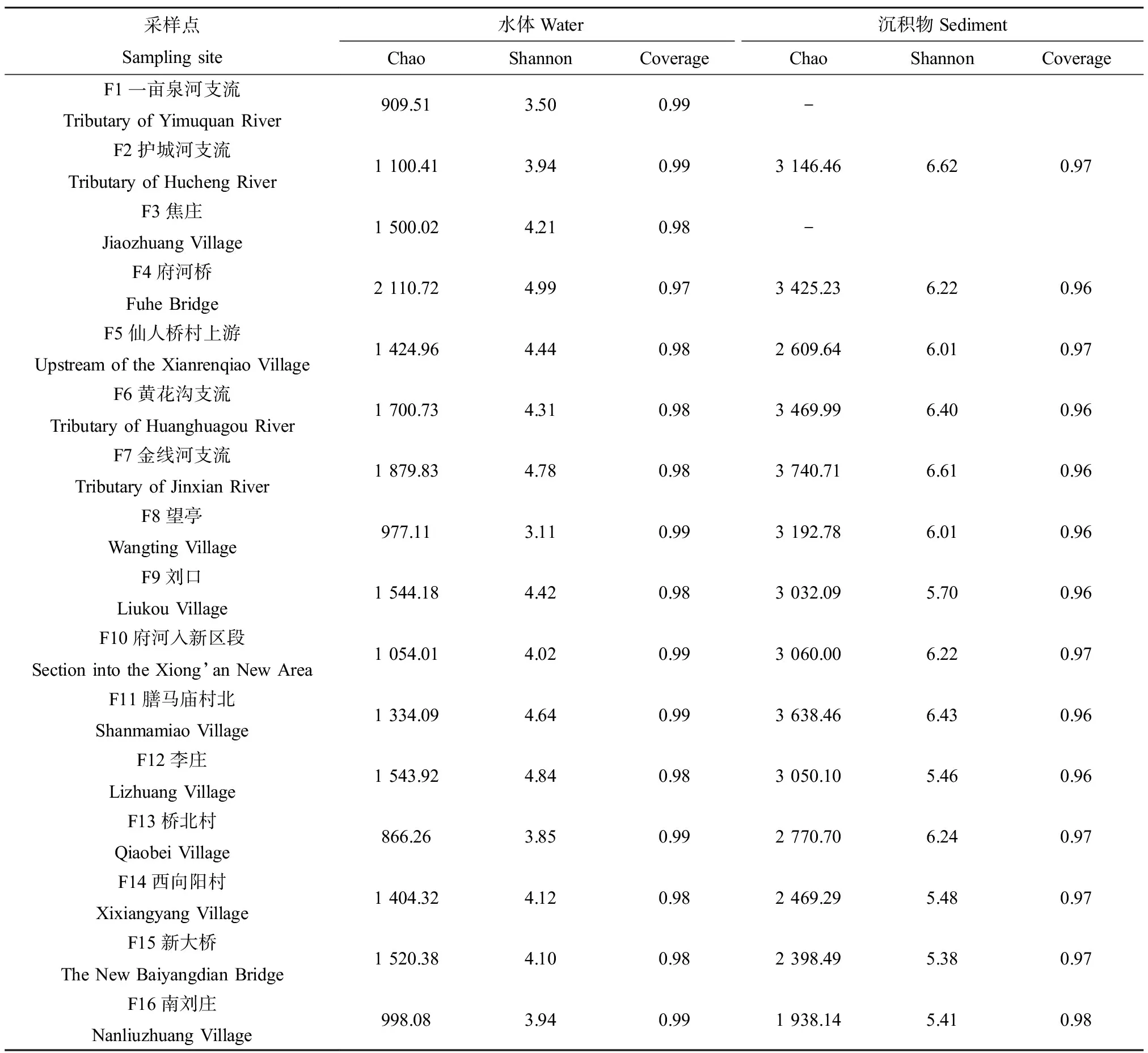
表4 水体和沉积物样品在97%水平下的丰富度和多样性指数Table 4 Richness and diversity index of water and sediment samples at 97% level
2.2.2 水体和沉积物细菌群落差异性分析
基于unweighted Unifrac采用PCoA分析衡量样本间群落物种组成的差异性[35],样本点距离越近,群落结构越相似,由图2(a)可知,上下游水体和沉积物样本分布在不同的位置,细菌群落组成存在显著性差异(P<0.05);对细菌群落结构进行层级聚类分析,结果(图2(b))显示水样F1~F9聚为一类、F10~F16聚为一类,沉积物中聚类虽然略有不同,但是在上游F1~F9和下游F10~F16之间也存在差异。

图2 水体和沉积物的PCoA(a)及细菌群落结构聚类分析(b)注:S表示地表水;N表示沉积物。Fig. 2 PCoA analysis (a) and cluster analysis of bacterial community structure (b) of water and sedimentNote: S stands for surface water; N stands for sediment.
由图2可知,水体细菌多样性和丰富度与沉积物中细菌群落结构存在一定相关性。水体中细菌群落多样性越高,相应的沉积物中也具有较高的微生物多样性,但是沉积物微生物群落不一定影响水体微生物种群和群落多样性。如,水样F4中Chao和Shannon指数最高,相应的F4沉积物中Chao和Shannon指数水平也较高。此外,结合表4数据发现,沉积物和水体中Chao和Shannon指数与上覆水水质条件(COD、TN和TP等)成负相关,Chao和Shannon指数越高,水体的理化性质越差,相反,这2个指数越低,水质越好。
2.3 细菌群落组成分析
2.3.1 府河水体细菌群落组成
利用Miseq测序技术研究府河水体和沉积物细菌群落结构,府河地表水样品共检出49个门,112个纲,294个目,493个科和970个属。变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、蓝藻菌门(Cyanobacteria)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)和厚壁菌门(Firmicutes)是水样中主要的菌门,约占总体的96.96%(图3(a))。变形菌门是府河上覆水的第一优势菌门,绝大位点丰度超过40.40%。但是在望亭(F8)、西向阳村(F14)、新大桥断面(F15)变形菌丰度最低,而蓝藻菌门成为第一优势菌,其丰度分别为53.42%、35.85%和39.34%。在府河入新区段(F10)点位优势菌为拟杆菌门(48.07%)。同时,实验结果发现下游放线菌的丰度比上游高。
府河水样中属水平微生物结构分布如图3(b)所示,norank_f_norank_o_Chloroplast、黄杆菌属(Flavobacterium)、unclassified_f_Burkholderiaceae、单胞菌属(Arenimonas)、噬氢菌属(Hydrogenophaga)、Limnohabitans和新鞘脂菌属(Novosphingobium)是上覆水样中主要的属类微生物,约占总体属水平微生物的54.07%。一亩泉河支流(F1)、府河入新区段(F10)和膳马庙村北(F11)点位的黄杆菌属丰度显著比其他点位高;上游unclassified_f_Burkholderiaceae、噬氢菌属、Limnohabitans和新鞘脂菌属比下游高。
2.3.2 府河沉积物细菌群落组成
府河沉积物微生物物种比水样物种较多样丰富,共检出62个门,141个纲,358个目,601个科和1 155个属。由图4(a)可知,沉积物样品中主要的门水平微生物为变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和拟杆菌门(Bacteroidetes),约占总体微生物门类的79.17%。府河沉积物微生物空间分布分析结果显示,在整个府河水域变形菌门丰度在37.50%~56.63%之间,其中李庄(F12)丰度最高。此外,绿弯菌门是府河沉积物中第二优势菌。上游酸杆菌门和拟杆菌门丰度比下游高。
如图4(b)所示,在属水平上对府河沉积物细菌群落结构进行分析,发现沉积物优势菌属占比较低,丰度相对较高的菌属为norank_f_Steroidobacteraceae、硫杆菌属(Thiobacillus)、norank_c_Subgroup_6、norank_f_Anaerolineaceae和硫碱螺旋菌属(Thioalkalispira),约占总体属水平微生物的20.56%。其中,硫杆菌是自养反硝化菌,在上下游丰度分别为24.44%和53.21%。

图3 府河水体门(a)和属(b)水平细菌群落热图Fig. 3 Heatmap of bacterial community at phylum (a) and genus (b) level of Fuhe River surface water

图4 府河沉积物门(a)和属(b)水平细菌群落柱形图Fig. 4 Columns of bacterial community at phylum (a) and genus (b) level of Fuhe River sediment
2.4 细菌群落结构与环境因子关系
2.4.1 府河水体细菌群落结构与环境因子的关系
环境因子的变化对菌群产生一定的影响,不同菌属受不同环境因子的影响程度不同。本研究对府河水体优势菌属和环境因子进行冗余分析(RDA),进一步探究水体细菌群落结构与环境因子之间的相关性。如图5(a)所示,RDA分析分别解释了45.94%和17.59%的水体细菌群落和环境因子的关系,共解释了细菌属水平63.53%的分布差异。环境因子对样点细菌群落的影响程度,取决于样点垂直投射于代表环境因子的射线之后离原点的距离,距离越远,影响程度越大。由图5(a)可知,NH3-N、TN、TP和pH是影响府河水体细菌群落结构主要环境因子,其中pH对F10点位的微生物影响程度最大,TN、NH3-N和TP对F3的微生物影响程度最大。典型细菌群落与环境因子分析发现,黄杆菌属和单胞菌属与pH呈正相关,与TN和NH3-N呈负相关。此外,研究发现府河水体中噬氢菌属、新鞘脂菌属与TN、NH3-N和TP成正相关。
2.4.2 府河沉积物细菌群落结构与环境因子关系
对府河沉积物优势菌属和环境因子进行冗余分析,重点研究下游沉积物细菌群落结构与重金属的相关性。沉积物RDA分析分别解释了46.49%和28.40%的细菌群落和环境因子的关系,共解释了微生物属水平74.89%的分布差异(图5(b))。结果显示,pH、TN和Cd对细菌群落结构影响较大。优势菌属硫杆菌和norank_f_Anaerolineaceae与TN呈负相关,优势菌属norank_c_Subgroup_6和pH呈正相关。
2.5 府河沉积物细菌群落主要功能类群
分析了府河沉积物中硝化细菌、反硝化细菌、硫酸盐还原细菌和甲烷氧化菌4种主要功能微生物在府河空间分布情况,结果如图6所示。结果表明,府河下游沉积物中硝化细菌和反硝化细菌丰度显著高于上游。在府河上游主要的功能硝化菌是硝化螺旋菌纲(Nitrospira, 2.82%),下游氧化NH3-N的功能硝化菌为硝化螺旋菌门(Nitrospirae, 2.75%)和硝化螺旋菌纲(1.67%)。在整个府河流域硫杆菌属是主要的反硝化菌,在府河上游其相对丰度比例大约为24.44%,而在下游F12和F15,硫杆菌属相对丰度达到16.65%和17.71%。硫酸盐还原菌中脱硫盒菌科(Desulfarculaceae)在各采样点均有一定的丰度,而脱硫杆菌属(Desulfobacterium)在府河上游丰度较高,脱硫杆菌科(Desulfobacteraceae)是下游主要的硫循环菌。甲基杆菌属(Methylobacter)是府河沉积物中主要的甲烷氧化菌,在F2和F15甲基杆菌属的相对丰度达到0.22%和0.16%。
3 讨论(Discussion)
府河上游点位承接污水处理厂排水及生活污水,河流污水生物处理不理想,排放废水中有机物质含量较高,进入府河之后导致上游点位COD和TOC含量升高。从整体结果可知,府河上游受生活污水及工业污水的影响,N、P污染严重,其中,位于排污口附近的F2护城河点位,受到附近3家中等规模医院的生活污染和医用废水污染,其水质最差;而下游各污染物含量较低,表明水体有一定的自净能力。府河下游膳马庙村北(F11)和李庄(F12)2个点位沉积物受到附近农田化肥农药污染,重金属含量较高,并且重金属含量高于河北土壤背景值,表明府河沉积物存在Cd、Pb、Cu和Zn重金属污染风险。
河流细菌多样性在空间分布上存在一定的差异,众多研究得出微生物多样性受到温度、pH和有机碳等的影响[36-37],这与本研究结论一致。F4府河桥点位流经城市,多年受到人类活动的影响,水质复杂多变,因而可能导致细菌丰度较高。望亭(F8)和桥北村(F13)断面物种多样性最低,可能是因为这2个点位存在特定菌类的富集,限制其他物种的生长,导致多样性和丰富度偏低。沉积物护城河支流(F2)和新金线河支流(F7)点位相对于其他采样点有较高的微生物丰富度和多样性,其主要原因可能是这2个点位是护城河和新金线河支流汇入点,受到支流汇入的扰动较大,导致此处微生物物种活性较高、群落结构多样。府河水体和沉积物群落差异性分析结果表明,细菌群落结构无论是水体还是沉积物在上下游均存在一定差异,有学者对富营养化河流的调查发现,上下游细菌群落结构具有明显差异,接收生活污水的上游区域具有降解芳香族化合物的微生物属,而受藻华影响的下游蓝藻细菌丰度较高[36],与本研究结果相符。并且在府河部分断面(如F2、F4和F7等)水体污染严重,破坏了河流生态系统稳定性,可能会导致不必要微生物的繁殖和生长,影响水体自净能力,进而引起水体富营养化。
已有研究表明,变形菌门、放线菌门和厚壁菌门是典型的淡水菌门[37]。府河优势菌存在一定的空间异质性。蓝藻菌具有固氮能力,对水体N循环起着重要作用,上游F8以及下游F14、F15点位氮磷含量较其他点位低,这可能与优势菌蓝藻菌的作用有关。属于拟杆菌的噬细胞菌的增多与水华的发生有关[38],拟杆菌门的丰度和富营养化可能有潜在的关系[39]。已知放线菌可以分解许多有机物,如芳香化合物、氰等毒性强的化合物,在污水及有机固体废物的生物处理中有积极的作用,下游放线菌的丰度比上游高说明在府河上游水体中难降解有机质随着水体流动逐渐累积至下游。沉积物细菌属水平物种多样性更高,检测出在分类学谱系中没有科学名称的物种,Wang等[37]对赣江南充段、林海等[38]对妫水河进行细菌群落结构特征研究时,也得出了相似结论。黄杆菌属属于拟杆菌门,是一类广泛存在于淡水水体中的优势菌[40],并且可以降解藻类有机物或生物聚合物。在上游丰度显著较高的unclassified_f_Burkholderiaceae和Limnohabitans隶属于伯克氏菌科,能降解有机农药和多氯联苯,新鞘脂菌属可降解有机污染物和多环芳烃,特别在焦庄(F3)这几种菌丰度最高,因为F3点位附近有汽车配件园,沿岸有家庭式小作坊,受工业污染影响较大。

图5 水体(a)和沉积物(b)细菌群落结构和环境因子的RDA分析Fig. 5 RDA analysis of bacterial community and environmental factors in water (a) and sediment (b)

图6 沉积物细菌群落主要功能类群注:(a)硝化细菌;(b)反硝化细菌;(c)硫酸盐还原菌;(d)甲烷氧化菌。Fig. 6 Relative abundance of key functional groups of sediment bacterial communityNote: (a) Nitrifying bacteria; (b) Denitrifying bacteria; (c) Sulfate-reducing bacteria; (d) Methanotrophs bacteria.
变形菌门是所有点位沉积物样品中的第一优势菌门,与以往对河流、海洋沉积物微生物优势菌群研究结果一致[38,41]。F12变形菌丰度最高,而该点位Chao指数较低,可能与李庄河面较宽有关,水体流动缓慢限制微生物迁移,使得此位点微生物结构稳定而单纯[38]。沉积物中第二优势菌绿弯菌的主要功能是以二氧化碳为碳源进行光合作用产生能量[42],但是由于在兼性厌氧条件下进行光合作用而不产生氧气,也不能进行固氮[43],因此,府河上游氮浓度比下游高,也可能和沉积物中绿弯菌门的丰度变化有关。上游城市段拟杆菌门的高丰度可能是居民区未经处理的含有硝酸盐、氨和粪便等污染物废水造成的,因为拟杆菌常在沉积物中表现出较高的丰度,并且该菌是一种致病菌,常见于人和动物体内[44]。沉积物属水平上的硫杆菌可以从地下水和被污染的地表水中去除硝酸盐,同时还可以修复硝酸盐含量高的废水,府河水体流速缓慢,为沉积物中反硝化菌提供较好的缺氧环境;norank_c_Subgroup_6隶属于酸杆菌门,是一种嗜酸菌,府河上游pH比下游偏低,所以该菌在上游丰度(40.24%)高于下游丰度(21.91%)。
府河水体中NH3-N、TN、TP和pH是影响细菌群落结构的主要环境因子。黄杆菌属和单胞菌属与pH呈正相关,与TN、NH3-N呈负相关。有研究表明,黄杆菌属是淡水水体中具有反硝化能力的优势菌,对生存环境条件pH较为敏感[43],尽管本研究府河水体pH变化差异小,但是在某些位点由于其pH波动促进了黄杆菌属和单胞菌属的活性。水体中噬氢菌属、新鞘脂菌属与TN、NH3-N和TP成正相关,NH3-N、TN和TP在不同程度上可以提高噬氢菌属、新鞘脂菌属的丰度,表明噬氢菌属、新鞘脂菌属对河流内氮、磷等有机污染物变化具有较好的适应性。刘峰等[7]发现汾河入黄河口水体微生物群落结构的变化主要受pH和溶解氧(DO)的影响;也有研究表明,人为的氮素污染是影响密云水库入库河流水体微生物群落组成的主要因素[45],与本研究结论一致。沉积物中pH、TN和Cd对微生物群落结构影响较大,赵思颖等[46]得出pH、TN及TP对鄱阳湖底泥微生物群落结构有影响,且底泥中营养成分和微生物多样性呈正相关,也有研究报道,Cd、Cu和鄱阳湖底泥变形菌门有显著相关性,其中Cd和隶属于变形菌门的5个有重金属修复作用的属呈正相关[18],这进一步支持了本研究的结果。优势菌属硫杆菌和norank_f_Anaerolineaceae与TN呈负相关,硫杆菌主要参与反硝化过程,当含氮高的废水排入河流,氮素的去除率会提高,norank_f_Anaerolineaceae隶属于绿弯菌门,绿弯菌门不能固氮。优势菌属norank_c_Subgroup_6隶属于酸杆菌,和pH呈正相关,这与酸杆菌是生长缓慢的寡营养菌、其丰度受pH影响大的研究结果相符[47]。
综合分析,本研究揭示了府河水质条件的变化极大影响细菌群落结构,污染程度高的上游水体和沉积物中细菌群落丰富度高于下游,同时发现水体细菌多样性和丰富度与沉积物具有相关性。整个空间分布中变形菌是上覆水和沉积物中的第一优势菌,其中上覆水区域中拟杆菌门、蓝藻菌门和放线菌门丰度也较高,而沉积物中除了变形菌,绿弯菌门、酸杆菌门和拟杆菌门也是府河底泥细菌中优势菌;进一步属水平分析发现上覆水中黄杆菌和新鞘脂菌以及底泥中硫杆菌在整个细菌群落中相对丰度最高。此外,发现府河pH、NH3-N、TN和TP显著影响细菌群落结构,而沉积物pH、TN和Cd对细菌群落结构影响最大。

