免疫抑制小鼠脓毒症前后肺部及肠道微生态的变化特点
宋立成,闫鹏,杨庆云,张晗,解立新,磨国鑫
中国人民解放军总医院呼吸与危重症医学部,北京 100048
脓毒症时,感染失控一方面是由于免疫细胞的失能和凋亡使机体对微生物的拮抗作用显著减弱,同时,机体合并了多器官功能的异常,使得免疫系统和微生态之间的相互作用变的更加复杂。因此,在非危重症或健康状态下,诱导免疫抑制将会如何影响机体的微生态,可能会更好地反映免疫系统与肺部及肠道微生态之间的相互作用。
本研究通过建立免疫抑制小鼠模型,观察小鼠肠道及肺部微生态的变化情况,确定健康状态下免疫抑制对微生态的影响;同时观察免疫正常及免疫抑制小鼠在脓毒症早期肠道及肺部微生态的变化特点。
1 材料与方法
1.1 免疫抑制小鼠模型的建立 2021年1月4日至4月9日将64只4周龄的雄性C57BL6小鼠用随机数字表法分为两组,分别为:免疫正常组(control组,n=32)和免疫抑制组(MP-control,n=32)。所有实验小鼠均饲养于无病原体的解放军总医院第八医学中心动物实验中心,接受12 h光照/12 h黑暗环境,给予充分的无菌水及鼠粮。在饲养2周后,分别给予control组小鼠每天200 μL 0.9%氯化钠注射溶液连续腹腔注射30 d;MP-control组小鼠每天200 μL 0.9%氯化钠注射溶液+甲泼尼龙(MP)(200 mg/kg)连续腹腔注射30 d。根据每日体质量变化及通过流式细胞术检测外周血淋巴细胞亚群进行模型评估。
1.2 脓毒症模型的建立 对control组和MP-control组通过气管内注入脂多糖(LPS)及腹腔联合注射LPS建立脓毒症小鼠模型。将LPS溶解于PBS中,配备为1 000 μg/mL,雄性小鼠通过吸入异氟烷进行麻醉,经口插入气管插管,LPS-control和MP-LPS组注入LPS溶液50 μL,同时两组小鼠均腹腔注射LPS 溶液50 μL。其中control组和MP-control组均包含LPS-control组16只和MP-LPS组16只。
1.3 小鼠血液标本的提取及处理 在术后24 h,分别对control组小鼠(8只)、MP-control组小鼠(8只)、LPS-control组小鼠(8只)、MP-LPS组小鼠(8只)进行眼球取血,0.8~1 mL/只。取300 μL标本进行离心,在4 ℃条件下,转速为1 000 r/min,离心15 min,离心结束后,小心吸取上层血清入1 mL抗凝管中,统一编号标记,置于-80 ℃储存备用。取500 μL标本,加入荧光标记的单克隆抗体,混匀后在室温孵育20~30 min,加入2mL的1×RBC Lysis Buffer进行溶血处理,摇匀后在暗盒中孵育10 min后1500 r/min离心5 min,吸弃上清,加入2 mL的1×PBS轻柔吹洗、混匀,再离心(1 500 r/min,5 min)弃上清后重复,通过流式细胞仪检测并记录T淋巴细胞亚群的百分比。
1.4 16S rRNA检测方法 在无菌操作下将右下肺分离,迅速放置于无菌冻存管中。将小鼠腹腔打开后,沿盲肠位置找到结肠,剪开切口,迅速将粪便标本置于专用粪便标本盒内。将上述样品封装、贴上标签后置于液氮罐中,并转移至-80 ℃的冰箱内冻存。将标本送至上海微基生物科技有限公司检测,进行高通量16S rRNA基因测序技术分析。
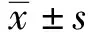
2 结果
2.1 免疫抑制模型建立的评价 通过腹腔注入MP造成免疫抑制模型,发现MP-control组体质量先是逐步增加,第4天起显著高于control组,此后体质量呈现逐步降低趋势,第14天起体质量开始显著低于control组,并持续至第30天(图1)。建模完毕后,MP-control组淋巴细胞计数显著降低(表1),同时伴有CD3+CD8+比例的显著升高(表1),及CD4+/CD8+的显著降低(表1)。进一步分析发现,MP干预后CD4+CD44high及CD8+CD44highT细胞的比例均显著升高(表1),提示幼稚型T细胞数量及比例的显著降低,T淋巴细胞的激活程度和成熟度显著升高,凋亡风险也愈加升高。

表1 两组免疫抑制模型T淋巴细胞亚群构成比的变化
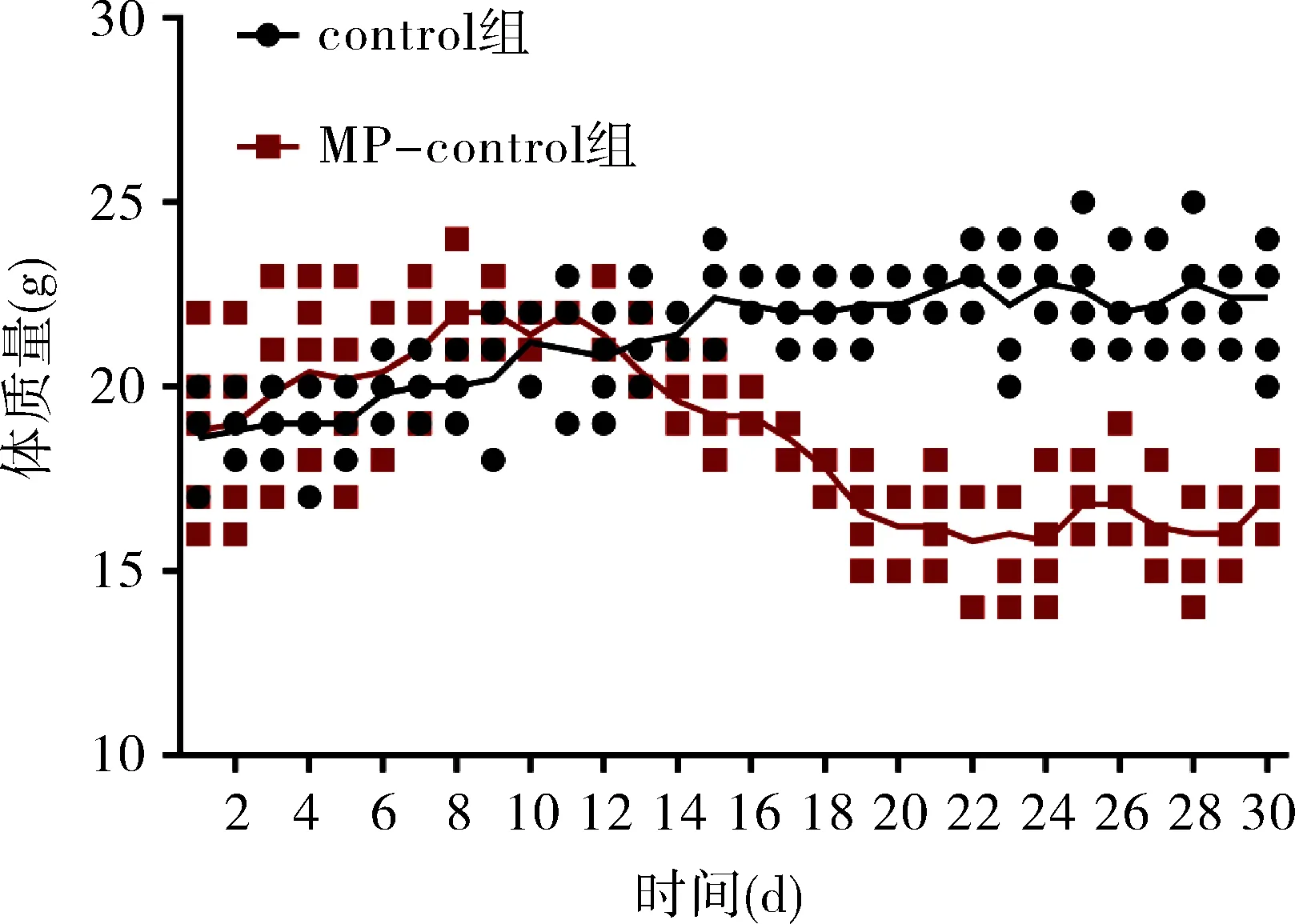
图1 免疫抑制模型建立后各组体质量的变化
2.2 免疫正常组和免疫抑制组经LPS干预后疾病严重程度特点 与control相比,MP预先干预并不会对促炎因子或适应性免疫相关因子产生影响,而LPS刺激后,免疫正常组的肿瘤坏死因子α(TNF-α),干扰素γ(IFN-γ),白细胞介素10(IL-10)和白细胞介素17A(IL-17A)均显著升高,而MP-control组经LPS刺激后免疫系统各因子与control相比均无明显改变(表2)。生存曲线显示,MP-control组给予LPS刺激后48h生存率显著降低,与LPS组差异有统计学意义(P<0.05),见图2。
注:**P<0.01。

表2 脓毒症对免疫抑制及免疫正常组外周血炎症因子的影响
2.3 肺组织及粪便内α多样性的比较 与control组相比,MP-control组肺组织shannon多样性及simpson多样性等均无明显改变,LPS刺激后24 h,control组和MP-control组α多样性均无统计学差异。而粪便中,MP-control组较control组shannon多样性显著升高,而LPS刺激后,MP-LPS组较LPS-control组shannon多样性显著降低,提示免疫抑制状态下肠道微生态的脆弱性(表3)。

表3 肺组织及粪便α多样性指数表
2.4 肺组织及粪便内各物种水平分布特点 肺组织分析发现,与control组相比,MP-control组变形菌门的水平显著降低(图3A),以促炎反应相关的β-变形菌纲及其下的伯克霍尔德氏菌目及其下的从毛单胞菌科为主要降低菌种[1](图3B、C、D);厚壁菌门水平显著升高(图3A),以产短链脂肪酸(SCFA)梭菌目、毛螺菌科升高最显著(图3C、D),同时抗炎反应相关的厚壁菌门的芽孢杆菌纲、乳酸杆菌目、属的水平也显著升高[1](图3B、C、E)。而拟杆菌门的各级微生物在MP-control组的肺内没有显著的变化。
粪便分析发现:MP-control组粪便中变形菌门的水平显著升高(图3F),特别是以β-变形菌纲及其下的伯克霍尔德氏菌目及其下的从毛单胞菌科(图3G、H、I),和ε-变形菌纲及其下的弯曲菌目、螺杆菌科、属为主要升高菌种(提示肠道内促炎反应的菌种增加)(图3G、H、I、J);厚壁菌门中的梭菌目、毛螺菌科升高显著,与肺组织内变化趋势相同,但芽孢杆菌纲、乳酸杆菌目、属的水平显著降低(图3G、H、I、J)。与control组相比,粪便中拟杆菌门、纲、目显著降低(这也是菌群紊乱的特征表现)(图3F、G、H)。
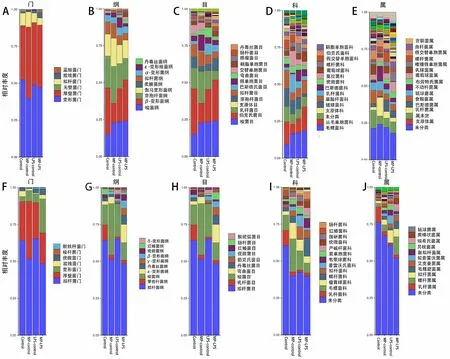
图3 肺组织及粪便内各物种水平的相对丰度比较:A为门水平各组小鼠肺部微生态平均丰度比较;B为纲水平各组小鼠肺部微生态平均丰度比较;C为目水平各组小鼠肺部微生态平均丰度比较;D为科水平各组小鼠肺部微生态平均丰度比较;E为属水平各组小鼠肺部微生态平均丰度比较;F为门水平各组小鼠粪便微生态平均丰度比较;G为纲水平各组小鼠粪便微生态平均丰度比较;H为目水平各组小鼠粪便微生态平均丰度比较;I为科水平各组小鼠粪便微生态平均丰度比较;J为属水平各组小鼠粪便微生态平均丰度比较
上述分析提示免疫抑制小鼠肺及粪便中的微生态均发生了显著改变,而且粪便和肺组织内变化的主要菌种变化特点存在差异。
与control组相比,脓毒症发生后,免疫正常的LPS-control组肺内微生态仅有厚壁菌门、梭菌纲、梭菌目、毛螺菌科较control显著升高(图3A、B、C、D),同时变形菌门、β-变形菌纲伯克氏菌目、从毛单胞菌科水平显著降低(图3A、B、C、D);其余菌种水平没有明显改变;但LPS-control组粪便内微生态除了厚壁菌门、梭菌纲、梭菌目、毛螺菌科与肺内变化趋势一致外,还伴有变形菌门β-、γ-、ε-各纲菌群的紊乱(图3F、G);同时厚壁菌门、芽孢杆菌纲、乳杆菌目、科、属的水平均显著降低(图3F、G、H、I、J),提示脓毒症早期,肠道内微生态发生显著的变化,而肺部微生态在一定程度上受肠道微生态的影响。
与LPS-control的肺组织相比,MP-LPS组内厚壁菌门下的芽孢杆菌纲、乳杆菌目、链球菌科的水平降低(图3A、B、C、D),提示炎症更严重,而其他菌种的变化与LPS-control组变化趋势相同。但在肠道中,MP-LPS的微生态较LPS-control组发生显著性差异。表现在变形菌门及其下的各纲、目、科、属的更显著紊乱(图3F、G、H、I、J),特别是γ-变形菌纲的肠杆菌目、科、属,和ε-变形菌纲的弯曲菌目、螺杆菌科、属显著升高,变形菌门下的各纲是肺部促炎环境及感染风险增加的重要标志物[2]。同时拟杆菌门、纲、目的降低趋势与MP-control组相同,提示免疫抑制对拟杆菌的显著影响(拟杆菌水平的稳定是维持肠道菌群稳定的重要因素,在一定程度上是促进肠道黏膜屏障发育和健全的重要成分,其降低提示肠道内菌群的显著紊乱[3]。其余菌群的变化在MP-LPS组和LPS-control组中趋势变化相同。
3 讨论
本研究发现,健康小鼠长期应用糖皮质激素可使肺部和肠道微生态发生显著的变化,而且两者的变化具有差异性。肺部微生态变化以促炎反应相关的β-变形菌纲水平的降低,及与抗炎反应和SCFA产生增多相关的乳酸杆菌及毛螺菌等水平的增加为特点,这些均提示激素对肺部微生态有改善和促进作用,而激素对肠道微生态的影响与肺部有明显不同,体现在ε-和β-变形菌纲的病原体水平显著升高,但抗炎相关的乳杆菌属的水平显著降低,同时拟杆菌门、纲、目的水平也是显著降低的,这提示糖皮质激素对肠道菌群有不良的影响,造成微生态的显著紊乱。
作为一种经典的免疫抑制药物,糖皮质激素免疫作用机制仍有很多未知,在微生态的调节方面,虽然既往有相关研究,但结论仍有争议。有研究[4]发现,泼尼松龙以1.0 mg/kg共14 d并不会对实验动物粪便微生态产生影响;另一项研究采用地塞米松DEX的28 d慢性暴露,肠道菌群发生了显著变化,尤其是放线菌显著升高,以放线菌属(双歧杆菌属)显著升高为特点。此外,与对照组相比,乳酸菌水平也有所增加[1]。糖皮质激素导致的双歧杆菌和乳酸菌的升高,可能都与抗炎作用有关,这些结果可能指向一个以微生物为中心的抗炎机制。而本研究发现,长期大量糖皮质激素应用,会使肺部抗炎相关的微生态水平升高,但是肠道菌群出现显著的紊乱,与先前的研究相比,考虑本研究中激素的用量更大,所以导致不同的结果,这也反映了不同的糖皮质激素使用方案对肠道菌群的影响是不同的。
当脓毒症发生后,免疫抑制较免疫正常组肺部微生态出现了明显的紊乱,这个结果意味着激素对健康个体肺部微生态的影响是很脆弱的,在感染打击下,不但不会发挥调节作用,而且会加重微生态的失衡。对肠道微生态的分析也证明了这一点。LPS干预后,免疫抑制组肠道微生态出现变形菌门下各纲、目、科、属水平较免疫正常组的显著升高,这是肠道促炎环境恶化及机会感染增加的重要预警标志[2],同时拟杆菌门的各级微生物也显著减少,由于拟杆菌水平的稳定是维持肠道菌群稳定的重要因素,在一定程度上是促进肠道黏膜屏障发育和健全的重要成分,其降低提示肠道内菌群的显著紊乱[3]。
本研究发现,虽然脓毒症启动后肠道和肺部微生态均发生显著变化,但是在脓毒症早期(24 h)内,肠道和肺部发生同步变化的菌群种类较少,既往关于肺肠轴的理论指出,肠道和肺部紧密联系且相互影响,在机体出现脓毒症时,肠道菌群的失衡导致大量活性氧释放,使肠道屏障受损,细菌可通过血液扩散至其他组织器官,最终引发炎症级联反应大暴发[5]。细菌移位后,肺是最先受到损伤的器官,说明肠源性感染是急性肺损伤的诱因。然而也有研究发现,在健康小鼠的肺部,正常状态下固有免疫反应更多反映了局部(肺-肺)微生物-宿主的相互作用,而不是远程(肠道-肺)微生物-宿主的相互作用。这个结论反映了小鼠肺微生物组的存在和免疫意义,肺微生物群的变异可能是一个重要的,被低估的实验和临床变异的来源[5]。这也和本研究结论相契合,即脓毒症早期,肺部微生态紊乱更多反映的是肺部自身的菌群失调,暂未受到肠道的广泛影响,后期随着病情加重或药物影响等,肺肠轴的作用可能更加突出。
激素不会保护微生态。在某种用药方式下,可能会增加某些抗炎菌群,但是由于其对免疫系统的影响,导致大量淋巴细胞凋亡,特别是B细胞,导致IgA分泌不足,同时也影响了免疫系统与微生态之间的相互平衡,也对肠道屏障功能造成了损伤。
在脓毒症中,糖皮质激素一直以来是应用最广泛、时间最长,且争议最大的药物。早期研究曾认为短期大剂量糖皮质激素(GC)对脓毒症患者是有效的,而后期的研究发现这种方案不能带来生存获益,而且二重感染的风险进一步升高了。此后的研究着眼于短期低剂量激素(氢化可的松200~300 mg/d),发现可以早期逆转休克并改善生存率,然而随着数据的积累,发现临床结局的异质性越来越大,目前在脓毒症的管理中,仅在限定条件下推荐GC的应用[6]。随着转录组学技术的进步,人们发现其实脓毒症和ARDS作为综合征,其具有很大的异质性,如果根据其基因表型特点对患者进行更细致的分类[7],有可能精准的区分出哪些患者可能从GC治疗中获益,哪些患者不但不能获益,还会增加死亡的风险[8]。本研究中,通过生存曲线分析发现,免疫抑制组在脓毒症后死亡率显著高于免疫正常组,结合肺部及肠道微生态的分析,本文认为通过肺部及肠道微生态紊乱的严重程度对脓毒症进行分型是一种可行的方法,微生态紊乱的针对性治疗,或者在GC治疗的过程中充分考虑微生态的具体状态,可能为脓毒症的个体化治疗提供思路。
总之,糖皮质激素会对健康个体的肺部及肠道微生态造成不同的影响,但当脓毒症出现时,GC的长期大量应用会造成更加严重的肺部及肠道微生态紊乱。

