老年人颈动脉内膜中层厚度与斑块和前列腺增生的相关性研究
张松,钱胜利,田海军
中国人民解放军中部战区总医院,a 干部病房,b 超声科,武汉430010
良性前列腺增生(BPH)是影响中老年男性的最常见疾病之一,严重影响患者生命健康和生活质量[1],然而其发病机制尚未完全阐明。近年来研究发现血管损害相关危险因素在BPH的发生发展中扮演重要的角色,而颈动脉粥样硬化斑块是评价血管功能的一个重要指标[2-3]。因此通过超声检测颈动脉内膜中层厚度(IMT)和斑块评估BPH的发生发展成为一种可能。本研究基于老年BPH患者辅助检查资料,分析颈动脉粥样硬化与BPH的关系,为BPH患者的临床诊疗提供新思路。
1 对象与方法
1.1 研究对象 收集2019年1—12月在解放军中部战区总医院体检中心健康体检以及住院的146例老年BPH患者体检资料。146例年龄范围60~96岁,年龄(84.3±6.8)岁。符合《2017年良性前列腺增生中西医结合诊疗指南(试行版)》中BPH的诊断标准[4],并按照研究[5-6]将BPH患者按前列腺体积(PV)大小分为PV>40 mL组(n=75)和PV≤40 mL组(n=71)。本研究方案经解放军中部战区总医院医学伦理委员会批准,所有研究对象均签署知情同意书。
1.2 排除标准 前列腺炎、前列腺癌、膀胱癌、其他膀胱疾患而影响正常的排尿功能者;有过前列腺手术病史的患者;严重心、肝、肾功能障碍者;近3个月服用α受体阻滞剂、5α还原酶抑制剂、他汀类药物、抗血小板药物以及活血化瘀的中药。
1.3 研究方法
1.3.1 体格检查及生化指标检测 详细询问患者病史,于受试当日测量血压、身高和体质量,并计算出体重指数(BMI)=体质量(kg)/身高(m)2。所有受试者均于清晨空腹采集静脉血,采用日立7600全自动生化分析仪检测血尿酸(SUA)、血糖(FPG)、血清胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)和前列腺特异性抗原(PSA)。
1.3.2 PV的测量 在询问患者既往史基础上,让患者于空腹憋尿状态下,由超声科医师采用彩色多普勒超声诊断仪(LOGIQ E9型,美国GE公司)经直肠测定前列腺最大左右径、上下径及前后径(cm),计算PV=左右径×上下径×前后径×0.52(mL)[7]。
1.3.3 颈动脉粥样硬化斑块的检测 患者采取仰卧位,颈部完全暴露,由超声专科医师采用彩色多普勒超声诊断仪(LOGIQ E9型,美国GE公司),检测患者双侧颈总动脉、颈总动脉分叉处及颈内动脉颅外段,测量并记录粥样硬化斑块数量、最大斑块的面积及颈动脉IMT。颈动脉粥样硬化斑块诊断测量标准:IMT ≥1.0 mm为内膜增厚;斑块定义:局限性IMT增厚凸入动脉管腔至少≥0.5 mm,或较周围IMT增加≥50%,或IMT ≥1.5 mm。用面积描迹法测量血管纵切面图像上左、右两侧颈总动脉和窦部4个血管段最大斑块的面积[8-9]。
2 结果
2.1 两组的基本临床资料比较 PV>40 mL组患者的BMI、收缩压(SBP)、舒张压(DBP)、PSA、SUA明显高于PV≤40 mL组(P<0.05),见表1。两组之间的年龄、TG、TC、HDL-C、LDL-C、FPG差异无统计学意义(P>0.05)。

表1 两组患者基本临床资料分析
2.2 两组颈动脉粥样硬化斑块比较 研究结果发现,PV>40 mL组患者的颈动脉粥样硬化斑块的数目、IMT明显高于PV≤40 mL组(P<0.05),而两组颈动脉粥样硬化最大斑块的面积差异无统计学意义(P>0.05)。见表2。

表2 两组患者颈动脉粥样硬化斑块比较
2.3 PV与各项代谢危险因素相关分析 采用多元logistic回归分析,结果显示DBP、PSA、SUA和IMT均是PV大小的危险因素(P<0.05)。见表3。
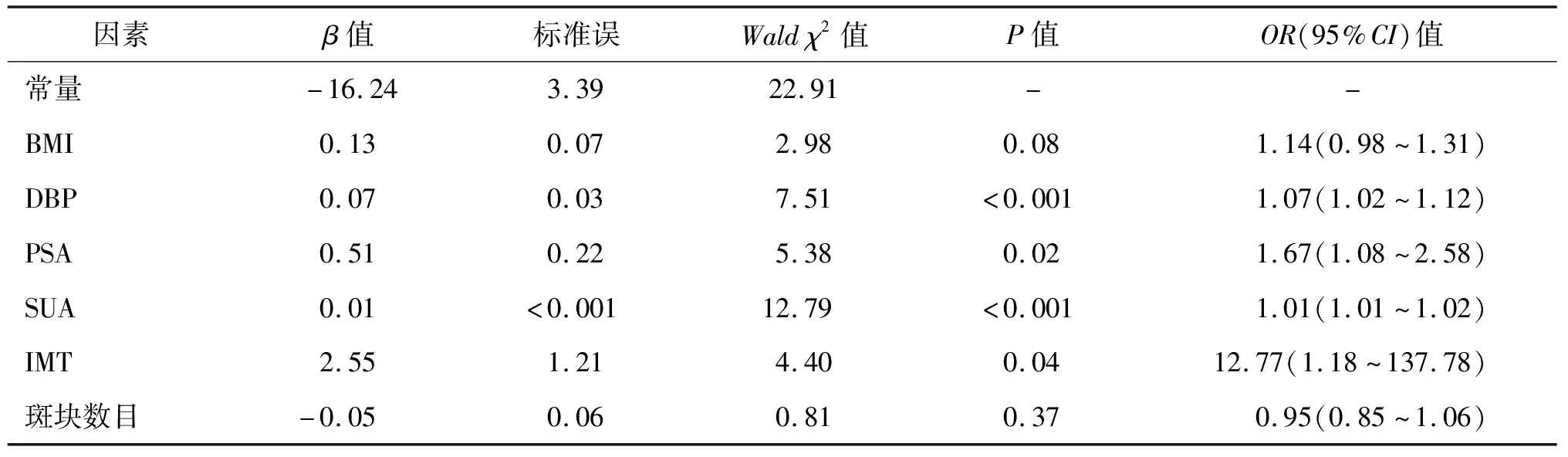
表3 PV与各项代谢危险因素logistic回归分析结果
3 讨论
大量的流行病学资料显示高血压、高脂血症、2型糖尿病等心血管危险因素是BPH的独立危险因素[10]。颈动脉是动脉粥样硬化病变高发部位,IMT是反映早期动脉粥样硬化的标志物,斑块形成是动脉粥样硬化严重的体现,也是血管疾病多重危险因素的敏感指标。颈动脉位于机体表浅部位,受外界因素干扰小,血管彩色多普勒超声可对颈动脉斑块形态学特征做出准确判断,并对其稳定性可做出评估。因此,利用超声影像定量测量技术评估其血管壁病变,适用于动脉粥样硬化的所有阶段[2-3,11]。
本研究结果显示PV>40 mL组患者的BMI、SBP、DBP、PSA、SUA明显高于PV≤40 mL组,表明这些因素与BPH发生发展密切相关,与本课题组以往报道基本一致[12-13]。本研究结果发现PV>40 mL组患者的颈动脉粥样硬化斑块数目、IMT厚度明显高于PV≤40 mL组(P<0.05),表明颈动脉粥样化严重程度与前列腺增生病变关系密切。PV是BPH临床进展的风险预测因素之一,本研究进一步行PV与各项代谢危险因素相关分析,结果发现PV与BMI、DBP、PSA、SUA、斑块数目、IMT呈正相关(P<0.05),而logistic回归分析显示DBP、PSA、SUA和IMT均是PV大小的危险因素,这与已有的报道相一致[14-15]。颈动脉粥样硬化与BPH发生发展有关,其可能发生机制:(1)增龄性动脉硬化可减少骨盆血流,加重前列腺组织缺血缺氧,诱导相关分子如HIF-1α的表达,刺激间质细胞增生,导致前列腺增生[16];(2)研究发现两者均与内皮素(ET)表达增多、一氧化氮(NO)活性水平下降有关,其中血管内皮功能损伤时ET释放增加,促进动脉痉挛及血栓形成,而NO活性下降可抑制血管平滑肌舒张,促进血小板聚集、平滑肌细胞增殖,这种改变促进了两者的发生[17];(3)慢性炎症因子如白细胞介素6(IL-6)、肿瘤坏死因子-α(TNF-α)等水平升高,促进动脉粥样硬化和BPH的发生[18];(4)代谢相关因素如高尿酸、高脂血症、高血压等可直接引起血管内皮损伤,加速动脉粥样硬化的发生和发展,导致前列腺慢性缺血,促进其增生[19]。颈动脉粥样硬化与BPH的关系是极其复杂的,相关的分子机制有待深入研究。
颈动脉斑块面积有望成为心血管风险的一个更强的预测因子,以及疗效评价的一个更敏感的指标。本研究对两组患者最大斑块面积进行了比较,结果差异无统计学意义(P>0.05)。分析可能存在以下原因:(1)两组受试者颈动脉斑块数目较多,采用最大斑块面积可能无法代表整个颈动脉斑块的面积;(2)受试者均为高龄,不能很好反映随着年龄增长,斑块面积增加与PV的关系。因此,需要综合评估颈动脉硬化斑块的程度,进一步分析与PV的关系。
本研究存在一些局限:(1)样本量较少,统计可能存在误差;(2)老年人年龄较高,颈动脉粥样硬化均较重,可能存在偏倚;(3)该特殊人群医疗保健水平较高,相关基础疾病如高血压、高脂血症、高血糖都能得到及时有效控制,对统计结果存在一定的影响。本研究结果还需要进一步的多中心的大量研究数据证实。
总之,颈动脉粥样硬化和BPH同为年龄相关性疾病,且两者密切相关。颈部血管彩色多普勒超声测量IMT和斑块,不仅能评估颈部血管动脉硬化程度,还可对前列腺增生病变早期预警。因此我们要及早筛查,提前干预动脉粥样硬化多种危险因素,并重视抗动脉僵硬治疗,以延缓乃至减少BPH的发生。

