骨肉瘤中Circ_0104346的表达及对骨肉瘤细胞增殖的影响
柳勋法,张翠灵
1.深圳市人民医院脊柱外科,广东深圳 518020;2.深圳市人民医院检验科,广东深圳 518020
骨肉瘤(osteosarcoma,OS)最常见的骨原发恶性肿瘤,在骨原发性肿瘤中,其发病率仅次于浆细胞骨髓瘤[1],每年全世界的发病率为4人/百万人[2]。手术和多药联合化疗是骨肉瘤患者主要的治疗方法。化疗能消灭患者体内潜在的微小转移灶、使肿瘤体积变小、肿瘤局部血供减少、提高保肢手术成功率。化疗联合手术治疗能够极大提高生存率,5年生存率从10%~20%上升到60%~70%。然而由于化疗抵抗的产生和化疗药物的不良反应,超过80%的手术治疗患者表现出转移和局部复发,预后极差[3-4]。同时肿瘤细胞耐药性不断增强,越来越多的研究发现化疗抵抗常常导致化疗失败,目前化疗抵抗的具体机制仍未完全清楚。前期研究中发现,在骨肉瘤癌旁组织中Circ_010434高表达,但其机制及对骨肉瘤细胞的作用尚不明确[5-6]。该研究通过收集4种骨肉瘤细胞,包括MG-63、U2OS、SaOS-2和SOSP-9607,观察Circ_010434对骨肉瘤细胞迁移及增殖的影响。现报道如下。
1 材料与方法
1.1 材料
实验用的4款骨肉瘤细胞,包括MG-63、U2OS及SaOS-2购买自北纳生物,SOSP-9607购买自中科院。
1.2 主要实验试剂
①2×SYBR Green PCR Master Mix(A4004M,Lifeint生命互联)。②miRNA cDNA Synthesis Kit逆转录试剂盒(CW2141S,CWBIO康为世纪)。③miRNA qPCR Assay Kit(CW2142S,CWBIO康为世纪)。④miRNA Purification Kit提取试剂盒(CW0627S,CWBIO康为世纪)。⑤Cell Cycle Staining Kit(CCS102,MULTI SCIENCES联科生物)。⑥结晶紫染色液(G1061,Solarbio)。
1.3 方法
收集4种骨肉瘤细胞系,包括MG-63、U2OS、SaOS-2和SOSP-9607,引物由通用生物系统(安徽)有限公司合成。分别进行RNA提取、RNA浓度和纯度测定、RNA逆转录,荧光定量PCR实验测定细胞中的Circ_0104346的表达。选取Circ_0104346表达量最高的细胞系进行后续试验。干扰骨肉瘤细胞中Circ_0104346的表达,流式检测凋亡实验检测细胞凋亡情况,流式检测周期实验检测细胞增殖情况。
1.3.1 细胞收集 用移液枪吸掉培养皿中的细胞培养液;在培养皿中加入Trizon裂解液,用移液枪吹打,将全部细胞悬液转移到1.5 mL离心管中,-80℃保存。
1.3.2 RNA提取 向以上溶液中加入氯仿离心15 min后,试管液体分成3层,取无色水相层并将其转移到新的1.5 mL RNase-Free离心管中,加入相同体积的乙醇(70%)并混匀并加入到收集管中,12 000 rpm离心半分钟后弃流出液,加入700μl RW1 12 000 rpm离心半分钟后弃流出液;加入500μl RW2 12 000 rpm离心半分钟后弃流出液;加入35μl无RNase的水离心;得到的RNA保存在-80℃,防止降解。
1.3.3 测定RNA的浓度和纯度 该研究中采用紫外分光光度仪(NP80,NanoPhotometer)分别在D260和OD280条件下进行数据检测并进行实验记录、数据分析。具体方法是从上述1.3.2实验步骤中保存的RNA液体中,吸取1.5 mL进行测定。
1.3.4 RNA逆转录 在准备好的RNase-free离心管中配制如下混合液(包括模板DNA、4×gDNA wiper Mix、RNase-free ddH2O),总容量16μl。在上述混合液中加入4μl的5×HiScript II qRT SuperMix II后混匀,加热至50℃并保持该温度15 min,后转至85℃并保持5 s,产物用于qPCR反应。
1.3.5 流式检测凋亡实验 转染成功后分组处理细胞,24 h后流式检测各组细胞凋亡情况。
1.3.6 流式检测周期实验 转染成功后分组处理细胞,24 h后流式检测各组细胞周期情况。
1.4 统计方法
采用SPSS 20.0统计学软件进行数据分析,计量资料以(±s)表示,采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 细胞中的Circ_0104346相对表达量情况比较
4组细胞间Circ_0104346相对表达量使用LSD法进一步对差异进行比较,可以看出其中SaOS-2>MG-63>SOSP-9607=U20S。表明SaOS-2细胞中Circ_0104346相对表达量最高,差异有统计学意义(P<0.05)。见表1。

表1 细胞中的Circ_0104346相对表达量比较
2.2 干扰Circ_0104346表达后各组细胞凋亡结果比较
3组细胞间的细胞凋亡可以看出干扰组>空载组>对照组。表明干扰Circ_0104346表达后,骨肉瘤细胞凋亡增加,增殖能力下降。差异有统计学意义(P<0.05)。见表2。
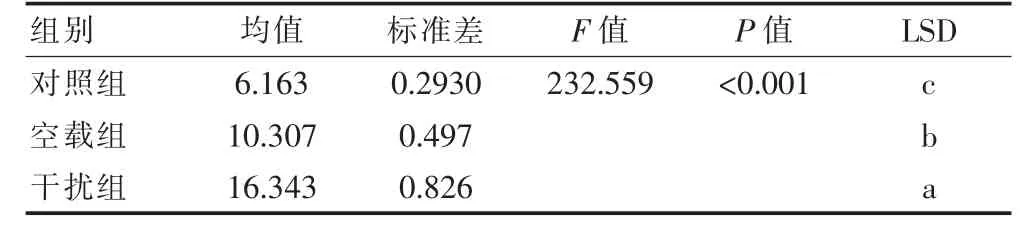
表2 干扰Circ_0104346表达后各组细胞凋亡率比较
2.3 干扰Circ_0104346表达后各组细胞周期检测结果比较
干扰组细胞处于G0/G1期数量明显增多,处于S期细胞明显减少,结果表明干扰Circ_0104346表达后,骨肉瘤细胞增殖及迁移能力明显下降。
为了研究3组细胞间的细胞处于G0及G1期的细胞数是否有不同,使用LSD法进一步对差异进行比较,可以看出干扰组>空载组>对照组,差异有统计学意义(P<0.05)。见表3。

表3 干扰Circ_0104346表达后各组细胞GO/GI数据比较
为了研究不同分组之间S有无差异,使用LSD法进一步对差异进行比较,可以看出对照组=空载组>干扰组,使用单因素方差分析进行检验,结果显示差异有统计学意义(P<0.05)。见表4。

表4 干扰Circ_0104346表达后各组细胞S数据比较
3 讨论
人骨肉瘤是儿童及青少年常见的骨原发性恶性肿瘤,合并转移性疾病及耐药的患者预后差,骨肉瘤耐药机制及新的靶标尚不明确[7-8]。CircRNA是一种非编码RNA,参与了生长发育、衰老、疾病等多种生命活动过程,具有调控基因表达的重要功能[9-10]。截至目前发现的CircRNA根据其来源可分为4类:外显子来源的环状RNA(CircRNA)、外显子及内含子共同组成的环状RNA(ElciRNA)、内含子来源的环状RNA(ciRNA)和通读环状RNA(rt-CircRNA)[11]。其中CircRNA存在人体许多组织中,如肝脏、肾脏、心血管、牙周组织、周围神经、肠道、子宫内膜中等发挥组织修复作用。随着研究的不断深入,人们总结出CircRNA具有以下生物学特征:CircRNA具有特殊的共价闭合环状结构,因而具有高度的稳定性;CircRNA在真核生物中广泛表达,截至到目前研究发现有超过20 000种的CircRNA,数量远远超过线型RNA;高度物种保守性,从目前发现CircRNA的生物学特性分析来看,多数具有高度保守的特性;从CircRNA分布来看,多数位于细胞质内,有些分布在细胞核内,因此其在细胞中的表达及分布存在特异性;CircRNA在不同系统的疾病或同一组织发育的不同阶段表达的种类和数量也有不同,表现出组织特异性和发育阶段特异性。CircRNA的生物学特征主要表现在:海绵吸附功能、调节基因转录、调节RNA结合蛋白、翻译合成蛋白质、调控细胞间信号通路,通过这些生物学的特性在疾病的发生和发展的过程中起到极其重要的作用。
近年来,CircRNA在神经系统、心血管系统、呼吸系统等领域积累了一定数量的研究成果,另外研究还发现其在乳腺癌、肝癌、胶质瘤、肺癌、直肠癌等恶性肿瘤中也有异常的表达,CircRNA已经成为某些恶性肿瘤诊断指标和治疗靶点。Zhu X等[12]通过对肺癌组织进行CircRNA测序发现,39个CircRNA的表达上调,20个CircRNA的表达下调。同样但其在骨肉瘤中的作用仍有待进一步研究。
前期采用高通量CircRNA芯片技术检测4例人骨肉瘤组织及对应癌旁组织中CircRNA表达谱,发现CircRNA在骨肉瘤组织中也同样存在者特异性和差异性表达。其中Circ_0104346高表达,具体作用机制尚不明确。在利用骨肉瘤细胞进行相关的分子生物学实验中,需要一种Circ_0104346表达含量高的骨肉瘤细胞系来进行细胞分子生物学的实验[13]。
MG-63是一种常用的人骨肉瘤细胞,在其B细胞受体中,检测出包括UVA活化蛋白激酶和络氨酸激酶受体,表明MG-63可能有助于进行候选生物标志物治疗及骨肉瘤的诊断研究,并可以为骨肉瘤的分子生物学机制研究提供合适的载体[14-15];U-2OS是由Ponten J和Saksela E在1964年从1名15岁女性的胫骨中等分化的肉瘤中分离建立的[16]。该细胞能表达胰岛素样生长因子Ⅰ、Ⅱ(IGF-Ⅰ、IGF-Ⅱ)受体和骨肉瘤衍生生长因子(ODGF);人成骨肉瘤细胞Saos-2是Fogh J和Trempe G分离和鉴定的众多人类肿瘤细胞系中的一种,该细胞来自1名11岁的白人女性的骨肉瘤组织[17-18];SOSP-9607组织来源于一名17岁男性患者,1996年7月16日因左胫骨上段成骨肉瘤行左大腿高位截肢术,截肢标本取材病理诊断成骨肉瘤(软骨母细胞型)[19-20]。
该研究利用PCR对4种人骨肉瘤细胞系中的Circ_0104346进行检测,结果显示在上述四种细胞系中SaOS-2细胞系的Circ_0104346表达最高,和其他3种细胞比较差异有统计学意义(P<0.05),因此该骨肉瘤细胞可以作为骨肉瘤耐药机制的分子细胞学研究载体。
后续选择SaOS-2细胞进行干扰实验,干扰细胞中的Circ_0104346表达后,骨肉瘤细胞的凋亡率明显增加,处于G0/G1细胞数量增多,处于S其细胞明显减少,表明骨肉瘤细胞的迁移及侵袭能力明显下降。
综上所述,骨肉瘤细胞中Circ_0104346表达上调,干扰Circ_0104346的表达能抑制其细胞迁移及增殖能力。

