LRG1和TNF-α在乳腺癌患者外周血中表达水平的变化及临床意义
王诗然,邹明明,欧津瑞,闫敏,孙凯源,孙平
1.牡丹江医学院,黑龙江牡丹江 157011;2.牡丹江医学院解剖教研室,黑龙江牡丹江 157011
乳腺癌是乳腺导管上皮及末端导管上皮发生的恶性肿瘤。大多数乳腺癌是可发现、可触及的肿块。少见表现为乳头溢液及乳头回缩。腋窝肿块晚期,表现为皮肤溃疡、皮肤结节、呈橘皮样改变。患者生存期,取决于能否得到早期正确诊断和治疗。超声检查是目前筛查乳腺恶性肿瘤的主要手段之一。近年来,乳腺癌的发病机制及治疗靶点在飞速发展的分子生物学技术作用下受到了临床日益广泛的关注[1],而在疾病的进展过程中,细胞因子在肿瘤免疫应答中发挥着极为重要的调节作用[2]。该研究回顾性分析2019年10月—2020年10月该院乳腺癌患者50例的临床资料,探讨乳腺癌患者外周血中LRG1和TNF-α表达水平的变化及临床意义,现报道如下。
1 资料与方法
1.1 一般资料
回顾性选取该院收治的乳腺癌患者50例作为乳腺癌组,年龄33~94岁,平均(54.2±9.3)岁;另回顾性选取同期乳腺良性病变患者50例作为乳腺良性病变组;健康体检人员50名作为健康对照组。乳腺良性病变组患者年龄32~93岁,平均(53.5±9.1)岁;健康对照组人员年龄31~94岁,平均(53.2±9.4)岁;3组人员的一般资料比较差异无统计学意义(P>0.05),具有可比性。该研究经过医院医学伦理委员会批准,患者或家属对研究知情同意。
1.2 纳入与排除标准
纳入标准:均符合乳腺癌的诊断标准[3]。排除标准:接受过放化疗治疗。
1.3 方法
在3组人员入院第2天上午6∶00抽取其3 mL空腹静脉血,室温下、4℃的温度下分别静置30 min~1 h、抗凝和离心15 min(速率:2 000 r/min),-70℃的低温中保存上层血浆待检。运用酶联免疫吸附法,应用酶联免疫吸附试剂盒(RD公司)对450 nm波长处样品吸光度(OD)值进行检测,将横坐标、纵坐标分别设定为OD值、标志物浓度,绘制标准曲线来、计算样品浓度,在此过程中分别采用curve exkpert软件、应用标准曲线的回归方程式;采用全自动酶标仪(Multiskan Ascent),运用酶联免疫吸附法,应用武汉博士德生物工程有限公司生产的试剂盒对外周血中肿瘤坏死因子-α(TNF-α)表达水平进行测定。
1.4 观察指标
3组人员的外周血中LRG1和TNF-α表达水平;乳腺癌组不同临床分期患者的外周血中LRG1和TNF-α表达水平。
1.5 统计方法
采用SPSS 21.0统计学软件处理数据,计量资料采用(±s)表示,组间差异比较进行t检验;P<0.05为差异有统计学意义。
2 结果
2.1 3组研究对象外周血中LRG1和TNF-α表达水平比较
乳腺癌组、乳腺良性病变组患者的外周血中LRG1和TNF-α表达水平均显著高于健康对照组,差异有统计学意义(F=471.229、424.059,P<0.05);乳腺癌组患者的外周血中LRG1和TNF-α表达水平均显著高于乳腺良性病变组,差异有统计学意义(P<0.05)。见表1。
表1 3组研究对象外周血中LRG1和TNF-α表达水平比较(±s)
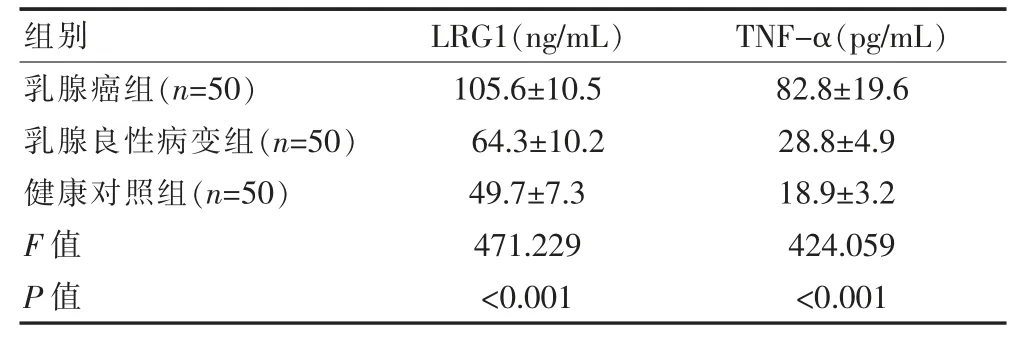
表1 3组研究对象外周血中LRG1和TNF-α表达水平比较(±s)
?
2.2 乳腺癌组不同临床分期患者外周血中LRG1和TNF-α表达水平比较
乳腺癌组Ⅱ期患者的外周血中LRG1和TNF-α表达水平均显著低于Ⅲ期、Ⅳ期患者,差异有统计学意义(F=12.625、36.892,P<0.05);Ⅲ期患者的外周血中LRG1和TNF-α表达水平均显著低于Ⅳ期患者,差异有统计学意义(P<0.05)。见表2。
表2 乳腺癌组不同临床分期患者外周血中LRG1和TNF-α表达水平比较(±s)
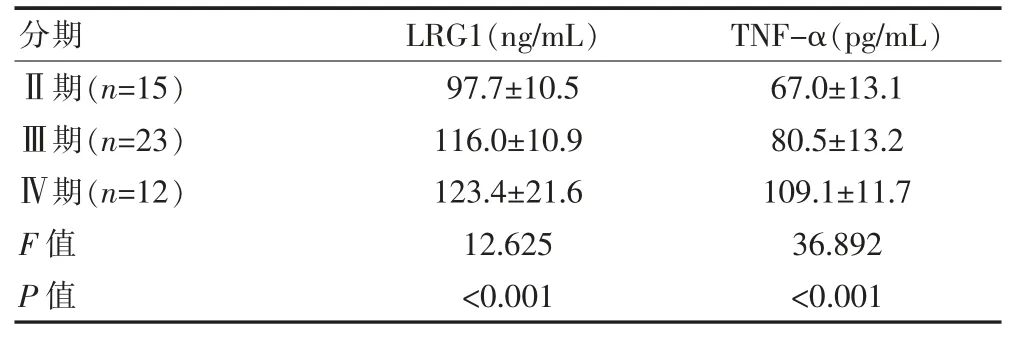
表2 乳腺癌组不同临床分期患者外周血中LRG1和TNF-α表达水平比较(±s)
?
3 讨论
乳腺癌是乳腺导管上皮及末端导管上皮发生的恶性肿瘤,多见于成年女性,目前已成为女性恶性肿瘤的第一高发肿瘤。乳腺不是维持人体生命活动的重要器官,所以原位乳腺癌并不致命,但由于乳腺癌细胞丧失了正常细胞的特性,细胞之间连接松散,容易脱落,癌细胞一旦脱落,游离的癌细胞可以随血液或淋巴液播散全身,形成转移,引发机体其它症状,从而危及生命。大多数乳腺癌是可发现、可触及的肿块,少数表现为乳头溢液及乳头回缩。腋窝肿块晚期,表现为皮肤溃疡、皮肤结节、呈橘皮样改变。患者生存期,取决于能否得到早期正确诊断和治疗。超声检查是目前筛查乳腺恶性肿瘤的主要手段之一。
细胞因子是一类多肽物质,在体内的生物学效应广泛,具有较多的种类,细胞因子之间相互制约、相互调节,促进复杂的细胞因子网络形成,LRG1和TNFα在网络中占有重要地位,一方面对机体自身免疫及抗感染免疫进行介导,另一方面对肿瘤生长、转移造成了直接影响[4]。LRG1归属于富含亮氨酸重复序列家族,分子量、等电位点分别为44~55 kD、4.52~4.72,人LRG基因在染色体19p13.3上定位[5]。在中性粒细胞早期分化判定中,LRG1可能是一种新的标志物[6]。近年来,相关医学研究表明,LRG是一类急相蛋白,高表达于急性期机体应答中[7-11]。相关医学研究表明,LRG1信使RNA是微小RNA-335的靶点,将miR-335下调,进而上调转化生长因子-β信号途径成员丝裂原活化蛋白激酶磷酸酶-1等,从而为神经细胞瘤分化、迁移提供有利条件[12-13]。相关医学学者研究表明,在乳腺癌的诊断中,血清LRG1水平提升(50.6 ng/mL→103.8 ng/mL),可能是一种潜在的生物标记物[14-15]。该研究结果表明,乳腺癌组患者的外周血中LRG1和TNF-α表达水平分别为(105.6±10.5)ng/mL、(82.8±19.6)pg/mL,乳腺良性病变组患者的外周血中LRG1和TNF-α表达水平分别为(64.3±10.2)ng/mL、(28.8±4.9)pg/mL,健康对照组的外周血中LRG1和TNF-α表达水平分别为(49.7±7.3)ng/mL、(18.9±3.2)pg/mL。乳腺癌组、乳腺良性病变组患者的外周血中LRG1表达水平显著高于健康对照组(P<0.05),乳腺癌组患者的外周血中LRG1表达水平显著高于乳腺良性病变组(P<0.05)。乳腺癌组Ⅱ期患者的外周血中LRG1表达水平显著低于Ⅲ期、Ⅳ期患者(P<0.05),Ⅲ期患者的外周血中LRG1表达水平显著低于Ⅳ期患者(P<0.05),和上述研究结果一致。
TNF-α一方面对一些肿瘤生长进行抑制,另一方面为卵巢癌的肺转移提供有利条件,对肿瘤具有双向作用[16]。其产生形式为自分泌、内分泌、旁分泌,对机体来说,高水平的TNF会引发恶液质[17]。相关医学研究表明,和乳腺良性病变患者、健康人群相比,乳腺癌患者具有显著较高的TNF-α水平,同时,随着临床分期的提升,TNF-α水平逐渐提升,以此认为在乳腺癌的发生发展过程中,TNF-α可能发挥了重要作用,对外周血中TNF-α水平进行检测能够为临床预测乳腺癌患者病情进展提供有效依据[18-19]。该结果表明,乳腺癌组、乳腺良性病变组患者的外周血中TNF-α表达水平显著高于健康对照组(P<0.05),乳腺癌组患者的外周血中TNF-α表达水平显著高于乳腺良性病变组(P<0.05)。乳腺癌组Ⅱ期患者的外周血中TNF-α表达水平显著低于Ⅲ期、Ⅳ期患者(P<0.05),Ⅲ期患者的外周血中TNF-α表达水平显著低于Ⅳ期患者(P<0.05),和上述研究结果一致,说明高水平的TNF-α可能促进了乳腺癌的发生发展。发生这一现象的原因为TNF-α的分泌主体为肿瘤细胞、单核巨噬细胞,体内淋巴细胞在不断加重的肿瘤负荷作用下被激活,将TNF-α过度释放出来,提升血中TNF-α水平[20-22]。
综上所述,乳腺癌患者外周血中LRG1和TNF-α表达水平升高,为临床诊断乳腺癌及其分期提供了有效依据,值得推广。

