流感病毒感染患者外周血中NKG2D及细胞因子水平变化的研究
涂海霞,曹敏,王守星,于青云,黄河
南京医科大学附属逸夫医院病理与临床检验中心,江苏南京 211100
流感病毒是临床中较为常见的呼吸道感染病原体,常造成鼻腔、咽喉部的急性炎症,影响着人类的身体健康及生活质量[1]。NKG2D是NK细胞表面的活化性受体,属于跨膜性受体,分子量大约为42kD,能与MHC-Ⅰ类相关分子Α和B结合,通过PI3K通路,利用相关DAP10多肽活化NK细胞的活性[2-3]。有研究表明,NKG2D和它的多种配体共同组成的一个强大的压力诱导监测系统,可以对受感染、发炎和恶性转化的细胞产生一定的抵抗作用,并且在抗肿瘤免疫监视中起决定性作用[4-5]。流感病毒感染呼吸道上皮细胞后,还诱导产生一系列促炎症因子。细胞因子是由多种细胞(特别是免疫细胞)所产生、具有广泛生物学活性的小分子蛋白质。细胞因子种类繁多、功能各异,它们在免疫细胞的分化发育、免疫调节、炎症反应中发挥重要作用[6-7]。该研究通过检测该院2019年3—4月流感爆发期间44例流感病毒感染患者及同期55名体检健康者的外周血中表面受体NKG2D及一系列细胞因子的表达变化,旨在了解流感患者机体免疫状态的变化,方便临床对疾病的早期诊疗,现报道如下。
1 对象与方法
1.1 研究对象
经南京医科大学附属逸夫医院伦理委员会批准及患者知情同意,选取该院流感爆发期间共44例临床诊断为流感病毒感染的门诊患者作为疾病组,其中男性18例,女性26例;年龄16~63岁,平均年龄(31.91±1.93)岁。选取同期55名体检健康者作为对照组,其中男性26名,女性29名;年龄21~65岁,平均年龄(31.55±1.42)岁。采集两组EDTΑ抗凝的新鲜外周血2 mL和对应血清2 mL,进行WBC及五分类计数,使用流式细胞仪进行CD3+CD4+、CD3+CD8+、CD16+CD56+、NKG2D及细胞因子表达水平的检测。
1.2 主要仪器与试剂
①WBC五分类:采用希森美康XN-B3进行检测,试剂购自希森美康;②CD3+CD4+、CD3+CD8+、CD16+CD56+、NKG2D、细胞因子:使用BECMAN公司的FC500流式细胞仪进行检测,CD3+CD4+、CD3+CD8+、CD16+CD56+及溶血素试剂购自北京同生时代;NKG2D试剂购自BD公司;细胞因子购自青岛瑞斯凯尔生物科技有限公司。
1.3 方法
1.3.1 WBC五分类 使用半导体激光流式细胞技术结合核酸荧光染色技术。
1.3.2 淋巴细胞亚群分析及NKG2D的检测 分别使用荧光标记的单克隆抗体组合1(CD45PC7、CD4FITC/CD8PE/CD3PC5)和组合2(CD3FITC/CD16+56PE、NKG2DPC5.5)对研究对象外周全血进行染色,组合2另设对照管(管内不加入NKG2DPC5.5标记,其余制备方法完全相同)。取50μl EDTΑ抗凝血,室温避光15 min,加入经10倍稀释的免洗溶血素500μl,室温避光15 min,样本溶血充分后使用流式细胞仪FC500检测,使用CXP Cytometer软件进行分析。
细胞亚群设门策略:组合1中T1为白细胞群,以T1为门,定义CD3+为T细胞群(T2),再以T2为门,分别定义出CD3+CD4+T细胞群(T3)和CD3+CD8+T细胞群(T4),见图1;组合2中N1为白细胞群,以N1为门,定义CD3-CD16+56+细胞为NK(N2)和CD3+CD16+56+细胞为NKT(N3),最终分析NK其表面活化性相关受体NKG2D表达的百分含量,见图2。
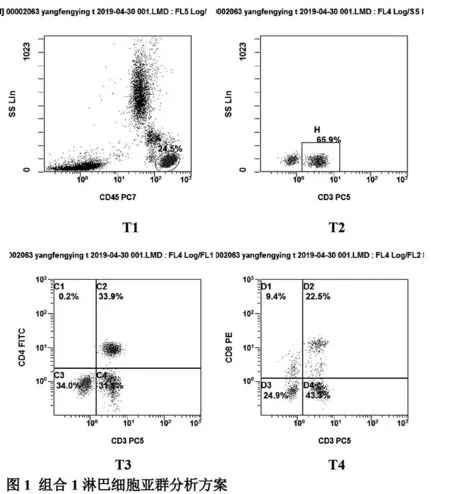
图1 组合1淋巴细胞亚群分析方案
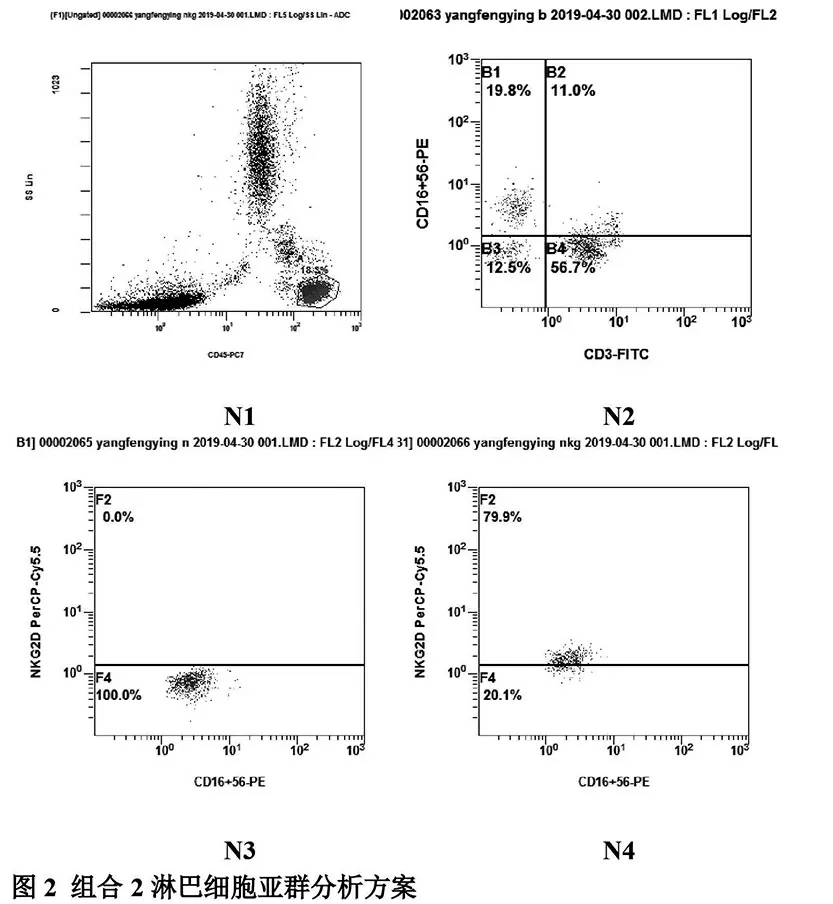
图2 组合2淋巴细胞亚群分析方案
1.3.3 细胞因子检测 两组血液标本采集30 min后,4 000 rpm离心5 min,取25μl样本,分别加入25μl实验缓冲液、25捕获微球检测抗体、25μl检测抗体,避光震荡2 h后加入25μl染料,避光震荡30 min。加10×洗涤液300μl,300~400 g常温离心5 min,使用流式细胞仪FC500进行检测分析。
1.4 统计方法
使用SPSS 20.0统计学软件分析处理数据,采用单样本Kolmogorov-Smirnov检验数据的正态性,正态分布的计量资料使用(±s)表示,组间比较采用t检验;非正态分布的计量资料用中位数(M)和四分位数间距(M25,M75)表示,组间比较采用非参数Mann-WhitneyU检验,P<0.05为差异有统计学意义。
2 结果
2.1 疾病组与对照组性别、年龄及WBC水平比较
将疾病组与对照组年龄、性别和WBC水平分别进行K‐S检验,其中性别、WBC呈正态分布(P>0.05),年龄呈非正态分布(P<0.05)。正态分布数据进行t检验,非正态分布数据使用Mann-WhitneyU检验,结果显示,疾病组与对照组年龄、性别及WBC水平差异无统计学意义(P>0.05),见表1。

表1 疾病组与对照组WBC水平比较
2.2 疾病组与对照组WBC五分类计数水平比较
在两组WBC对比差异无统计学意义的基础上,对WBC进行五分类计数,将疾病组与对照组分类计数水平分别进行K-S检验,其中单核细胞、淋巴细胞、嗜碱性粒细胞呈正态分布(P>0.05),进行t检验;中性粒细胞、嗜酸性粒细胞呈非正态分布(P<0.05),使用Mann-WhitneyU检验。结果显示,两组中性粒细胞、嗜酸性粒细胞差异无统计学意义(P>0.05),而单核细胞、淋巴细胞、嗜碱性粒细胞计数差异有统计学意义(P<0.05),见表2。
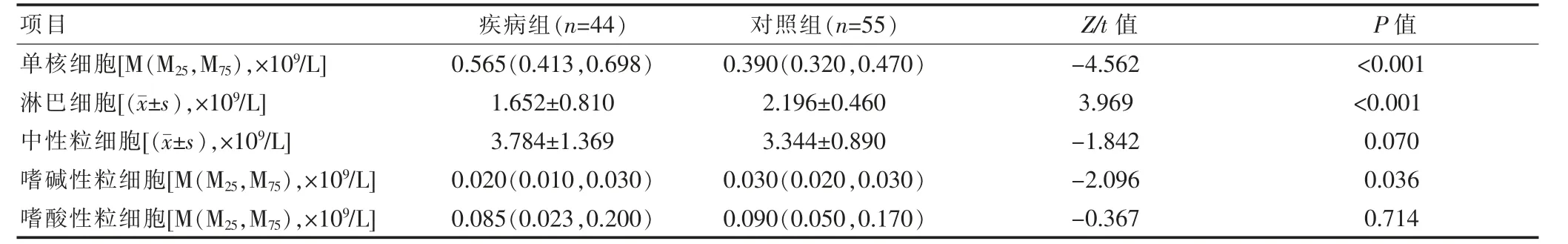
表2 疾病组与对照组WBC五分类计数水平比较
2.3 疾病组与对照组淋巴细胞亚群表达水平比较
在正常WBC分类中,单核细胞和嗜碱性粒细胞所占比例不超过10%,淋巴细胞占20%~50%,故使用流式细胞术对淋巴细胞亚群结果进行再一步分析,除CD3+CD16+56+呈非正态分布(P<0.05),其余指标均呈正态分布(P>0.05)。检测后发现两组CD3+CD4+、CD3+CD8+和CD16+CD56+差异无统计学意义(P>0.05),而NKG2D表达水平差异有统计学意义(t=3.670,P=0.001),见表3。
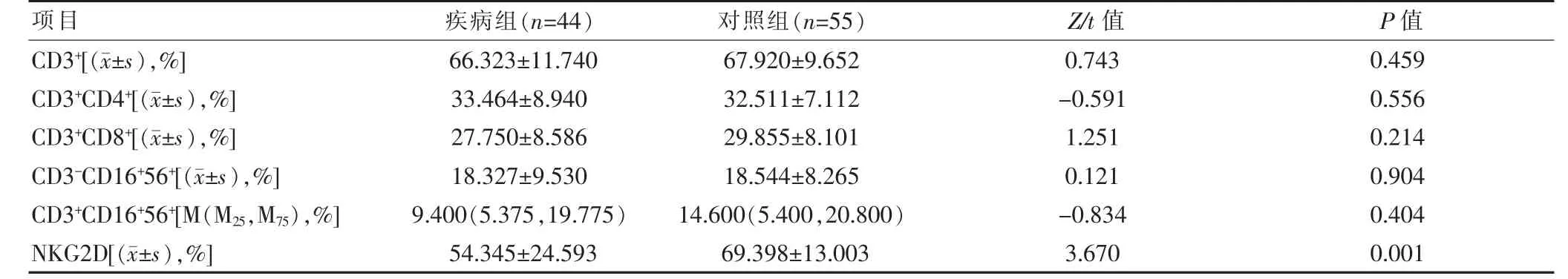
表3 疾病组与对照组淋巴细胞亚群表达水平比较
2.4 疾病组与对照组细胞因子表达水平比较
细胞因子在免疫调节、炎症应答等生理和病理过程中均发挥着重要作用,使用流式细胞术对细胞因子表达水平进行分析,检测数据均呈非正态分布,使用Mann-WhitneyU检验后发现两组IL-17和TNF-α差异无统计学意义(P>0.05),而除此之外的其他细胞因子差异有统计学意义(P<0.05),见表4。
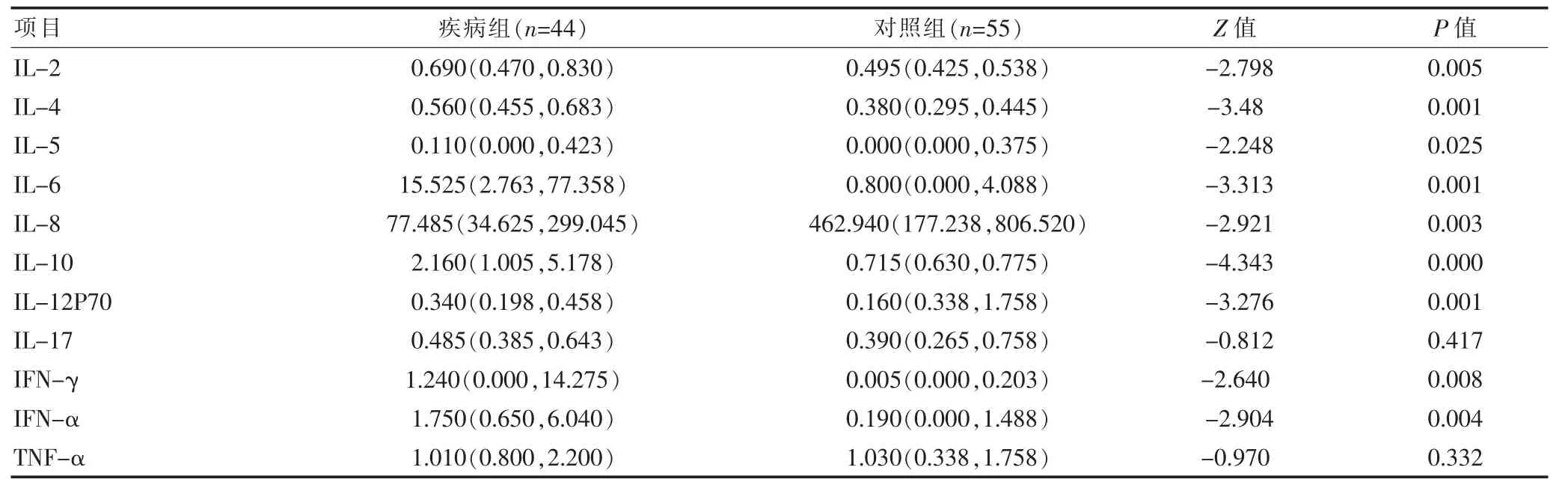
表4 疾病组与对照组细胞因子表达水平比较[M(M25,M75),pg/mL]
3 讨论
流感病毒主要通过空气中的飞沫、易感者与感染者之间的接触或与被污染物品的接触进行传播,一般秋冬季节是高发期。人流感主要是甲型流感病毒和乙型流感病毒引起的。人群普遍易感,潜伏期长短取决于侵入的病毒量和机体的免疫状态,发病率高,病死率低,多以淋巴细胞和单核细胞浸润为主[8-9],这与该研究结果两组单核及淋巴细胞对比差异有统计学意义的结果相一致。
该研究中,两组CD3+CD4+、CD3+CD8+细胞亚群之间差异无统计学意义(P>0.05),疾病组各淋巴细胞亚群计数略低于对照组,提示机体抗病毒能力的下降,但流感病毒感染后,病毒感染进展过程中存在适应性免疫受损,T细胞亚群能通过相互影响、相互调节、相互制约保持动态平衡,这可能与非重症有关[10]。CD3、CD4、CD8是T细胞受体识别外来抗原的辅助分子,表达这些分子的淋巴细胞是抗病毒免疫的重要组成部分,这些细胞数量的减少提示CD3、CD4、CD8是常见的T淋巴细胞表面标志物。CD3+CD4+细胞亚群能分泌细胞因子增强吞噬细胞的抗感染机制和直接诱导靶细胞凋亡,对细胞免疫起正调节作用;CD3+CD8+细胞亚群主要为抑制性T细胞,抑制机体免疫应答,也对靶细胞具有一定杀伤作用,对细胞免疫起负调节作用。当不同的T淋巴细胞亚群在数量上和功能上发生异常时,即可导致机体免疫功能紊乱。
疾病组NKG2D表达水平与对照组相比呈下调趋势[(54.345±24.593)vs(69.398±13.003)],这符合流感病毒逃避NK细胞的杀伤效应[11]。患者发生流感感染后,固有和适应性免疫细胞均参与介导宿主对病毒感染的免疫反应[12]。自然杀伤细胞(NK)是固有免疫系统的主要效应细胞,能有效地杀灭病毒感染的细胞,进而控制病毒感染。NK细胞作用于流感病毒的同时,有研究证明了流感病毒也具有反击机制,主要通过直接诱导NK细胞凋亡、通过抑制性受体抑制NK细胞活化、抑制NK细胞产生TNF-α等不同的机制作用于NK细胞,影响NK细胞发挥杀伤功能,形成有效感染[13]。CD16+CD56+是NK细胞的表面标志,与T细胞淋巴亚群相似,可能由于NK细胞的杀伤和免疫逃逸作用[14],两组数据CD16+CD56+淋巴细胞水平之间差异无统计学意义。NKG2D是NK细胞表面重要的活化性受体,与配体结合后可激活NK细胞和CD8+效应细胞,产生抗病毒干扰素IFN-γ发挥细胞毒性作用,杀死被流感病毒感染的上皮细胞[15]。NKG2D还可作为协同刺激因子传递第二信号,增强其他活化性受体对NK细胞的激活作用[16]。
T淋巴细胞可以诱导分化为Th1,Th2,Th17,分泌产生不同的细胞因子,Th1产生IL-2、IL-8、IL-12、TNF-α和IFN-γ,促进细胞介导的免疫反应;Th2分泌IL-4、IL-5、IL-6、IL-10、TNF-α,诱导B细胞的活化和分化;Th17产生IL-17及TNF-α,免疫功能的紊乱势必影响细胞因子表达水平的改变。流感病毒感染人体后,可以诱发细胞因子风暴,导致全身炎症反应[17]。该研究结果显示,疾病组与对照组相比,除IL-17及TNF-α差异无统计学意义之外,其他细胞因子水平差异有统计学意义。该研究中IL-17检测差异无统计学意义,但在既往研究中IL-17对甲型与非甲型流感病毒感染相关肺炎患者具有较高的诊断灵敏度和特异性[18],但在临床感染中通常存在甲流乙流的混合感染,故单独检测IL-17意义不大。流感病毒感染时血清中IL-8明显低于正常对照组,可能跟IL-8水平的变化能够敏感地反映病情严重程度有关[19]。
该研究中,疾病组IL-2、IL-4、IL-5、IL-6、IL-10、IL-12P70及IFN-α、IFN-γ水平则明显高于对照组(P<0.05),这与杨艳娥等[20]研究结果相符。在其研究中分析呼吸道感染的热性惊厥患儿IL-6、IL-10水平表达,结果显示感染组患儿IL-6水平(27.70±8.74)ng/L及IL-10(2.15±0.55)ng/L显著高于健康对照组患儿(4.46±1.10)ng/L、(6.37±1.76)ng/L(P<0.001)。于涛等[21]在其研究中对呼吸道感染患者进行炎性细胞因子分析发现呼吸道病毒感染组TNF-α为(39.2±2.5)显著高于无感染对照组(16.6±2.3)(P<0.001)。IL-4、IL-5是Th2细胞分泌的特异性细胞因子,两者都能够刺激嗜酸性粒细胞活化、增殖、分化、移行,进而分泌多种炎症介质参与炎症反应[22]。TNF-α主要由巨噬细胞及活化的单核细胞分泌,为炎症反应的始动因子,是机体损伤期间宿主反应最早、最强的介质之一,在重症炎症反应中高表达,同时亦可对机体免疫功能产生抑制作用[23]。章海峻等[9]的研究显示甲型/乙型流感患者血清IL-2、IL-6、IL-10水平明显高于对照组(H=10.43、6.78、114.26、67.43,P<0.05);同样的结果在其他研究中也有报导,王海等[24]研究显示流感病毒感染后,外周血中IL-12上升,其研究中流感组的IL-12水平高达(134.2±42.8)ng/L,显著高于健康对照组(96.2±36.9)ng/L(P<0.05)。IL-6是机体应激反应中最敏感、最重要的一种标志物,T细胞、B细胞及活化的单核细胞都能在不同条件下产生IL-6,具有促进和抑制炎症反应的免疫代偿作用,对维持机体稳态有重要作用[25]。IL-6是目前临床运用较广泛的炎症指标,检测便捷。血清IL-6水平和流感严重程度之间有着紧密的关系,同时也会影响到患者的预后[26],因此如何在短时间内改善IL-6水平是临床重要的治疗方向[27]。该研究显示,流感患者血清TNF-α水平与对照组差异无统计学意义,分析原因可能与流感产生的炎症反应较轻有关。
综上所述,流感患者外周血淋巴细胞上NKG2D表达水平降低,IL-8水平低于对照组,IL-2、IL-4、IL-5、IL-6、IL-10、IL-12P70及IFN-α、IFN-γ水平则明显高于对照组,这对患者机体免疫功能的状态、病情评估有一定临床价值,可以作为诊断及监测疾病进展的有效指标,为流感的预防、诊断及治疗提供一定的帮助。该文阐明了疾病发生后不同细胞亚群之间的相关性,为流感感染的诊断、治疗和新型疫苗的研究提供理论依据和技术支持。

