古巴栓孔菌胞内及胞外多糖的体外生理活性*
刘柯灵,李奕葶,史维丽,班立桐,孙 宁,黄 亮
(天津农学院农学与资源环境学院,天津 300384)
古巴栓孔菌(Tramtes cubensis) 是一类属于多孔菌科 (Polyporaceae) 栓菌属 (Trametes) 的大型木腐真菌。栓菌属含有的大量药用真菌,具有抗炎、降血糖、抗肿瘤和抗氧化等功效[1]。迄今为止,栓菌属中被驯化的有云芝(Coriolus versicolor)、香栓菌(Trametes suaveloens)、血红栓菌 (Trametes san-guinea)、迷宫栓孔菌 (Trametes gibbosa) 等[2-4]。目前,关于古巴栓孔菌的研究鲜有报道,其药用价值以及生理活性亟待深入研究。
真菌多糖具有良好的生理活性,如抗氧化、抗肿瘤、抑菌与调节免疫等[5]。虽然目前没有关于古巴栓孔菌多糖的相关文献报道,但已有研究证实同样属于多孔菌科的灵芝(Ganoderma lucidum)、茯苓(Poria cocos)、灰树花 (Griflola frondosa),以及同属多孔菌科栓菌属的云芝、红栓菌(Trametes sanguinea)等药用真菌的多糖就具有显著的生理活性[6]。如灵芝多糖不仅具有提高免疫力的作用,还具有抗肿瘤与降血糖等效果[7-10];茯苓多糖具有增强免疫力的作用,Pu[11]研究表明茯苓多糖PCP(Poria cocos polysaccharide,PCP) 能激活NF-κB蛋白通过Ca2+/PKC/p38信号通路发挥免疫功能效果;灰树花多糖在真菌多糖中具有最显著的抗癌活性,其机制可能与增加BAK-1基因的表达,引起细胞凋亡有关[12];云芝多糖具有显著的抑制肿瘤、调节免疫、消炎护肝、抗氧化等生理活性[13];朱红栓菌子实体与菌丝体的胞内和胞外多糖,均具有良好的抗肿瘤以及调节免疫等效果[14]。
因此,为了进一步探究古巴栓孔菌多糖的生理活性,通过液体深层发酵方法,获取古巴栓孔菌的胞内多糖与胞外多糖,对其进行分离提取,并考察其体外抗氧化能力、α-淀粉酶抑制活性以及亚硝酸盐清除能力,综合评价这2种多糖的生物活性。试验结果不仅为古巴栓孔菌多糖的开发利用和进一步研究提供了一定的理论与数据基础,还为其他药用真菌多糖的研究与应用提供了思路和方向。
1 材料与方法
1.1 供试菌株
供试菌株采自福建省厦门市厦门热带植物园,经鉴定为古巴栓孔菌[1],并保藏于天津农学院食用菌研发中心。
1.2 主要试剂
拜唐苹阿卡波糖片(50 mg/片),拜耳医药保健有限公司;枯草芽孢杆菌α-淀粉酶(≥4 000 U·g-1、猪胰腺α-淀粉酶(≥10 u·mg-1),上海鼓臣生物技术有限公司;ABTS,北京索莱宝科技有限公司;DPPH,东京化成工业株式会社;可溶性淀粉,天津市风船化学试剂科技有限公司。
1.3 主要仪器设备
JY88-II超声波细胞粉碎机,宁波新芝生物科技股份有限公司;RE-2000A旋转蒸发器,上海亚荣生化仪器厂;Alpha1-2LDplus冷冻干燥机,德国克莱斯特有限公司;Centrifuge5430台式高速离心机,德国艾本德生命科学公司;Enspire酶标仪,美国珀金埃尔默(上海)有限公司;DNP-9272BS-III电热恒温培养箱,上海新苗医疗器械制造有限公司;ZWY-2112B恒温培养振荡器,上海智城分析仪器制造有限公司。
1.4 试验方法
1.4.1 菌种的培养
平板培养:取保存于PDA斜面培养基上的菌种于新鲜PDA固体培养基,25℃条件下静置培养7 d。PDA固体培养基配方:土豆提取物 200 g·L-1、葡萄糖 20 g·L-1、琼脂 20 g·L-1,pH 自然。
种子液培养:从平板培养基上取3块5 mm2的菌块,接入液体培养基,250 mL摇瓶装液量为100 mL,于25℃、160 r·min-1条件下培养7 d。种子液体培养基配方:葡萄糖20 g·L-1、酵母浸粉5 g·L-1、KH2PO41 g·L-1、 MgSO40.5 g·L-1、VB10.01 g·L-1,蒸馏水1 L,pH自然。
液体深层发酵培养:将种子液按5%(v/v)的接种量接种于液体深层发酵培养基,250 mL摇瓶装液量 100 mL,于 25℃、160 r·min-1条件下培养7 d[15]。发酵液配方:葡萄糖25 g·L-1、牛肉浸膏25 g·L-1、KH2PO41 g·L-1、 MgSO40.5 g·L-1、VB10.01 g·L-1,蒸馏水 1 L,pH 5。
1.4.2 发酵液体积及菌丝体生物量的测定
液体深层发酵培养7 d后,利用孔径0.09 mm的过滤筛分离菌丝体和发酵液,分别收集。计算发酵液体积,收集后的菌丝体于40℃烘干、称重后备用。
1.4.3 胞外多糖和胞内多糖的提取
1)胞外多糖的提取
将发酵液浓缩至原体积的1/4,加入其4倍体积的无水乙醇,于4℃冰箱静置12 h,7 000 r·min-1离心并收集沉淀。沉淀溶于蒸馏水,用Sevage法去除其蛋白质成分,重复3次~5次,水相部分为胞外粗多糖溶液,收集后浓缩、冻干、称重,储存于干燥箱中备用。
2)胞内多糖的提取
将收集到的菌丝体粉碎,采用超声波辅助水提法,提取菌丝体胞内多糖,料液比1∶15、功率150 W、超声时间30 min[13]。水提后7 000 r·min-1离心15 min,取上清,浓缩到原体积的1/4,加入其4倍体积的无水乙醇,在4℃冰箱静置12 h,再次离心后收集沉淀,沉淀溶于蒸馏水,用Sevage法去除其蛋白质成分,重复3次~5次,水相部分为胞内粗多糖溶液,收集后浓缩、冻干、称重,储存于干燥箱中备用。
1.4.4 多糖含量的测定
采用苯酚-硫酸法[16-17]测定古巴栓孔菌胞内多糖与胞外多糖的含量。向试管中加入1 mL的多糖稀释样品液、5%苯酚试剂0.5 mL以及2.5 mL浓H2SO4,摇匀,煮沸15 min,冷却后,在490 nm波长处测定。每组3个平行,由葡萄糖标准曲线回归方程计算得出多糖含量。
1.4.5 抗氧化活性的测定
1) DPPH自由基清除活性
参考LI[17]与王敏[18]所述方法进行,略做修改。将冻干后的多糖粉末,配制成质量浓度梯度分别为0.156 mg·mL-1、 0.313 mg·mL-1、 0.625 mg·mL-1、1.500 mg·mL-1、 2.500 mg·mL-1、 5.000 mg·mL-1、10.000 mg·mL-1的多糖溶液。取多糖样品溶液125 μL,加入500 μL的DPPH乙醇溶液(25 μg·mL-1),混合均匀后,置于黑暗处反应30 min;然后在517 nm波长下用酶标仪测定吸光度值,试验重复3次。DPPH自由基清除率(E1,%)计算公式为:

式中:A0为蒸馏水替代样品的反应体系吸光度值;A1为不同浓度多糖溶液的反应体系吸光度值;A2为蒸馏水替代DPPH溶液的反应体系吸光度值。
2) ABTS·+清除活性
参考张燕所述方法[19]并略作修改。将冻干的多糖粉末,配制成质量浓度梯度分别为0.156 mg·mL-1、0.313 mg·mL-1、 0.625 mg·mL-1、 1.500 mg·mL-1、2.500 mg·mL-1、5.000 mg·mL-1、10.000 mg·mL-1的多糖溶液。取多糖样品50 μL,加入ABTS·+溶液450 μL,混合均匀后反应10 min;然后在734 nm波长下用酶标仪测定其吸光度值,重复测试3次。ABTS·+自由基清除率 (E2,%) 计算公式为:
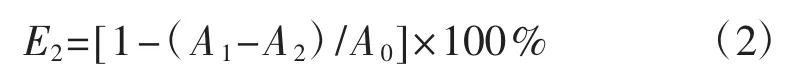
式中:A0为蒸馏水替代样品的反应体系吸光度值;A1为不同浓度多糖溶液以及阳性对照VC的反应体系吸光度值;A2为蒸馏水替代ABTS·+溶液的反应体系吸光度值。
3) 羟基自由基清除活性
根据李霞[20]与李奕葶[17]所述方法并略作修改。将冻干的多糖粉末,配制成质量浓度梯度为0.156 mg·mL-1、0.313 mg·mL-1、0.625 mg·mL-1、1.500 mg·mL-1、 2.500 mg·mL-1、 5.000 mg·mL-1、 10.000 mg·mL-1的多糖溶液。取 9 mmol·L-1的 FeSO4与 9 mmol·L-1的水杨酸-乙醇溶液各1 mL,摇匀后加入多糖溶液1 mL、8.8 mmol·L-1的H2O2溶液1 mL;水浴37℃反应1 h后,冷却至室温;在510 nm下测吸光度值,重复测试3次。羟基自由基清除率(E3,%)计算公式为:

式中:A0为蒸馏水替代样品的反应体系吸光度值;A1为不同浓度多糖溶液以及阳性对照VC的反应体系吸光度值;A2为蒸馏水替代水杨酸溶液的反应体系吸光度值。
4) 超氧阴离子清除活性
利用邻苯三酚氧化法[21]进行多糖超氧阴离子清除率的测定。将冻干后的多糖粉末,配制成质量浓度梯度为 0.156 mg·mL-1、0.313 mg·mL-1、0.625 mg·mL-1、1.500 mg·mL-1、2.500 mg·mL-1、5.000 mg·mL-1、10.000 mg·mL-1的多糖溶液。取pH 8.2的Tris-HCl缓冲液3 mL和多糖溶液1 mL,25℃下保温20 min;加入25℃下预热的7 mmol·L-1的邻苯三酚0.3 mL准确反应 4 min,加入 10 mmol·L-1的 HCl溶液 1 mL终止反应;在420 nm处测定其吸光度值,试验重复3次,取其平均值,计算清除率。超氧阴离子清除率(E4,%) 计算公式为:

式中:A0为蒸馏水替代样品的反应体系吸光度值;A1为不同浓度多糖溶液以及阳性对照VC的反应体系吸光度值;A2为蒸馏水替代邻苯三酚溶液的反应体系吸光度值。
1.4.6 α-淀粉酶活性抑制试验
采用碘-淀粉比色法分别测定古巴栓孔菌胞内多糖及胞外多糖对猪胰腺、枯草芽孢杆菌来源α-淀粉酶的抑制活性[22]。试验在0.1 mol·L-1、pH 7.0的磷酸钾缓冲液酶活力测定体系中进行。将冻干后的多糖粉末,配制成质量浓度梯度分别为0.156 mg·mL-1、0.312 mg·mL-1、 0.625 mg·mL-1、 1.500 mg·mL-1、2.500 mg·mL-1、5.000 mg·mL-1、10.000 mg·mL-1的多糖溶液。在试管中加入不同浓度的待测多糖样品0.05 mL以及0.3 g·L-1的可溶性淀粉溶液1 mL,于37℃温浴 5 min后加入 0.01 mg·mL-1的 α-淀粉酶0.05 mL。45℃反应 3 min后,加入 0.01 mol·L-1的碘液1 mL进行检测,在紫外分光光度计660 nm处测定吸光度值,阳性对照为阿卡波糖。化合物对α-淀粉酶的抑制率(E5,%)计算公式为:

式中:A0为淀粉溶液与碘液反应后的吸光度值;A1为不同浓度多糖溶液以及阳性对照阿卡波糖的反应体系吸光度值。
1.4.7 亚硝酸盐清除能力的测定
将冻干后的多糖粉末,配制成质量浓度梯度分别为 0.156 mg·mL-1、0.312 mg·mL-1、0.625 mg·mL-1、1.500 mg·mL-1、 2.500 mg·mL-1、 5.000 mg·mL-1、10.000 mg·mL-1的多糖溶液。在试管中加入浓度为5.0 μg·mL-1亚硝酸钠标准溶液1 mL以及不同浓度多糖溶液2 mL,反应10 min后加入0.4%的对氨基苯磺酸溶液2 mL,静置5 min后再加入0.2%的盐酸萘乙二胺1 mL,显色后静置15 min,在波长538 nm处测定吸光度值,阳性对照为VC溶液[24]。多糖对亚硝酸盐的清除率(E6,%)计算公式为:
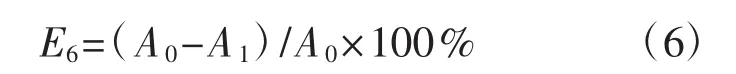
式中:A1为不同浓度样品溶液的吸光度值;A0为蒸馏水代替样品反应的吸光度值。
2 结果与分析
2.1 菌丝体生物量与多糖含量
经液体深层发酵后,古巴栓孔菌菌丝体生物量为 (2.15± 0.08) g·L-1,胞内多糖含量为 (15.42±0.26) mg·g-1,胞外多糖的含量为 (44.82 ± 1.04)mg·L-1,去除蛋白质后的胞内多糖占提取物总质量的91%,胞外多糖占提取物总质量的94%。对比4种姬松茸与13种野生灵芝的胞外多糖以及胞内多糖含量[24-26],古巴栓孔菌的胞外与胞内多糖含量均较低,究其原因与提取方法和发酵条件相关,后续试验会进一步探讨多糖的最优提取条件与最适发酵条件。
2.2 抗氧化活性
古巴栓孔菌多糖对DPPH自由基清除活性试验结果见图1。
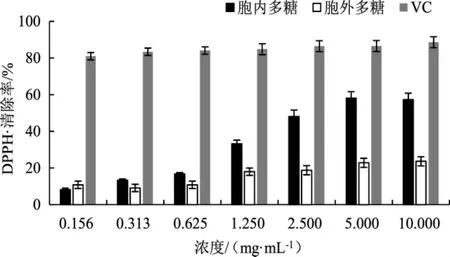
图1 多糖对DPPH自由基的清除率Fig.1 Scavenging rate of polysaccharide on DPPH·
图1结果表明,阳性对照VC对DPPH自由基有很强的清除作用,浓度为0.156 mg·mL-1的VC的清除率即可达到80%以上。在0.156 mg·mL-1~10.000 mg·mL-1内,古巴栓孔菌的胞内多糖对DPPH自由基的清除率随其浓度的增加而提高,在0.625 mg·mL-1~10.000 mg·mL-1范围内清除率明显提升,最高可达57.32%。而古巴栓孔菌的胞外多糖的最高清除率只有23.64%,且随浓度的升高,清除率并无明显变化。虽然古巴栓孔菌的胞内多糖对DPPH·的清除率低于VC,但也具有一定的抗氧化活性,而胞外多糖抗氧化活性明显较弱。
ABTS·+清除试验通常用于评价化合物总抗氧化活性[24],古巴栓孔菌多糖对ABTS·+清除活性试验结果见图2。

图2 多糖对ABTS·+的清除率Fig.2 Scavenging rate of polysaccharide on ABTS·+
如图2所示,古巴栓孔菌的胞内与胞外多糖均呈现良好的抗氧化活性,其胞内多糖在2.5 mg·mL-1浓度时,清除率已基本达到100%,与阳性对照相似。胞外多糖浓度在10 mg·mL-1时,清除率也达到100%。所测样品质量浓度范围内,随着质量浓度增加其ABTS·+清除活性随之明显增强,2种多糖都表现出较强的ABTS·+清除活性。
古巴栓孔菌多糖对羟基自由基清除活性试验结果见图3。
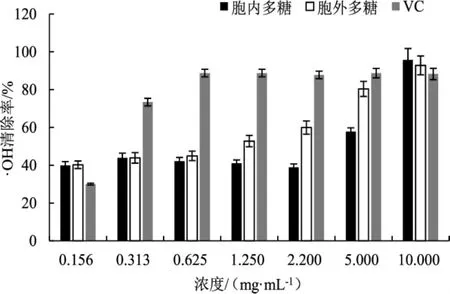
图3 多糖对羟基自由基的清除率Fig.3 Scavenging rate of polysaccharide on·OH
图3结果表明,阳性对照VC对羟基自由基有很强的清除作用,并且古巴栓孔菌的胞内多糖与胞外多糖的清除率随着浓度的增加而提高。结果还表明,多糖浓度在2.5 mg·mL-1~10.0 mg·mL-1范围内,古巴栓孔菌胞内多糖对羟基自由基的清除作用急剧上升;测试浓度范围内古巴栓孔菌的胞外多糖对羟基自由基的清除作用也随浓度的增加平稳升高,最高可达到92.85%。因此古巴栓孔菌的胞内与胞外多糖对羟基自由基也具有一定的抗氧化活性。
古巴栓孔菌多糖对超氧阴离子清除活性试验结果见图4。

图4 多糖对超氧阴离子的清除率Fig.4 Scavenging rate of polysaccharide on O2-·
由图4可知,多糖浓度范围为0.156 mg·mL-1~10.000 mg·mL-1内,2种多糖对超氧阴离子的清除作用平稳上升,且与阳性对照VC对超氧阴离子清除作用相差较小。在浓度为10 mg·mL-1时,古巴栓孔菌的胞内与胞外多糖对超氧阴离子的清除作用最高,胞内多糖的清除率为94.52%,胞外多糖为93.61%。而阳性对照VC的最高清除率为95%,说明古巴栓孔菌的胞内与胞外多糖对超氧阴离子的清除效果较好,且两者效果相差不大。
2.3 α-淀粉酶抑制活性
α-淀粉酶抑制活性通常被用作评价降血糖能力的指标之一[27],古巴栓孔菌多糖对猪胰腺来源α-淀粉酶抑制活性试验结果见图5。

图5 多糖对猪胰腺来源α-淀粉酶活性的抑制率Fig.5 Inhibition rate of polysaccharide on α-amylase activity of porcine pancreas
如图5所示,阳性对照阿卡波糖对α-淀粉酶的抑制活性随浓度升高而提升,当浓度为10 mg·mL-1时,其抑制率达到90.11%。而胞内与胞外多糖在浓度为 0.156 mg·mL-1~2.500 mg·mL-1时,对 α-淀粉酶的抑制率均低于阳性对照阿卡波糖,且抑制率无明显梯度变化,基本在42.84%~45.08%。当浓度上升至5 mg·mL-1时,胞内与胞外多糖对α-淀粉酶的抑制率均有大幅提升,且胞内多糖α-淀粉酶抑制率最高为56.81%;胞外多糖浓度为10 mg·mL-1时,α-淀粉酶的抑制率最高为55.98%。因此,古巴栓孔菌的胞内与胞外多糖对猪胰腺来源的α-淀粉酶具有一定的抑制活性,且效果相似。
古巴栓孔菌多糖对枯草芽孢杆菌来源α-淀粉酶抑制活性试验结果见图6。
由图6可知,胞内与胞外多糖质量浓度在0.156 mg·mL-1~10.000 mg·mL-1时,阳性对照阿卡波糖对枯草芽孢杆菌来源α-淀粉酶的抑制活性随浓度提升;当浓度达到10 mg·mL-1时,其抑制率达到95.24%。而古巴栓孔菌胞内与胞外多糖在浓度为0.156 mg·mL-1~2.500 mg·mL-1时,抑制效果无明显差距,基本为58.92%~64.32%。当古巴栓孔菌的胞内与胞外多糖质量浓度为5 mg·mL-1时,抑制效果有明显的提升,且抑制率均达到最高,分别为74.06%与72.30%。而当浓度达到10 mg·mL-1时,古巴栓孔菌的胞内与胞外多糖对α-淀粉酶的抑制活性均有所下降。
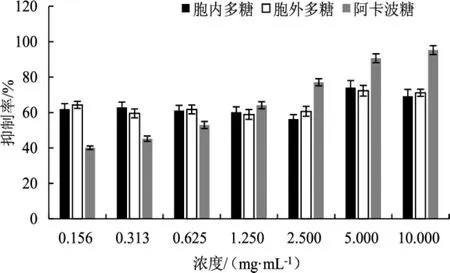
图6 多糖对枯草芽孢杆菌来源α-淀粉酶活性的抑制率Fig.6 Inhibition rate of polysaccharide on α-amylase activity from Bacillus subtilis
2.4 亚硝酸盐清除能力
古巴栓孔菌多糖对亚硝酸盐清除能力试验结果见图7。
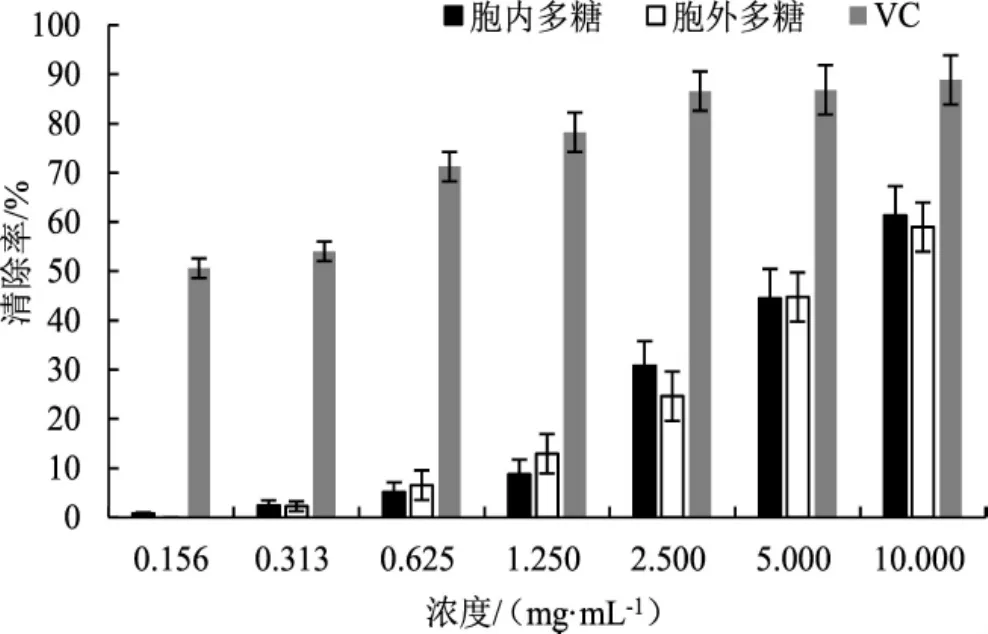
图7 多糖对亚硝酸盐的清除能力Fig.7 Scavenging rate of polysaccharide on nitrite
如图7所示,阳性对照VC对亚硝酸盐的清除作用明显,0.156 mg·mL-1VC的清除率就已经达到50.61%,最高清除率可达88.86%。在0.15 mg·mL-1~10.000 mg·mL-1,古巴栓孔菌的胞内多糖与胞外多糖对亚硝酸盐的清除率随其浓度的增加,在1.25 mg·mL-1~10.00 mg·mL-1其清除率明显提升,胞内与胞外多糖抑制率最高可达60.13%和58.97%。
3 讨论与结论
真菌多糖可以与自由基结合,形成抑制物阻止氧化,促进抗氧化酶生成以及提高抗氧化酶活性,因此具有抗氧化能力[26-28]。本研究结果表明,在清除羟自由基、ABTS·+、超氧阴离子的能力中,古巴栓孔菌的胞内多糖与胞外多糖能力相差不大。但是在对DPPH自由基的清除中,2种多糖的能力差距明显,古巴栓孔菌胞内多糖的清除能力比胞外多糖显著,并且随着浓度的升高,清除能力也逐步提升。与栓菌属中奶油栓孔菌(Trametes lactinea) 子实体多糖抗氧化活性相比,奶油栓孔菌子实体多糖浓度在1 mg·mL-1时,ABTS·+清除能力为100%;浓度增加至4 mg·mL-1时,其DPPH·清除能力为79.64%,超氧阴离子的清除能力为43.57%[29]。由此可见,奶油栓孔菌子实体多糖对ABTS+·和DPPH·清除能力,均优于本研究中提取的古巴栓孔菌胞外与胞内多糖。
α-淀粉酶可以将淀粉水解成低分子的糖类物质,抑制其活性可以缓解人体内淀粉的降解与葡萄糖的吸收。所以α-淀粉酶抑制剂可以降低II型糖尿病患者餐后血糖水平,以及减少糖尿病并发症的发生。因此,从果、蔬、谷物、菌类等天然产物中寻找α-淀粉酶抑制剂成为当今研究的热点方向[30]。近年的研究证实,真菌多糖具有显著的抑制α-淀粉酶活性的效果,其抑制活性与多糖的分子结构、空间构象以及含有的杂质含量等均相关[31]。李井雷等[32]的试验表明,纯化后的羊肚菌胞外多糖具有良好的α-淀粉酶抑制活性,且浓度达到0.8 mg·mL-1时,其抑制活性达到60%左右,与未纯化的古巴栓孔菌胞内和胞外多糖相比,具有显著的抑制效果,究其原因与多糖的种类以及纯化程度均有密切联系。
亚硝酸盐既可以直接导致DNA损伤,还能在酸性条件下与氨基酸和胺类物质反应生成亚硝胺,具有强致癌性。一些化学成分如黄酮类、多酚类、皂苷类、多糖类等,能与亚硝酸根发生化学反应,从而达到清除亚硝酸盐的作用[23]。目前,古巴栓孔菌的多糖对亚硝酸盐清除效果的研究尚未见报道,本研究结果显示2种多糖浓度达到10 mg·mL-1时,亚硝酸盐清除率均超过50%,具有较显著的清除能力。
综上所述,古巴栓孔菌的胞内、胞外多糖具有较显著的抗氧化和亚硝酸盐清除能力,而且对α-淀粉酶的活性抑制效果明显。试验结果为古巴栓孔菌胞内、胞外多糖的进一步研究提供了一定的数据及理论依据,为其作为功能性食品或食品添加剂奠定了研究基础。今后,将对2种多糖进一步研究,通过离子交换柱层析的方法进行纯化,深入探讨各种生理活性与多糖的构效关系。

