复合酶水酶法提取鹿油及其脂肪酸组成分析
夏蕴实,刘畅,王梓,孙印石*
1. 中国农业科学院特产研究所(长春 130000);2. 吉林农业大学中药材学院(长春 130000);3. 长春大学食品学院(长春 130000)
我国是世界上梅花鹿养殖历史最悠久的国家,是世界三大养鹿国(新西兰、中国、俄罗斯)之一[1]。鹿油是鹿科动物梅花鹿(Cervus nippon)或马鹿(Cervus elaphus)的脂肪油,也叫鹿脂,是一种资源丰富的鹿副产品,具有较高的可利用价值。鹿油的提取方式主要有熬制法[2]、超临界二氧化碳萃取法[3]和水酶法。熬制法因提取温度较高且不易控制火候,容易出现焦糊,对鹿油中有效成分也有一定影响,影响油脂品质;超临界二氧化碳提取法工艺繁琐且费用较高,导致所提油脂价格昂贵。
水酶法的作用原理是采用相关的酶(如淀粉酶、蛋白酶、果胶酶等)在水相中降解油料细胞壁、分解油料细胞与其他大分子形成的复合物,使油脂从油料中释放出来,并利用油和水密度不同,通过离心将非油成分和油分离[5],具有绿色环保、反应条件温和、安全等优点[4]。近年来,水酶法被广泛应用于动物油脂的提取中。吴详庭[6]以水酶法提取鲐鱼油,在酶量1 000 U/g原料,pH 7.3,45 ℃条件下提取率达78.66%,且以该法提取油脂可有效降低乳化,提高油脂提取率,操作方法简单高效,价格低廉,便于商业化生产。王庆玲等[7]首次利用水提法提取猪油并比较4种蛋白酶对提油率的影响,结果表明,碱性蛋白酶所提猪油提取率最高,可达96.82%。由于水酶法提取温度较低,与传统提油方法相比,所得猪油的基本理化指标结果均优。
有研究使用单一的木瓜蛋白酶提取鹿油,提取率较低,为73.7%±0.4%[8]。为有效提高鹿油提取率,试验以鹿板油为原料,采用复合酶水酶法提取鹿油,考察提取条件对鹿油提取率的影响,采用单因素试验和正交试验优化提取鹿油的工艺条件,利用GC-MS(气相色谱-质谱联用仪)对鹿油的脂肪酸组成进行分析与鉴定,为鹿油的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
鹿油(未经加工的新鲜梅花鹿板油,长春市世鹿鹿业有限公司);中性蛋白酶(50 000 U/g,Solarbio);碱性蛋白酶(200 000 U/g,Solarbio);氢氧化钠、甲醇、无水硫酸钠、氯化钙(北京化工厂)。
1.2 仪器与设备
ME2002/02型电子天平(梅特勒-托利多仪器(上海)有限公司);HH-4A型数显恒温水浴锅(常州国华电器有限公司);DZF-6090型真空干燥箱(上海精宏实验设备有限公司);TG16-WS台式高速离心机(湖南湘仪实验室仪器开发有限公司);7890A/7000B气相色谱-质谱联用仪(美国安捷伦公司)。
1.3 试验方法
1.3.1 水酶法提取鹿油
取200 g清洗、沥干水分后的冷冻鹿板油,切碎成小块,按料液比1∶1(g/mL)加入蒸馏水,调节pH,加入一定量的酶,在一定温度下缓慢搅拌一定时间,反应完成后在90~95 ℃下水浴10 min灭酶活,在5 000 r/min条件下离心20 min,吸取上层油,真空干燥,得鹿油。做3组平行试验。
1.3.2 提取率计算

1.3.3 单因素试验
在确定料液比基础上,以鹿油提取率为指标,分别以复合酶配比、酶解温度、提取时间、pH和加酶量为变量进行单因素试验。
1.3.4 正交优化试验
在单因素试验基础上,以鹿油提取率为指标,选择复合酶配比、酶解温度、提取时间、pH和加酶量为考察因素,按L9(34)正交因素水平表进行正交试验。
1.3.5 理化指标
水分测定按GB 5009.3—2016进行测定;酸价按GB 5009.229—2016进行测定;过氧化值按GB 5009.227—2016进行测定。
1.3.6 脂肪酸组成分析
1.3.6.1 甲酯化处理
称取150 mg鹿油,加入8 mL 2% NaOH-甲醇溶液,于80±1 ℃回流,直至油滴消失,冷却至室温,加入7 mL 15% BF3-甲醇溶液,于80±1 ℃回流3 min,取出,迅速冷却至室温。准确加入15 mL正庚烷,涡旋2 min,加饱和NaCl水溶液,静置分层。吸取约5 mL上层正庚烷液至装有3~5 g无水硫酸钠的50 mL离心管中,涡旋1 min,离心,上清液稀释10倍或100倍进样。
1.3.6.2 气质联用仪条件
色谱柱,DB-23 60 m×0.25 mm×0.25 μm;载气,高纯He;载气流量1.0 mL/min;进样口220 ℃;EI源230 ℃。程序升温条件:初始温度60 ℃,保持1 min,10 ℃/min,升温至180 ℃,以3 ℃/min升温至220 ℃,保持2 min。
1.4 统计学分析
用S P S S 统计分析软件进行单因素方差分析(ANOVE),Duncan法进行多因子比较分析。
2 结果与分析
2.1 单因素试验
2.1.1 复合酶配比对鹿油提取率的影响
在料液比1∶1(g/mL),酶解温度50 ℃,加酶量1%,pH 7.0,酶解时间1 h条件下,研究复合酶配比对鹿油提取率的影响,结果见图1。复合酶提取率均高于单一酶提取率,可能是由于复合酶使酶解更加完全。随着酸性蛋白酶添加比例降低、碱性蛋白酶添加比例升高,鹿油提取率升高,中性蛋白酶与碱性蛋白酶1∶3时,鹿油提取率达到最高,为83.6%。进一步升高碱性蛋白酶比例,提取率反而降低,可能是由于过度的碱性蛋白酶的添加阻碍了酶解反应的进行。后续试验以复合酶配比(中性蛋白酶∶碱性蛋白酶)1∶3进行。
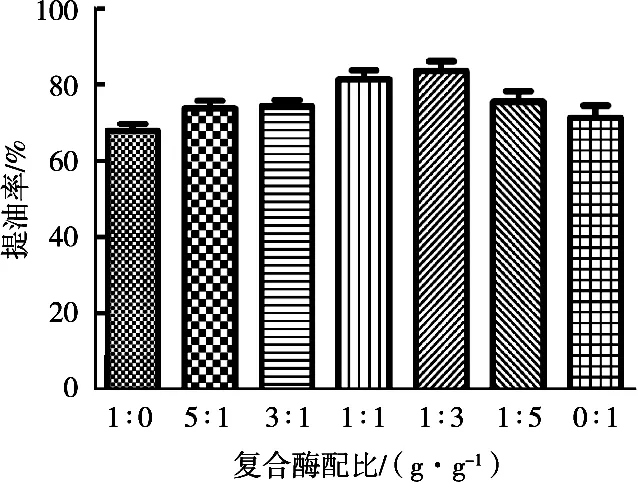
图1 复合酶配比(中性蛋白酶∶碱性蛋白酶)对鹿油提取率的影响
2.1.2 酶解温度对鹿油提取率的影响
在料液比1∶1(g/mL),加酶量1%,pH 7.0,酶解时间1 h,复合酶配比1∶3条件下,酶解温度为35~60 ℃时,研究不同酶解温度对鹿油提取率的影响,结果见图2。温度35~55 ℃时,随着温度升高,提取率逐渐升高;55 ℃时提取率最高,为85.6%;温度超过55℃时,提取率逐渐下降。因此,55 ℃为复合酶解最适温度,温度升高和降低都会抑制复合酶活性,进而影响鹿油提取率[9-10]。后续试验以酶解温度55 ℃进行。
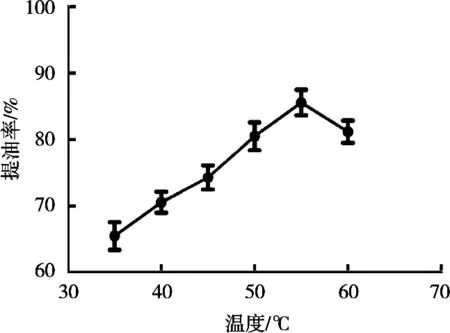
图2 酶解温度对鹿油提取率的影响
2.1.3 酶解时间对鹿油提取率的影响
在料液比1∶1(g/mL),酶解温度55 ℃,加酶量1%,pH 7.0,复合酶配比1∶3,酶解时间0.5~3.5 h条件下,研究不同酶解时间对鹿油提取率的影响,结果见图3。酶解时间0.5~2.5 h时,鹿油提取率随着酶解时间的增加而升高,酶解时间超过2.5 h时,鹿油提取率逐渐趋于平缓。其中,酶解时间1.0~2.5 h时,复合酶反应速率较快,2.5 h后底物反应近乎完全,且产物抑制等作用导致反应速率降低[11-13]。因此最适提取时间为2.5 h,提取率为84.4%。后续试验以酶解时间2.5 h继续进行。
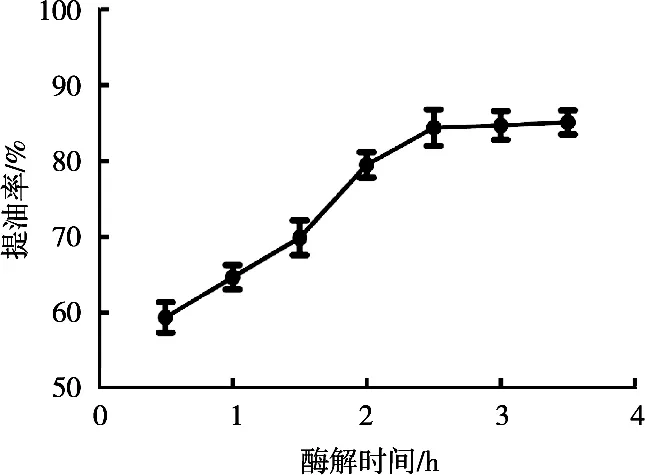
图3 酶解时间对鹿油提取率的影响
2.1.4 加酶量对鹿油提取率的影响
在料液比1∶1(g/mL),酶解温度55 ℃,pH 7.0,酶解时间2.5 h,复合酶配比1∶3,加酶量0.5%~4%条件下,研究不同加酶量对鹿油提取率的影响,结果见图4。加酶量<2.0%时,随着加酶量增加,鹿油提取率逐渐升高,加酶量2%时达到最高,为87.5%。加酶量>2.0%时,鹿油提取率降低,原因可能是复合酶浓度超过一定量时,酶和底物不能充分接触,导致酶促反应效率下降[14],因此后续试验以加酶量2%进行。
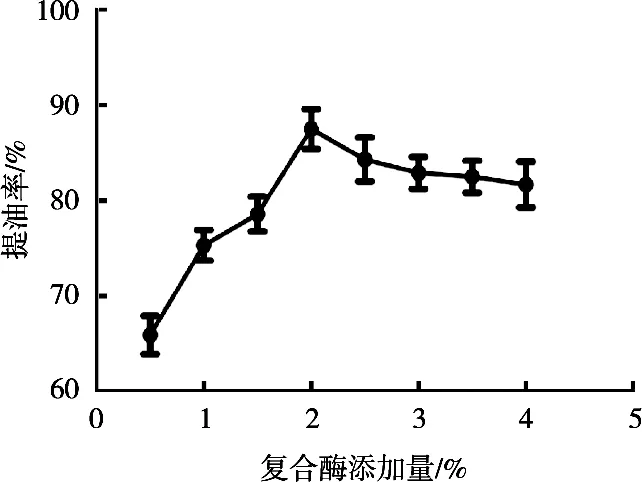
图4 复合酶添加量对鹿油提取率的影响
2.1.5 pH对鹿油提取率的影响
在料液比1∶1(g/mL),酶解温度55 ℃,加酶量2%,酶解时间2.5 h,复合酶比1∶3,pH 4.5~8.0条件下,研究不同pH对鹿油提取率的影响,结果见图5。pH< 7.0时,鹿油提取率随着pH的升高而升高,pH>7时,鹿油提取率随着pH升高而降低;pH 7.0时,鹿油提取率达到最高,为78.8%。这可能与蛋白酶的底物适应性有关[15]。因此,复合酶解最适pH为7.0。
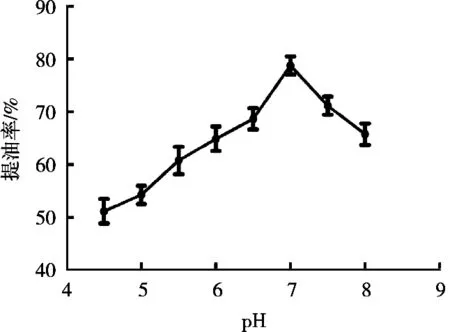
图5 pH对鹿油提取率的影响
2.2 正交试验
在单因素试验的基础上,根据正交试验设计方案,选取复合酶配比、酶解温度、加酶量和酶解时间为自变量,以鹿油提取率为指标,设计L9(34)正交试验。正交试验因素水平见表1,正交试验设计及结果见表2。
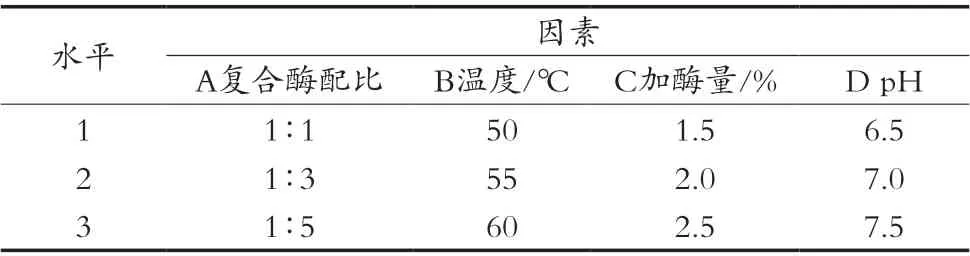
表1 正交因素水平
由表2中极差值R可知,4个影响因素对鹿油提取率影响程度大小依次是B>D>A>C。所得最优方案为B2D2A2C2,即酶解温度55 ℃、pH 7.0、复合酶配比1∶3、加酶量2%。
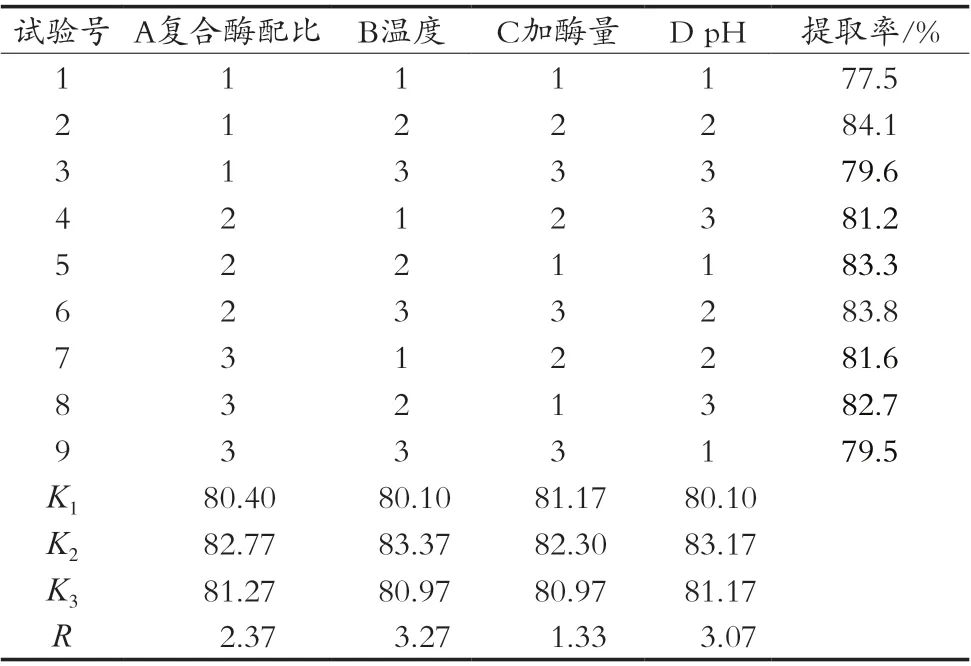
表2 正交试验结果
2.3 验证试验
按照上述最优条件,完成3组平行试验进行验证,所得提取率分别为84.3%,86.1%和85.7%,3组结果无显著差异。由此可知,试验优化的提取工艺具有良好的稳定性和重现性。
2.4 最佳条件下所提鹿油的理化指标
由表3可知:最佳提取条件下所得鹿油含水量为6.25%,水酶法提取油脂中通常含有较多水分,高速离心并不能完全去除油脂中的水分,通常需要通过直接干燥法或减压干燥法去除多余水分;最佳提取条件下所得鹿油的酸价为2.27 mg/g,低于《食品安全国家标准食用动物油脂》所规定的酸价≤2.50;过氧化值为0.26 g/100 g,稍高于过氧化值≤0.20,可能是由于存放时间过长或存放过程中接触到空气、阳光,使所提鹿油过氧化值略有升高[16]。
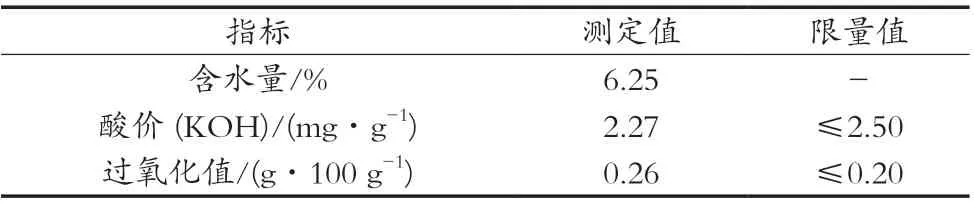
表3 鹿油的理化指标
2.5 鹿油脂肪酸组成分析
采用GC-MS对甲酯化衍生的鹿油脂肪酸组成进行分析,其总离子流色谱图见图6。通过标准品对照和数据库检索对其脂肪酸进行定性,并按峰面积归一化法进行定量,分析结果见表4。
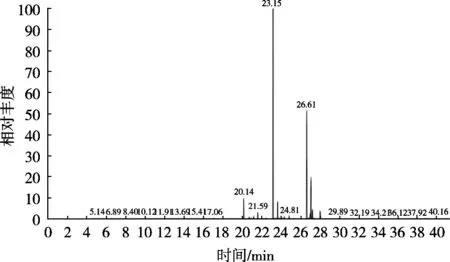
图6 鹿油脂肪酸甲酯气相色谱图
由表4可知,通过外标法在复合酶水酶法提取的鹿油中共检测出20种脂肪酸。其中,含量大于5%的脂肪酸共5种,依次是棕榈酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1n9C)、棕榈油酸(C16∶1n7)、亚油酸(C18∶2n6)。饱和脂肪酸9种,主要包括棕榈酸、硬脂酸、肉豆蔻酸等,占脂肪酸总量的64.60%;单不饱和脂肪酸4种,包括油酸、棕榈油酸等,占脂肪酸总量的28.56%;多不饱和脂肪酸7种,包括亚油酸、亚麻酸等,占脂肪酸总量的6.62%。
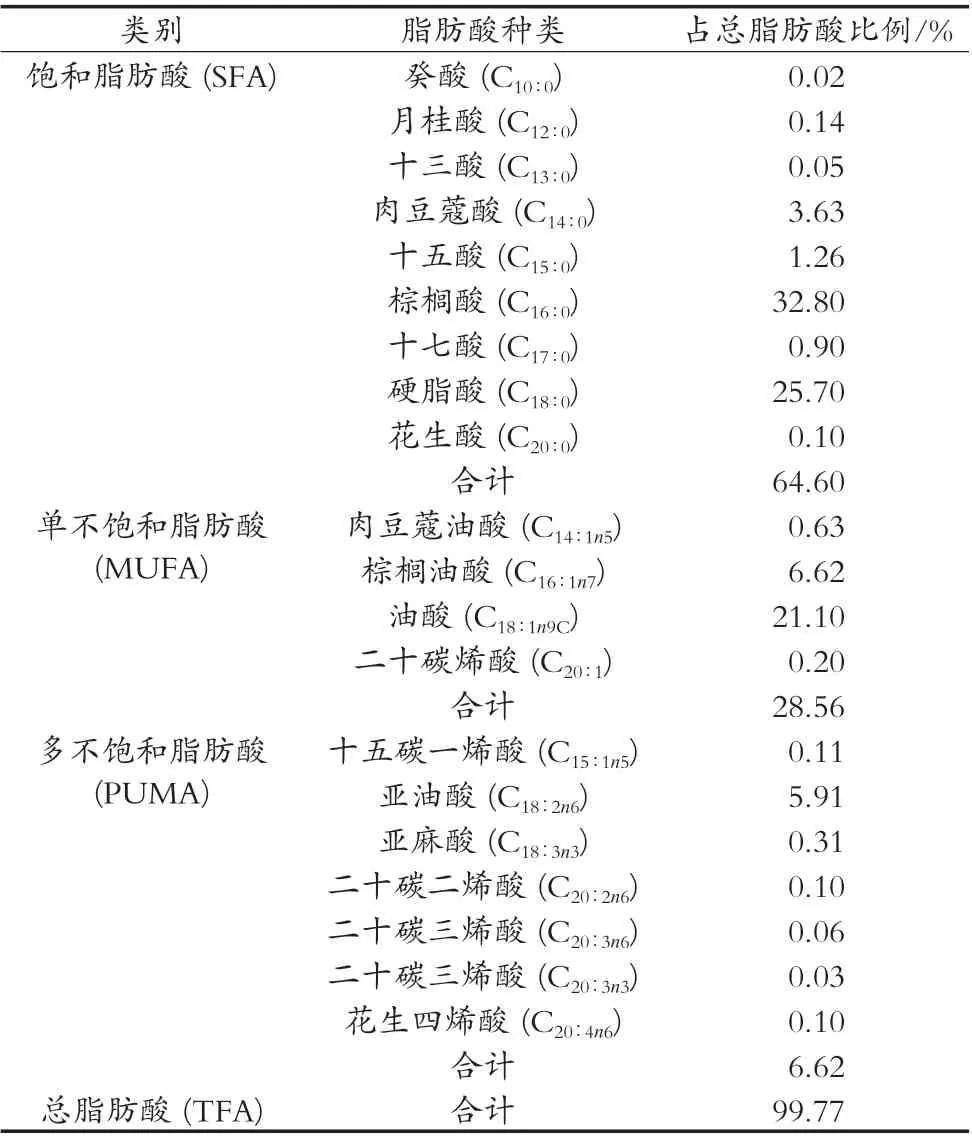
表4 鹿油中脂肪酸组成及含量
棕榈酸又称软脂酸,其钠盐是肥皂的主要成分之一,在工业上通常由动植物油脂皂化制得,且被广泛应用于润滑剂、涂料、油墨和增塑剂中。硬脂酸主要用于生产硬脂酸盐,在食品工业、化妆品工业及橡胶工业均有广泛应用[17]。油酸、棕榈油酸、亚油酸是不饱和脂肪酸,能够降低血液黏稠度、改善血液微循环、保持细胞膜的相对流动性,以保证细胞的正常生理功能,部分不饱和脂肪酸还具有免疫调节和调节血脂等作用,如亚油酸[18-20]。
3 结论
采用正交试验的方法优化复合蛋白酶水酶法提取鹿油的工艺,各因素对鹿油提取率影响的大小依次为B>D>A>C,所得最佳工艺参数:料液比1∶1(g/mL),酶解温度55 ℃、pH 7.0、复合酶配比1∶3、加酶量2%。在此条件下,鹿油提取率为85.37%。采用GC-MS对复合酶水酶法提取的鹿油成分进行分析鉴定,共鉴定出20种化合物,主要含有棕榈酸、硬脂酸、油酸、棕榈油酸、亚油酸等,其中不饱和脂肪酸占64.60%,单不饱和脂肪酸占28.56%,多不饱和脂肪酸占6.62%。水酶法是一种简单、温和且无污染的提取油脂方法,复合酶提取鹿油较单一酶提取更为完全,明显提高鹿油提取率,具有潜在应用前景。

