基于MGB1-TLR4-NF-κB信号通路分析右美托咪定对脓毒症小鼠急性肺损伤的保护作用
吴华兵,肖秀英,詹玮玮,隗莉,胥春梅
脓毒症(sepsis)是由机体对感染的异常反应引起的器官功能障碍综合征,临床表现为体温升高或降低、心悸气短、寒战及精神萎靡。全世界每年感染脓毒症人数超过3 000万,且发病率和病死率仍在上升,是世界范围内危重症患者死亡的主要原因之一[1]。严重创伤、烧伤、腹膜炎等原因引起的感染均有可能导致脓毒症的发生,临床住院患者中脓毒症的发病率可达1%~2%[2]。右美托咪定(dexmedetomidine,Dex)是高选择性的α2肾上腺素受体激动剂,具有镇静、镇痛、抗焦虑、抗交感神经和减少阿片类药物不良反应的作用[3],最新研究证实,Dex治疗脓毒症的效果良好,可显著抑制患者的炎性反应,降低病死率,增强免疫系统活性[4]。本实验探究Dex对脓毒症小鼠急性肺损伤的保护作用,并进一步了解其潜在调控机制,报道如下。
1 材料与方法
1.1 实验材料 (1)实验动物:雄性BALB/c小鼠36只,购自武汉大学动物实验中心(合格证号:2016SY03245),4~8周龄,体质量18~22 g,饲养于无特殊病原体的饲养箱内,保持饲养箱内环境安静,给予充足的光照和水源,维持室温及50%空气湿度,实验小鼠均经动物保护学科委员会同意。(2)试剂、药物:右美托咪定(上海源叶生物科技有限公司),脂多糖(lipopolysaccharides,LPS,美国Sigma公司),髓过氧化物酶(MPO)、白介素-6 (IL-6)、IL-1β、肿瘤坏死因子(TNF-α)酶联免疫吸附试剂盒(武汉伊莱瑞特生物科技股份有限公司),BCA试剂盒(上海齐源生物科技有限公司),MGB1、TLR4、NF-κB、β-actin一抗[中国艾博抗(上海)贸易有限公司] 。(3)仪器设备:电子天平(型号 H0503,邢台智冠机械科技有限公司),高温烤箱(型号 JY-KX-150,东莞市精域环境测试设备有限公司),组织匀浆机(型号 JJ-2,常州金坛良友仪器有限公司),离心机(型号 TG18KR,上海舜制仪器制造有限公司)。
1.2 实验方法 2017年8—12月于三峡大学第三临床医学院动物实验中心进行实验。小鼠适应性喂养3 d后,按照完全随机法分为空白对照组、模型组及右美托咪定(Dex)组,每组12只。模型组和Dex组小鼠按照LPS 20 mg/kg腹腔注射,以构建脓毒症小鼠模型,当小鼠出现寒战发抖、抱团取暖、呼吸频率加快、口唇发紫发青、抓取时反抗无力时视为造模成功,空白对照组小鼠腹腔注射等量生理盐水。造模成功后Dex组小鼠腹腔注射Dex 40 μg/kg,24 h后断头处死各组小鼠,沿胸线逐层分开组织,打开腹腔及胸膜,取出肺组织于-80℃的液氮中保存待用。
1.3 观测指标与方法
1.3.1 肺组织病理切片染色:将各组小鼠肺组织切片脱蜡后,乙醇脱水处理,加入蒸馏水后用苏木精水溶液进行染色,持续数分钟,再用氨水进行分色处理,冲洗1 h加入蒸馏水,乙醇再次脱水10 min,伊红溶液进行染色,持续2~3 min,乙醇脱水后透明封片,观察各组小鼠肺组织标本染色情况;并根据肺泡浸润、出血、间隔水肿及纤维蛋白沉积程度进行肺损伤评分[5]:肺泡浸润、出血、间隔水肿及纤维蛋白沉积程度每项计0~3分,无为0分,轻微为1分,中度为2分,重度为3分,总分为各项得分累加,总分越高,肺损伤程度越重。
1.3.2 肺组织湿干重比(W/D)检测:将小鼠肺组织擦干后用电子天平称重,得到肺组织湿重(wet weight,W),再将肺组织置于高温烤箱中烘烤至干透后再次称重,得到肺组织干重(dry weight,D),计算W/D。
1.3.3 肺组织炎性因子检测:小鼠肺组织称重后,加入裂解液进行裂解,4℃下离心取上清液。采用酶联免疫吸附试剂盒检测IL-6、IL-1β和TNF-α、MPO,严格按试剂盒要求操作。
1.3.4 肺组织MGB1-TLR4-NF-κB信号通路蛋白检测:采用Western-blot法检测。小鼠肺组织经匀浆机处理后离心,弃上清液,加入含有1%苯甲基磺酰氟(PMSF)的裂解液(RIPA)1 000 μl,冰上裂解30 min,4℃下离心收集总蛋白,根据BCA试剂盒说明书测量各组乳腺球蛋白(mammaglobin,MGB1)-Toll样受体4(toll-like receptor 4,TLR4)-核因子κB(nuclear factor kappa-B,NF-κB)信号通路的蛋白表达。取各组蛋白30 mg共20 μl进行聚丙烯酰胺凝胶电泳后电转至聚偏二氟乙烯膜(PVDF)上,脱脂奶粉封膜1 h后,再与MGB1、TLR4、NF-κB、β-actin一抗在4℃下孵育过夜(抗体浓度为1∶1 000)。用磷酸盐缓冲液洗膜多次,加入稀释比为1∶2 000的羊抗兔二抗共同孵育1 h,洗膜3次后曝光成像,Image J软件分析各组MGB1-TLR4-NF-κB蛋白的灰度值。
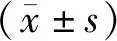
2 结 果
2.1 各组小鼠肺组织病理形态变化 空白对照组小鼠肺组织染色均匀且清晰可见,结构完整,排列紧密且有序,无明显炎性反应浸润;模型组肺组织染色较深,边缘模糊,形态结构不完整,排列杂乱,毛细血管内皮细胞受损出血,肺泡空腔内观察到大量炎性反应浸润;Dex组肺组织较为清晰,结构相对完整,排列较为整齐,较模型组炎性反应程度显著减轻,且无弥漫性出血,见图1。

图1 各组小鼠肺组织病理形态变化比较(HE染色,×200)
2.2 各组小鼠肺损伤指标比较 与空白对照组比较,模型组小鼠W/D比值、肺损伤评分显著升高(t=14.587、15.013,P均<0.01);与模型组比较,Dex组小鼠W/D比值、肺损伤评分均显著降低(t=12.405、7.696,P均<0.01),见表1。
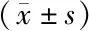
表1 各组小鼠肺损伤相关指标比较
2.3 各组小鼠肺组织内炎性因子水平比较 与空白对照组比较,模型组IL-6、IL-1β、TNF-α和MPO水平显著升高(t=98.601、18.049、33.506、5.929,P均<0.01);与模型组比较,Dex组L-6、IL-1β、TNF-α和MPO水平显著降低(t=50.881、9.054、9.490、4.515,P均<0.01),见表2。
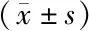
表2 各组小鼠肺组织内炎性因子水平比较
2.4 各组小鼠肺组织内MGB1-TLR4-NF-κB通路蛋白表达比较 与空白对照组比较,模型组MGB1-TLR4-NF-κB通路的蛋白表达显著上调(t=24.779、22.033、22.642,P均<0.01);与模型组比较,Dex组上述分子的蛋白表达均显著下调(t=21.394、18.644、17.781,P均<0.01),见图2、图3。
3 讨 论
近些年来,脓毒症已经成为全球性的公共卫生问题,也是现阶段临床感染致死的主要原因之一,病死率高达40%[6]。脓毒症是由细菌、真菌及病毒引起的,其发病机制极其复杂,包括机体炎性反应失衡、凝血及免疫障碍、线粒体功能受损及自噬等病理生理过程,最终引发全身性循环及器官功能障碍,甚至可进一步进展为脓毒性休克,对患者生命安全造成极大威胁[7]。肺部是人体重要免疫器官,通过先天免疫细胞和适应性免疫细胞诱导免疫反应。肺部是多种空气传播病原体、气溶胶及炎性反应过敏原的主要靶器官,可致肺炎、急性呼吸窘迫综合征、急性肺损伤(ALI),脓毒症患者几乎都伴有ALI[8-9],减轻ALI已成为治疗脓毒症的关键步骤。目前针对脓毒症缺乏专门的治疗方案,主要通过加强疾病源头控制、抗生素及器官功能支持来避免感染[10]。脓毒症患者机体内的炎性因子大量释放,肺内组织液生成及回流失调,从毛细血管内外渗,积聚于肺泡及肺间质内,引起肺组织水肿,同时血氧饱和度迅速下降,引起呼吸衰竭及心脏骤停等严重后果[11-12]。因此,抑制炎性反应,减轻急性肺损伤对于脓毒症患者的临床治疗十分关键。
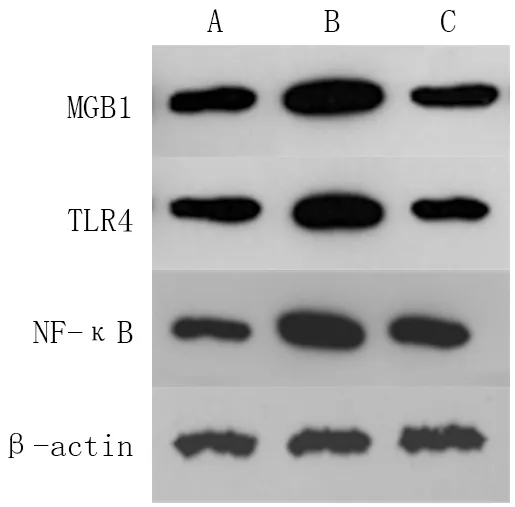
注:A.空白对照组;B.模型组;C.Dex组

注:与空白对照组比较,aP<0.01;与模型组比较,bP<0.01
右美托咪定常用于儿科镇静,临床效果较好,且安全性较高,对于外周血管收缩及交感神经溶解也有较好的促进作用[13]。证据表明,Dex等α2肾上腺素受体激动剂可抑制脓毒症等需要体外循环支持患者的炎性反应及交感神经过度兴奋,从而保护心血管、肺脏、肾脏及大脑等重要器官[14],减轻脓毒症患者急性肺损伤。本结果发现,Dex可显著抑制脓毒症模型小鼠肺组织内的炎性因子水平,减轻炎性反应,改善肺损伤。Dex对模型小鼠炎性反应的抑制和对肺损伤的保护作用原因可能在于Dex优异的抗炎生物活性及器官保护作用。IL-6、IL-1β、TNF-α和MPO是经典的炎性因子标志物,Dex通过抑制IL-6、TNF-α和MPO等炎性介质的过度表达,抑制炎性反应的激活,阻断炎性级联放大效应,避免因脓毒症导致的器官损伤,发挥保护肺功能的作用[15-17]。Meng等[18]研究发现,Dex可显著抑制脂多糖诱导的全身性炎性反应,降低肺损伤评分和肺组织湿干重比,减轻脓毒症大鼠的急性肺损伤,这也与本结果相符。
MGB1作为乳腺和肿瘤特异性标志物,参与介导乳腺癌、子宫内膜癌等恶性肿瘤的发生发展,同样也是炎性级联反应中的重要蛋白质,在脓毒症等炎性反应中高表达[19]。TLR4-NF-κB则是经典的炎性反应通路,可调节IL-1β、TNF-α和MPO等多种炎性因子的水平,参与调控炎性反应,进而导致脓毒症等炎性反应性疾病的发生[20]。本研究发现,Dex可抑制MGB1-TLR4-NF-κB信号通路的激活,抑制脓毒症小鼠的炎性反应,下调IL-6、IL-1β、TNF-α和MPO等炎性介质的表达水平。
综上所述,Dex通过抑制MGB1-TLR4-NF-κB信号通路的激活,减轻脓毒症小鼠肺组织炎性细胞浸润等炎性反应,对脓毒症小鼠急性肺损伤起到良好的保护效果,提示MGB1-TLR4-NF-κB通路可能与脓毒症急性肺损伤有关,为Dex临床治疗脓毒症急性肺损伤的可行性提供了更多数据支撑。
利益冲突:所有作者声明无利益冲突
作者贡献声明
吴华兵:设计研究方案,实施研究过程,论文撰写;肖秀英、詹玮玮:提出研究思路,分析试验数据,论文审核;隗莉、胥春梅:实施研究过程,资料搜集整理,论文修改

