榅桲总黄酮对氧糖剥夺诱导的人脑微血管内皮细胞损伤的影响及机制研究
刘禹岐,郗欧,刘怡彤
·论著·
榅桲总黄酮对氧糖剥夺诱导的人脑微血管内皮细胞损伤的影响及机制研究
刘禹岐,郗欧,刘怡彤
110000 沈阳,辽宁中医药大学附属第二医院脑病一科(刘禹岐、郗欧),康复科(刘怡彤)
探究榅桲总黄酮(TFCOM)对氧糖剥夺(OGD)诱导的人脑微血管内皮细胞(HBMEC)损伤的影响及可能机制。体外培养 HBMEC,建立 OGD 模型。用 10、20、40 μg/ml TFCOM 干预 OGD 诱导的 HBMEC,CCK8 法检测细胞增殖活性,流式细胞术检测细胞凋亡,蛋白质印迹法检测细胞中 cleaved-caspase3 蛋白表达,酶联免疫吸附实验检测细胞中 SOD 活性和 MDA 含量,RT-PCR 检测 circ_HECTD1 表达。分别转染 circ_HECTD1 小干扰 RNA 或过表达载体至 HBMEC,上述相同方法观察 circ_HECTD1 对 OGD 诱导的 HBMEC 增殖活性、凋亡及细胞中 cleaved-caspase3 蛋白表达、SOD 活性和 MDA 含量的影响。TFCOM 增强了 OGD 诱导的 HBMEC 增殖活性和细胞中 SOD 活性,降低了 OGD 诱导的 HBMEC 凋亡率、细胞中 cleaved-caspase3 蛋白和 circ_HECTD1 表达及 MDA 含量,且呈剂量依赖性。沉默 circ_HECTD1 增强了 OGD 诱导的 HBMEC 增殖活性和细胞中 SOD 活性,降低了 OGD 诱导的 HBMEC 凋亡率、细胞中 cleaved-caspase3 蛋白和 MDA 含量。过表达circ_HECTD1 减弱了 TFCOM 对 OGD 诱导的 HBMEC 增殖活性、凋亡及细胞中 SOD 活性和 MDA 含量的影响。TFCOM 可减少 OGD 诱导的 HBMEC 凋亡,并抑制 HBMEC 氧化应激,其作用机制可能与下调细胞中 circ_HECTD1 表达有关。
榅桲总黄酮; circ_HECTD1; 氧糖剥夺; 人脑微血管内皮细胞; 凋亡; 氧化应激
缺血性脑卒中是由脑动脉血栓或栓塞性闭塞引起的,具有较高的发病率和致死率[1]。人脑微血管内皮细胞(HBMEC)是血脑屏障的重要结构,其在脑缺血或缺氧时结构和功能被破坏,从而引起脑细胞及脑组织损伤,造成脑功能紊乱[2]。研究显示,缺血或缺氧引起的 HBMEC 损伤在缺血性脑卒中发生发展中起重要作用,抑制缺血或缺氧引起的 HBMEC 对缺血性脑卒中的治疗尤为关键[3]。榅桲是蔷薇科榅桲属灌木植物,富含有机酸、黄酮和鞣质等化学成分。研究显示,榅桲总黄酮(total flavonoids of.,TFCOM)可通过阻碍 JNK 和 NF-κB 信号通路来下调心肌梗死引起的炎性损伤和细胞凋亡,减轻心肌梗死大鼠心肌损伤[4];榅桲总黄酮可改善自发性高血压大鼠心脏功能,抑制心肌肥厚,并减轻心肌纤维化[5]。然而,榅桲总黄酮对 HBMEC 损伤的影响和机制还未见相关报道。circ_HECTD1 是一种环状RNA(circRNA),其在缺血性脑组织中表达增加,敲低 circ_HECTD1 可显著减少短暂性脑中动脉闭塞小鼠脑梗死面积,减轻神经元缺陷并改善星形胶质细胞活化,circ_HECTD1 可作为脑卒中的治疗靶标[6]。本研究建立氧糖剥夺(OGD)诱导的人脑微血管内皮细胞损伤模型,主要观察了榅桲总黄酮对 OGD 诱导的 HBMEC 凋亡和氧化应激的影响及其能否通过调控 circ_HECTD1 发挥作用,以期为其用于缺血性脑卒中的治疗提供一定的实验依据。
1 材料与方法
1.1 材料
HBMEC 购自江苏依莱萨生物技术有限公司;榅桲叶购自张仲景大药房,按照文献[4]方法制备榅桲总黄酮,采用分光光度计法测定榅桲总黄酮纯度为 64.29%;DMEM 培养液、Annexin V-FITC/PI 试剂盒和 BCA 蛋白检测试剂盒购自北京索莱宝科技有限公司;LipofectamineTM2000 试剂盒购自美国 Invitrogen 公司;胎牛血清(FBS)购自浙江天杭生物科技股份有限公司;si-circ_HECTD1、si-NC、pcDNA-circ_HECTD1 和 PCR 引物购自生工生物工程(上海)股份有限公司;丙二醛(MDA)和超氧化物歧化酶(SOD)检测试剂盒购自南京建成生物工程研究所;RNA 抽提试剂盒、逆转录试剂盒和 PCR 试剂盒购自宝生物工程(大连)有限公司;兔抗人活化的半胱天冬酶 3(cleaved-caspase3)抗体购自 Abcam 中国公司。
1.2 方法
1.2.1 细胞培养和转染 复苏 HBMEC,加含 10% FBS 的 DMEM 培养液,置于CO2培养箱(37 ℃、CO2体积分数 5%、湿度 97%)中培养。取对数期 HBMEC 接种至 6 孔板中(5.0 × 105个/孔),培养 12 h 后,弃培养液。用 LipofectamineTM2000 脂质体法,分别将 si-circ_HECTD1、si-NC、pcDNA-circ_HECTD1 转染至 HBMEC 细胞。转染 12 h 后,换为含 10% FBS 的 DMEM 培养液。再培养 24 h 后,RT-qPCR 法检测细胞中 circ_HECTD1 表达验证转染效果,并收集细胞用于后续实验。
1.2.2 CCK8 法检测细胞增殖活性 将 HBMEC 及转染 si-circ_HECTD1、si-NC、pcDNA-circ_ HECTD1 的 HBMEC 接种于 96 孔板中(2.5 × 104个/孔),培养 4 h 后,弃培养液,分组处理。HBMEC 分为对照组、模型组、模型+ TFCOM 低剂量组(模型+ TFCOM-L 组)、模型+ TFCOM 中剂量组(模型+ TFCOM-M 组)和模型+ TFCOM 高剂量组(模型+ TFCOM-H 组),其中模型组建立氧糖剥夺模型[7],先加含 10% FBS 的 DMEM 培养液,置于CO2培养箱中培养 24 h,弃培养液,PBS 清洗 2 次,再加无糖 DMEM 培养液,置于缺氧培养箱(37 ℃、CO2体积分数 5%、N2体积分数 95%、湿度 97%)中培养 6 h;模型+ TFCOM-L 组、模型+ TFCOM-M 组和模型+ TFCOM-H 组细胞先分别加含 10、20、40 μg/ml[8]榅桲总黄酮与 10% FBS 的 DMEM 培养液,置于CO2培养箱中培养 24 h,弃培养液,PBS 清洗2 次,再加无糖 DMEM 培养液,置于缺氧培养箱中培养 6 h;对照组细胞用含 10% FBS 的 DMEM 培养液,置于 CO2培养箱中培养 30 h。转染si-circ_HECTD1、si-NC 的 HBMEC 处理同模型组,记为模型+ si-circ_HECTD1 组、模型+ si-NC 组。转染pcDNA-circ_HECTD1 的 HBMEC 处理同模型+TFCOM-H 组,记为模型+ TFCOM + pcDNA-circ_HECTD1 组。每组设 3 个复孔。培养结束后,每孔加 10 μl CCK8,孵育 2 h,酶标仪(λ = 450 nm)测光密度()值。值越大,说明细胞增殖活性越强。
1.2.3 流式细胞术检测细胞凋亡 将 HBMEC 及转染 si-circ_HECTD1、si-NC、pcDNA-circ_HECTD1 的 HBMEC 接种于 6 孔板中(1.0 × 105个/孔),培养 4 h后,弃培养液,用 PBS 清洗 2 次,分组处理,方法同 1.2.2。培养结束后,收集各组细胞,用PBS清洗 2 次,利用 Annexin V-FITC/PI 试剂盒,上流式细胞仪检测细胞凋亡。凋亡率(%)=(早期凋亡细胞数+ 晚期凋亡细胞数)/总细胞数 × 100%。
1.2.4 蛋白质印迹法检测细胞中 cleaved-caspase3蛋白表达 细胞接种和分组情况同1.2.3。培养结束后,收集各组细胞,PBS 清洗 2 次。用 RIPA 试剂提取细胞中总蛋白,并使用 BCA 法测定蛋白浓度。行 10% SDS-PAGE 电泳,然后将分离蛋白转至 PVDF 膜,用 5% 脱脂奶粉室温封闭 2 h 后,分别用 cleaved-caspase3(1:1000)和 GAPDH(1:1500)一抗 4℃孵育过夜。洗膜后,再用山羊抗兔二抗(1:3000)室温孵育 1 h。加显影液避光显影,曝光拍照,Image J 软件分析 cleaved-caspase3 相对 GAPDH 的表达量。
1.2.5 酶联免疫吸附法检测细胞中 SOD 活性和 MDA 含量 细胞接种和分组情况同 1.2.3。培养结束后,收集各组细胞,PBS 清洗 2 次。加细胞裂解液充分裂解细胞,3500 r/min 离心 5 min,取上清,利用 SOD、MDA 试剂盒,检测上清中 SOD 活性及 MDA 含量。
1.2.6 RT-PCR 检测细胞中 circ_HECTD1 表达 细胞接种和分组情况同 1.2.3。培养结束后,收集各组细胞,PBS 清洗 2 次。同 RNA 抽提试剂盒提取细胞中总 RNA,经逆转录生成 cDNA 后,行 PCR 扩增。扩增程序:95 ℃ 5 min;95 ℃10 s,60℃ 30 s,72℃ 30 s,共 35 个循环。引物序列:circ_HECTD1 上游 5' ACTCCGTCACCTCGAT TAGC 3',下游 5' ATCATCCCATGTTCTCCGGC 3';GAPDH 上游 5' AATCCCATCACCATCTTCC 3',下游 5' CATCACGCCACAGTTTCC 3'。2-△△Ct法计算 circ_HECTD1 相对于 GAPDH 的表达量。
1.3 统计学处理
2 结果
2.1 榅桲总黄酮对 OGD 诱导的 HBMEC 凋亡的影响
与对照组比较,模型组 HBMEC 增殖活性降低,凋亡率升高,凋亡相关蛋白cleaved-caspase3 的表达升高,差异均具有统计学意义(< 0.05)。与模型组比较,各给药组 HBMEC 增殖活性升高,凋亡率降低,凋亡相关蛋白 cleaved-caspase3 的表达降低,差异均具有统计学意义(< 0.05),且各检测指标组间两两比较,差异均具有统计学意义(< 0.05)(图 1)。
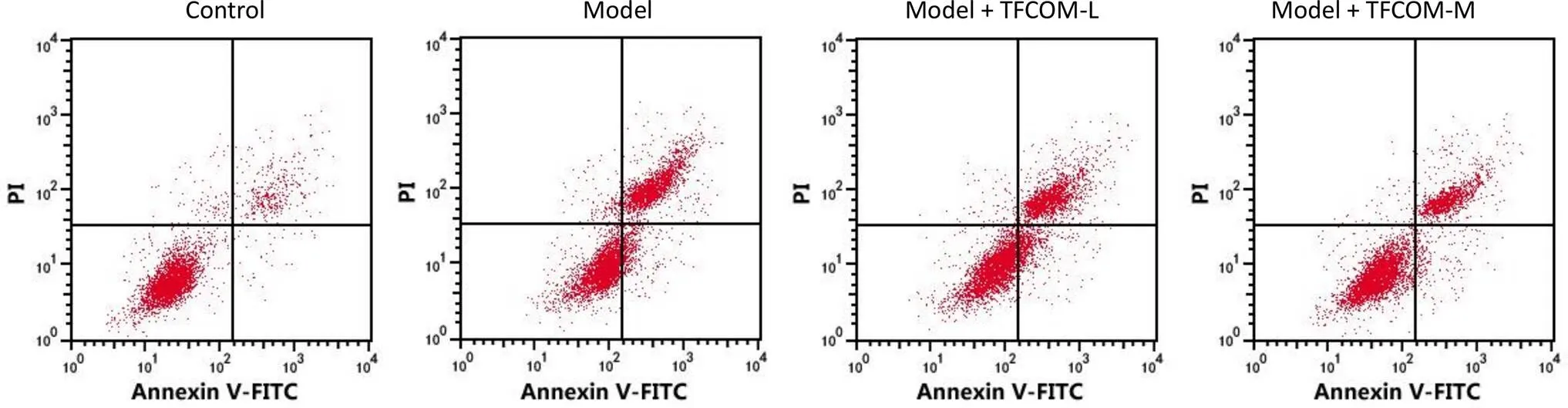
Figure 1 Effects of TFCOM on proliferation and apoptosis of HBMEC cells induced by OGD (A: Effect of cell apoptosis; B: Effect of cells activity; C: Effect of cleaved-caspase3 protein; Compared with the control group,*<0.05; Compared with the model group,#< 0.05; Compared with the model + TFCOM-L group,△< 0.05; Compared with the model + TFCOM-M group,▲< 0.05)
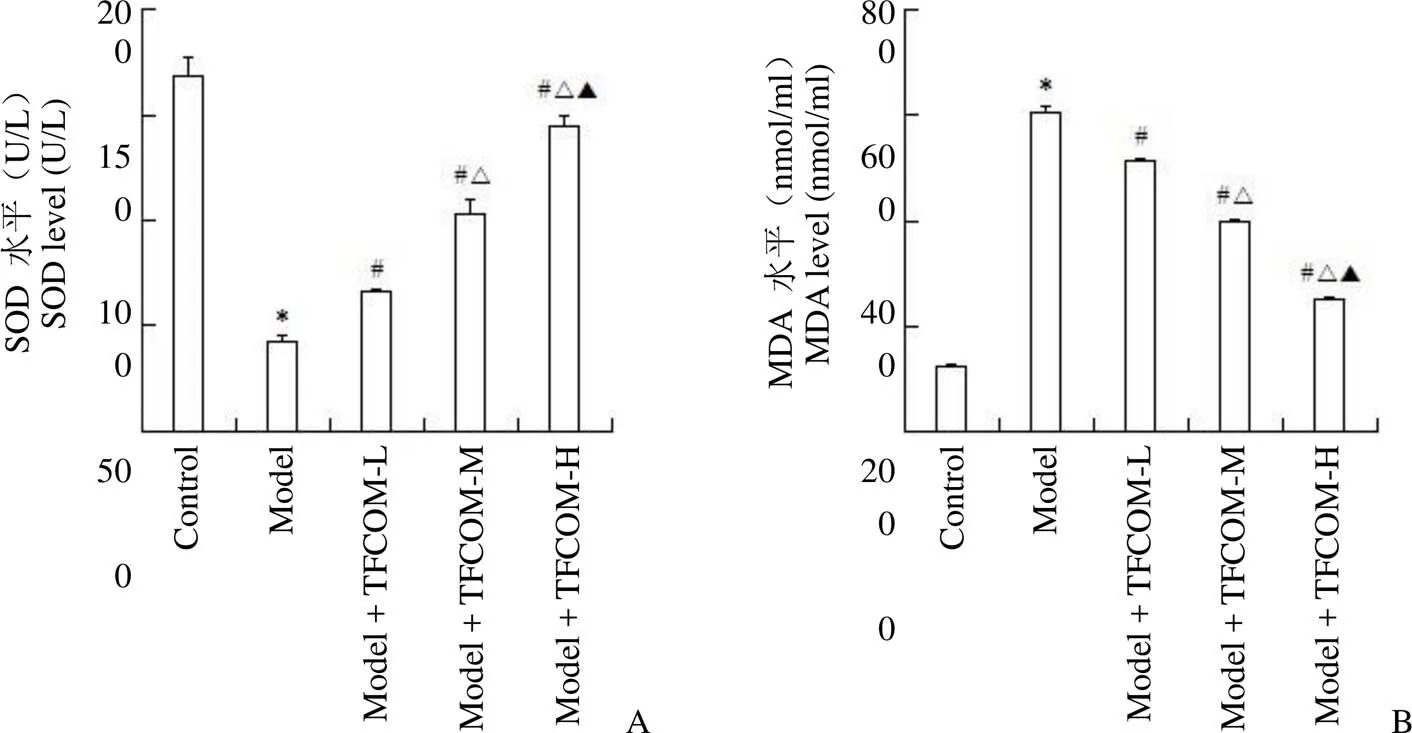
图 2 TFCOM 对OGD 诱导的HBMEC 氧化应激的影响(A:SOD 活性;B:MDA 含量;与 control 组相比,*P < 0.05;与 model 组相比,#P < 0.05;与model + TFCOM-L 组相比,△P < 0.05;与model + TFCOM-M 组相比,▲P < 0.05)
Figure 2 Effects of TFCOM on oxidative stress of HBMEC induced by OGD (A: SOD activity; B: MDA content; Compared with the control group,*< 0.05; Compared with the model group,#< 0.05; Compared with the model + TFCOM-L group,△< 0.05; Compared with the model + TFCOM-M group,▲< 0.05)
2.2 榅桲总黄酮对 OGD 诱导的 HBMEC 中氧化应激的影响
与对照组比较,模型组 SOD 活性降低,MDA 含量升高,差异均具有统计学意义(< 0.05)。与模型组比较,各给药组 SOD 活性升高,MDA 含量降低,差异均具有统计学意义(< 0.05),且各检测指标组间两两比较,差异均具有统计学意义(< 0.05)(图 2)。
2.3 榅桲总黄酮对 OGD 诱导的 HBMEC 中 circ_HECTD1 表达的影响
与对照组比较,模型组 circ_HECTD1 表达升高,差异均具有统计学意义(< 0.05)。与模型组比较,各给药组circ_HECTD1 表达降低,差异均具有统计学意义(< 0.05),且组间两两比较,差异均具有统计学意义(< 0.05)(图 3)。
2.4 沉默 circ_HECTD1 对 OGD 诱导的 HBMEC 凋亡和氧化应激的影响
转染 si-circ_HECTD1 的 HBMEC 中 circ_HECTD1 表达明显低于转染 si-NC 的 HBMEC(0.21 ± 0.02 比 1.00 ± 0.00,= 68.416,< 0.05),表明沉默 circ_HECTD1 的 HBMEC 构建成功。与模型组或模型+ si-NC 组比较,模型+ si-circ_HECTD1 组 HBMEC 增殖活性升高,凋亡率降低,cleaved-caspase3 蛋白表达降低,SOD 活性升高,MDA 含量降低,差异均具有统计学意义(< 0.05)。模型组与模型+ si-NC 组各检测指标比较差异均无统计学意义(> 0.05)(图 4)。
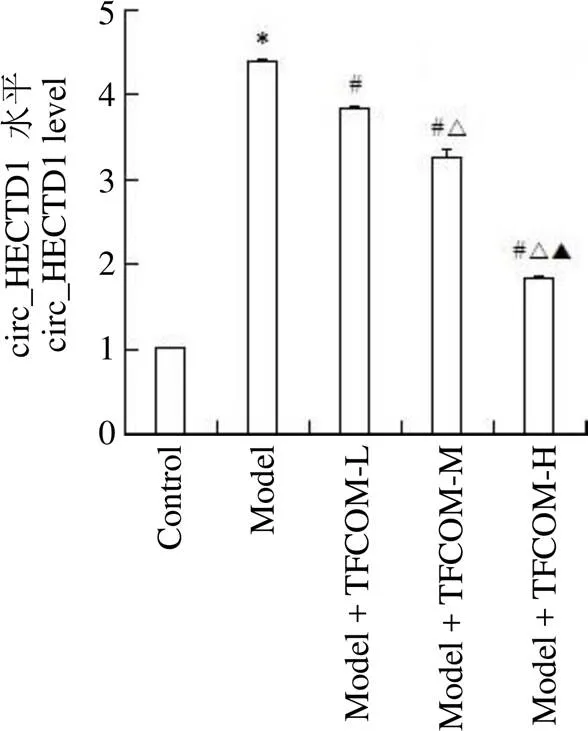
图3 TFCOM 对OGD 诱导的HBMEC 中circ_HECTD1 表达的影响(与control 组相比,*P < 0.05;与model 组相比,#P < 0.05;与model + TFCOM-L 组相比,△P < 0.05;与model + TFCOM-M 组相比,▲P < 0.05)
Figure 3 Effects of TFCOM on the expression of circ_HECTD1 in HBMEC induced by OGD (Compared with the control group,*< 0.05; Compared with the model group,#< 0.05; Compared with the model + TFCOM-L group,△< 0.05; Compared with the model + TFCOM-M group,▲< 0.05)
2.5 过表达 circ_HECTD1 减弱榅桲总黄酮对 OGD 诱导的 HBMEC 凋亡的影响
转染 pcDNA-circ_HECTD1 的HBMEC 中circ_HECTD1 表达明显高于对照组 HBMEC(4.32 ± 0.09 比 1.00 ± 0.00,= 63.893,< 0.05),表明过表达 circ_HECTD1 的 HBMEC 构建成功。与模型+ TFCOM 组比较,模型+ TFCOM + pcDNA-circ_HECTD1 组 HBMEC 增殖活性降低,凋亡率升高,cleaved-caspase3 蛋白表达升高,差异均具有统计学意义(< 0.05)(图 5)。
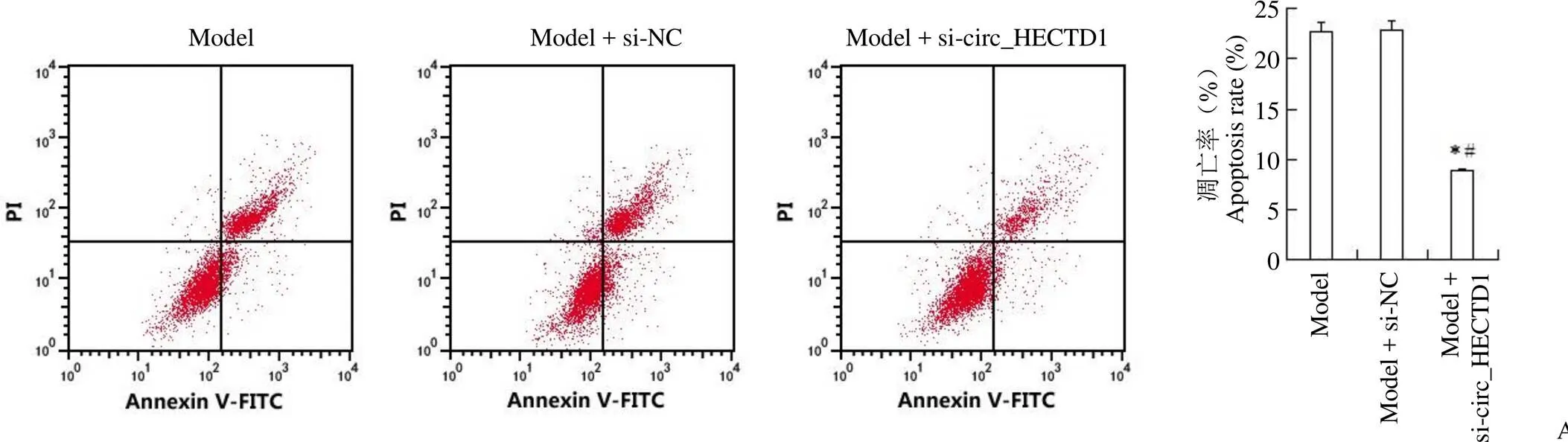
Figure 4 Effects of silencing circ_HECTD1 on the proliferation, apoptosis and oxidative stress of HBMEC induced by OGD (A: Effect of cells apoptosis; B: Effect of cells activity; C: Effect of cleaved-caspase3 protein; D: Effect of SOD activity; E: Effect of MDA content; Compared with model group,*< 0.05; Compared with model + si-NC group,#< 0.05)
2.6 过表达 circ_HECTD1 减弱榅桲总黄酮对 OGD 诱导的 HBMEC 氧化应激的影响
与模型+ TFCOM 组比较,模型+ TFCOM + pcDNA-circ_HECTD1 组 SOD 活性降低,MDA 含量升高,差异均具有统计学意义(< 0.05)(图 6)。
3 讨论
脑卒中是造成人类死亡的第三大疾病,严重威胁患者生命健康[9]。HBMEC 是内覆于血管腔表面且具有合成、分泌和代谢等多种功能的连续单层扁平细胞,参与血液和脑组织间物质交换,在维持大脑动态平衡中发挥重要作用。近年来研究表明,HBMEC 损伤是脑卒中发生发展的始动环节和关键,通过抑制 HBMEC 损伤可延缓脑卒中的发展进程,起到治疗脑卒中的作用[10]。
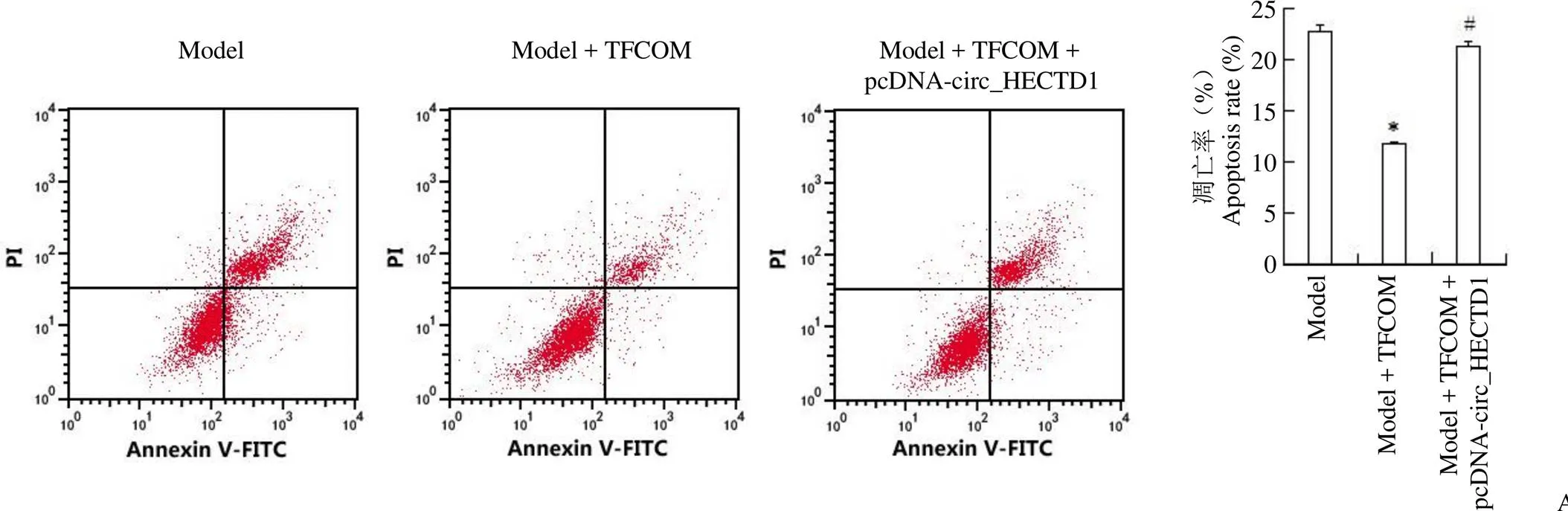
Figure 5 Overexpression of circ_HECTD1 attenuates the effect of TFCOM on the proliferation activity and apoptosis of HBMEC induced by OGD (A: Effect of cells apoptosis; B: Effect of proliferation activity; C: Effect of cleaved-caspase3 protein expression; Compared with model group,*< 0.05; Compared with model + TFCOM group,#< 0.05)
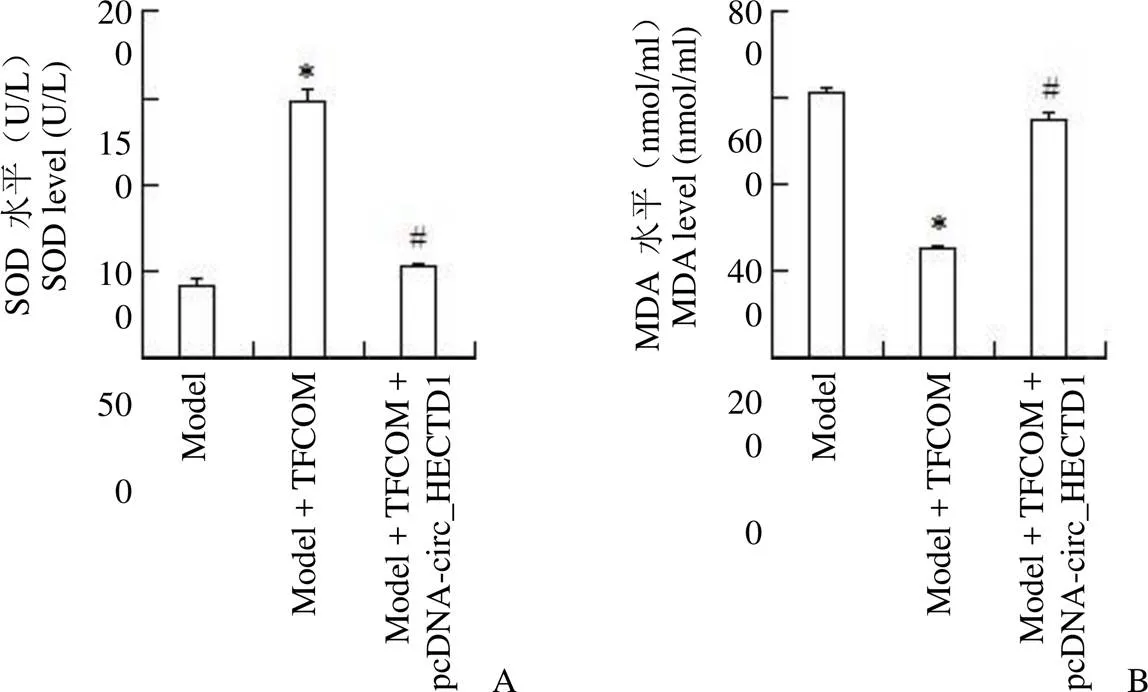
图6 过表达circ_HECTD1 减弱TFCOM 对OGD 诱导的HBMEC 氧化应激的影响(A:对 SOD 活性的影响;B:对 MDA 含量的影响;与model 组相比,*P < 0.05;与model + TFCOM 组相比,#P < 0.05)
Figure 6 Overexpression of circ_HECTD1 attenuates the effect of TFCOM on OGD-induced HBMEC oxidative stress (A: Effect of SOD activity; B: Effect of MDA content; Compared with model group,*< 0.05; Compared with model + TFCOM group,#< 0.05)
天然中草药或其活性成分因毒副作用小,作用靶点多,效果显著等优点在疾病的治疗中表现出较好的优势,是目前研究的热点对象。榅桲总黄酮是榅桲的主要活性成分之一,具有抗炎、抗氧化等功效[11]。有报道称,榅桲总黄酮可减少 H2O2诱导的人脐静脉内皮细胞凋亡,减轻 H2O2引起的人脐静脉内皮细胞损伤作用[8]。本研究结果显示,氧糖剥夺可降低 HBMEC 的增殖活性,并促进其凋亡,而榅桲总黄酮可有效促进氧糖剥夺诱导的 HBMEC增殖,减少细胞凋亡,且呈剂量依赖性。细胞凋亡受多种基因分子和信号通路的调控,其中 caspase 级联反应在细胞凋亡过程中发挥关键作用。caspase3 是 caspase 级联反应的核心分子,其在接收上游凋亡信号后活化,生成 cleaved-caspase3,进一步裂解细胞内底物,诱导细胞凋亡[12]。本研究结果显示,榅桲总黄酮对氧糖剥夺诱导的人脑微血管内皮细胞中 cleaved-caspase3 蛋白表达起抑制作用,提示其可能通过抑制 caspase 级联反应来减少氧糖剥夺诱导的 HBMEC 凋亡。
缺血性脑卒中发病机制较为复杂,其中氧化应激是影响缺血性脑卒中发生发展的原因之一。脑缺血发生时脑组织中产生大量氧自由基,氧化抗氧化失衡,过度的氧化应激可引起脑组织中细胞凋亡,加剧脑损伤[13]。MDA 是脂质过氧化产物之一,其水平高低可间接反映氧化应激水平[14]。SOD 是重要的抗氧化酶,其可清除氧自由基,减轻自由基对机体组织的损伤[15]。本研究结果显示,HBMEC 经氧糖剥夺诱导后,细胞中 MDA 含量明显升高,SOD 活性降低,说明氧糖剥夺引起 HBMEC 产生了氧化应激;而榅桲总黄酮可呈剂量依赖性降低氧糖剥夺诱导的 HBMEC 中 MDA 含量,并促进 SOD 活性,这表明榅桲总黄酮可有效抑制氧糖剥夺诱导的 HBMEC 氧化应激水平,减轻细胞损伤。
circRNA 呈闭合环状,结构稳定,且高度保守。近年来,随着高通量测序技术的发展,发现人类多种疾病中存在异常表达的 circRNA,这些 circRNA 在细胞凋亡、炎症反应和氧化应激等生理或病理过程中起调控作用,为疾病的治疗提供了分子靶点[16-18]。研究已表明,多种 circRNA 参与调控脑微血管内皮细胞损伤,影响缺血性脑卒中的发生发展[19]。circ_HECTD1 参与肿瘤、肺纤维化、脑梗死等多种疾病的发展进程[20-22]。本研究结果显示,氧糖剥夺能够明显促进 HBMEC 中 circ_HECTD1 的表达,而沉默 circ_HECTD1 减少氧糖剥夺引起的 HBMEC 凋亡,并降低细胞内氧化应激水平,与 Dai 等[23]报道的敲低 circ_HECTD1 可减轻脑缺血引起的神经元损伤的结果一致,这提示 circ_HECTD1 有可能成为治疗缺血性脑卒中的靶点。此外,本研究将 40 μg/ml 的榅桲总黄酮作用于氧糖剥夺诱导的过表达 circ_HECTD1 的 HBMEC,结果显示,与未过表达 circ_HECTD1 的细胞比较,40 μg/ml 的榅桲总黄酮作用于氧糖剥夺的过表达 circ_HECTD1 的 HBMEC 凋亡加剧,且氧化应激水平升高,这表明过表达 circ_HECTD1 减弱了榅桲总黄酮对氧糖剥夺诱导的 HBMEC 凋亡及氧化应激的影响,进一步提示榅桲总黄酮可能通过下调 circ_HECTD1 的表达来抑制氧糖剥夺诱导的 HBMEC 凋亡及氧化应激。
综上,榅桲总黄酮可减少氧糖剥夺诱导的 HBMEC 凋亡,抑制氧化应激,减轻氧糖剥夺诱导的 HBMEC 损伤,其作用机制可能与下调细胞中 circ_HECTD1 表达有关。但本研究尚存在一定的不足之处,还需进一步在体内探究榅桲总黄酮对缺血性脑卒中发生发展的影响;同时需要分离鉴定榅桲总黄酮的主要成分,进一步明确减轻氧糖剥夺诱导的 HBMEC 损伤的主要活性物质。
[1] Mu J, Cheng X, Zhong S, et al. Neuroprotective effects of miR-532-5p against ischemic stroke. Metab Brain Dis, 2020, 35(5): 753-763.
[2] Zhou XY, Xu BC, Gu Y, et al. Long noncoding RNA SNHG1 protects brain microvascular endothelial cells against oxygen-glucose deprivation/reoxygenation-induced injury by sponging miR-298 and upregulating SIK1 expression. Biotechnol Lett, 2021, 43(6):1163- 1174.
[3] Zhang L, Yang H, Li WJ, et al. LncRNA MALAT1 promotes OGD-induced apoptosis of brain microvascular endothelial cells by sponging miR-126 to repress PI3K/Akt signaling pathway. Neurochem Res, 2020, 45(9):2091-2099.
[4] Sun ZX, Suo HL, Wang LH. Protective effects of total flavonoids of Cydonia Oblonga Mill on myocardial injury in myocardial infarction in rats and its effect on JNK and NF-κB pathway. Chongqing Med, 2019, 48(10):1646-1651, 1656. (in Chinese)
孙治霞, 索红亮, 王丽辉. 榅桲总黄酮对心肌梗死大鼠心肌损伤的保护作用及对JNK和NF-κB通路的影响. 重庆医学, 2019, 48(10): 1646-1651, 1656.
[5] Zhou WT, Ma H, Abdurahman A, et al. Effects of total flavonoids from Cydonia oblonga on cardiac structure and function in spontaneously hypertensive rats. Chin Traditional Patent Med, 2016, 38(11):2313-2318. (in Chinese)
周文婷, 马虎, 阿迪力•阿不都热合曼, 等. 榅桲总黄酮对自发性高血压大鼠心脏结构和功能的影响. 中成药, 2016, 38(11):2313- 2318.
[6] Han B, Zhang Y, Zhang Y, et al. Novel insight into circular RNA HECTD1 in astrocyte activation via autophagy by targeting MIR142-TIPARP: implications for cerebral ischemic stroke. Autophagy, 2018, 14(17):1164-1184.
[7] Xiang YY, Wang X, Zhang QX. Influence of medicated serum of Houshi Hei San on expressions of PLCγ2/ERK and TGF-β/Smad2/3 in vascular endothelial cells after injury of oxygen-glucose deprivation. J Beijing Univ Traditional Chin Med, 2019, 42(11):934-939. (in Chinese)
相阳阳, 王璇, 张秋霞. 侯氏黑散含药血清对氧糖剥夺损伤血管内皮细胞PLCγ2/ERK及TGF-β/Smad2/3表达的影响. 北京中医药大学学报, 2019, 42(11):934-939.
[8] Maimaiti G, Tuerxun A, Abudureheman A, et al. Protective effect of total flavonoids in Cydonia oblanga Mill. on human umbilical vein endothelial cell oxidative damage induced by hydrogen peroxide.J Xinjiang Med Univ, 2016, 39(6):696-702. (in Chinese)
古再努尔•买买提, 阿尔孜古丽•吐尔逊, 阿迪力•阿不都热合曼, 等. 榅桲总黄酮对过氧化氢诱导人脐静脉血管内皮细胞氧化损伤的保护作用研究. 新疆医科大学学报, 2016, 39(6):696-702.
[9] Zhang X, Zhou G. MiR-199a-5p inhibition protects cognitive function of ischemic stroke rats by AKT signaling pathway. Am J Transl Res, 2020, 12(10):6549-6558.
[10] Teng H, Li M, Qian L, et al. Long non coding RNA SNHG16 inhibits the oxygen glucose deprivation and reoxygenation induced apoptosis in human brain microvascular endothelial cells by regulating miR 15a 5p/bcl 2. Mol Med Rep, 2020, 22(4):2685-2694.
[11] Zhou WT, Yiming WLY, Ma H, et al. Anti-hypertensive effect of total flavonoids of Cydonia oblonga leaves and its mechanism based on anti-inflammatory function. J Chin Med Mater, 2015, 38(10):2134- 2138. (in Chinese)
周文婷, 邬利娅•伊明, 马虎, 等. 榅桲总黄酮降压作用及抗炎机制的实验研究. 中药材, 2015, 38(10):2134-2138.
[12] Shen X, Wang D, Chen X, et al. Propofol inhibits proliferation, migration, invasion and promotes apoptosis by regulating HOST2/JAK2/STAT3 signaling pathway in ovarian cancer cells. Cytotechnology, 2021, 73(2):243-252.
[13] Li W, Zhu Q, Xu X, et al. MiR-27a-3p suppresses cerebral ischemia-reperfusion injury by targeting FOXO1. Aging (Albany NY), 2021, 13(8):11727-11737.
[14] Yuceli S, Yazici GN, Mammadov R, et al. The effect of lutein on ischemia-reperfusion-induced vasculitic neuropathic pain and neuropathy in rats. In Vivo, 2021, 35(3):1537-1543.
[15] Cheng L, Wang X, Ma X, et al. Effect of dihydromyricetin on hepatic encephalopathy associated with acute hepatic failure in mice. Pharm Biol, 2021, 59(1):557-564.
[16] Lv YS, Wang C, Li LX, et al. Effects of circRNA_103993 on the proliferation and apoptosis of NSCLC cells through miR-1271/ERG signaling pathway. Eur Rev Med Pharmacol Sci, 2020, 24(16):8384- 8393.
[17] Guo X, Miao G, Liu J, et al. CircHivep2 contributes to microglia activation and inflammation via miR-181a-5p/SOCS2 signalling in mice with kainic acid-induced epileptic seizures. J Cell Mol Med, 2020, 24(22):12980-12993.
[18] Shi P, Ji H, Zhang H, et al. circANRIL reduces vascular endothelial injury, oxidative stress and inflammation in rats with coronary atherosclerosis. Exp Ther Med, 2020, 20(3):2245-2251.
[19] Xu X, Wu Z, Qiu H, et al. Circular RNA circPHC3 promotes cell death and apoptosis in Human BMECs after oxygen glucose deprivation via miR-455-5p/TRAF3 axis in vitro. Neuropsychiatr Dis Treat, 2021, 17:147-156.
[20] Jiang QL, Feng SJ, Yang ZY, et al. CircHECTD1 up-regulates mucin 1 expression to accelerate hepatocellular carcinoma development by targeting microRNA-485-5p via a competing endogenous RNA mechanism. Chin Med J (Engl), 2020, 133(15):1774-1785.
[21] Fang S, Guo H, Cheng Y, et al. circHECTD1 promotes the silica-induced pulmonary endothelial-mesenchymal transition via HECTD1. Cell Death Dis, 2018, 9(3):396.
[22] Zhang Z, He J, Wang B. Circular RNA circ_HECTD1 regulates cell injury after cerebral infarction by miR-27a-3p/FSTL1 axis. Cell Cycle, 2021, 20(9):914-926.
[23] Dai Q, Ma Y, Xu Z, et al. Downregulation of circular RNA HECTD1 induces neuroprotection against ischemic stroke through the microRNA-133b/TRAF3 pathway. Life Sci, 2021, 264:118626.
Effects of total flavonoids of. on human brain microvascular endothelial cells injury induced by oxygen and glucose deprivation and its mechanism
LIU Yu-qi, XI Ou, LIU Yi-tong
Department of Encephalopathy (LIU Yu-qi, XI Ou), Department of Rehabilitation (LIU Yi-tong), The Second Affiliated Hospital of Liaoning University of Traditional Chinese Medicine, Shenyang 110000, China
To explore the effect of total flavonoids of. (TFCOM) on the damage of human brain microvascular endothelial cells (HBMEC) induced by oxygen glucose deprivation (OGD) and its possible mechanism.HBMEC was culturedand an OGD model was established. After 10, 20, 40 μg/ml TFCOM were used to interfere with OGD-induced HBMEC, CCK8 method was used to detect cell proliferation activity; flow cytometry was used to detect cell apoptosis; Western blot was used to detect the expression of cleaved-caspase3 protein in cells; Enzyme-linked immunosorbent assay was used to detect SOD activity and MDA content in cells, and RT-PCR was used to detect the expression of circ_HECTD1. The small interfering RNA or overexpression vector of circ_HECTD1 was transfected into HBMEC respectively. The same methods as above were used to observe the effects of circ_HECTD1 on the proliferation and apoptosis of HBMEC induced by OGD and the expression of cleaved-caspase3 protein, SOD activity and MDA content in cells.TFCOM dose-dependently enhanced OGD-induced HBMEC proliferation activity and SOD activity, and reduced OGD-induced HBMEC apoptosis rate, the expression of cleaved-caspase3 protein and circ_HECTD1, as well as MDA content in cells. Silencing circ_HECTD1 enhanced the proliferation activity of HBMEC induced by OGD and SOD activity in cells, but reduced the apoptosis rate of HBMEC induced by OGD, and the content of cleaved-caspase3 protein and MDA in cells. Overexpression of circ_HECTD1 weakened the effects of TFCOM on the proliferation and apoptosis of HBMEC induced by OGD, and SOD activity and MDA content in the cells.TFCOM could reduce OGD-induced HBMEC apoptosis and inhibit oxidative stress. Its mechanism may be related to the down-regulation of circ_HECTD1 expression in the cells.
total flavonoids of.; circ_HECTD1; oxygen glucose deprivation; human brain microvascular endothelial cells; apoptosis; oxidative stress
LIU Yu-qi, Email: lyq13654076169@163.com
10.3969/j.issn.1673-713X.2021.06.007
辽宁省中医药管理局辽宁省中医药临床学(专)科能力建设项目(LNZYXZK201906)
刘禹岐,Email:lyq13654076169@163.com
2021-05-28

