垂柯霉素对结肠癌细胞增殖、迁移能力的抑制及其分子机制
庄琢琛,佟鑫,苏丽娅,白利平
·论著·
垂柯霉素对结肠癌细胞增殖、迁移能力的抑制及其分子机制
庄琢琛,佟鑫,苏丽娅,白利平
100050 北京,中国医学科学院医药生物技术研究所国家卫生健康委员会抗生素生物技术重点实验室(庄琢琛、佟鑫、白利平);010050 呼和浩特,内蒙古医科大学附属医院临床医学研究中心(佟鑫、苏丽娅)
探究垂柯霉素对结肠癌细胞增殖、侵袭及迁移能力的影响和分子机制。采用垂柯霉素对人结肠癌 HCT116、RKO 和 HT29 细胞作用,通过细胞克隆形成实验测定对细胞增殖能力的影响,通过细胞划痕愈合实验测定对细胞横向迁移能力的影响,通过 Transwell 细胞侵袭实验测定对细胞纵向侵袭能力的影响,通过 Western blot 实验检测结肠癌细胞中 P-LRP6、CycD1、Met 和 C-myc 蛋白表达的变化。细胞克隆形成实验结果表明,垂柯霉素可以显著抑制结肠癌细胞的克隆形成能力,降低细胞增殖能力。细胞划痕愈合实验和 Transwell 细胞侵袭实验结果表明垂柯霉素可以显著抑制细胞的横向迁移及纵向侵袭能力。Western blot 实验结果表明垂柯霉素可降低 LRP6 的磷酸化,降低下游蛋白CycD1、Met 和 C-myc 的表达,阐明了垂柯霉素抑制结肠癌细胞增殖的分子机制。垂柯霉素通过降低 LRP6 的磷酸化降低Wnt 通路下游蛋白表达,进而抑制结肠癌细胞的增殖、迁移和侵袭。
结肠癌; 垂柯霉素; 细胞增殖; LRP6; Wnt
癌症是严重威胁人类生命和健康的重要非传染性疾病之一,在中国也是主要的公共卫生问题之一。国际癌症研究机构发布的全球癌症排名显示,结肠癌已成为发病率排名第三的癌症,其死亡率也仅次于肺癌。近年来结肠癌的发病率及死亡率在各个国家和地区也呈逐年上升趋势,严重威胁人类的生命健康[1-2]。结肠癌由多方因素引发,其发生和发展是由多基因和细胞通路改变共同作用的结果。目前结肠癌的治疗主要采取手术和放化疗为主的综合治疗,传统的化疗药物对患者的预后作用很有限,病人化疗耐药情况时有发生,而且对肿瘤的转移或术后复发的治疗仍有局限性[3]。因此,对结肠癌重要的分子和信号通路的研究,以及新型治疗方法的探索显得尤为必要。
结肠癌的发生涉及多种信号通路,其中 Wnt 信号通路在胚胎发育中具有重要作用,同时也调节多种成人组织的自我更新与稳态维持。Wnt 信号通路主要包括三种途径,其中经典的 Wnt 途径通过调节 β-catenin 的水平来调节关键基因水平,从而发挥作用[4-5]。如图1 所示,Wnt 信号进入胞内后,将信号传递给Dishevelled(Dvl),活化的Dvl 抑制由大肠腺瘤性息肉病(APC)、糖原合酶激酶-3β(GSK-3β)、轴突抑制物(Axin)和酪蛋白激酶 1(CK1)组成的复合物的活性,使 β-catenin 不能被GSK-3β 磷酸化,而在胞浆内集聚并进入到细胞核,与T 细胞因子/淋巴增强结合因子(TCF/LEF)家族的DNA 结合,介导靶基因的转录激活[6-7]。而当有 Wnt 小分子配体结合后,会减少 GSK-3β 所在的复合物解体,减少 β-catenin 进入细胞核影响下游蛋白的表达[8]。现已发现多个 Wnt 通路靶基因,如 MMP7、CD44、CycD1、C-myc、c-Jun、Met 等[6-7],这些靶基因可以影响肿瘤血管的形成、细胞的迁移与侵袭、干细胞的维持、上皮-间质转化、免疫逃逸和耐药等。因此,发现靶向 Wnt 通路的抑制剂或转录拮抗剂对于结肠癌治疗具有重要意义。
垂柯霉素(trichomicin)是本实验室从木霉菌属哈茨木霉()中分离得到的新结构小分子化合物,结构式如图 2 所示,已获得发明专利,专利号为 200510082974.X。前期的体外研究证实垂柯霉素具有显著抗炎和抗肿瘤活性,可抑制巨噬细胞 IL-6 和 TNF-α 的转录及分泌,抑制结肠癌及肿瘤基质细胞中 JAK/Stat3 和IKK/NF-κB 通路,从而抑制结肠癌生长[9-10]。本研究通过细胞生物学实验和 Western blot 法分析了垂柯霉素对结肠癌细胞的侵袭和迁移能力及相关调控的分子机制,对探究结肠癌的发生机制及防治均有重要意义,以期为开发小分子化合物作为治疗手段提供理论依据。
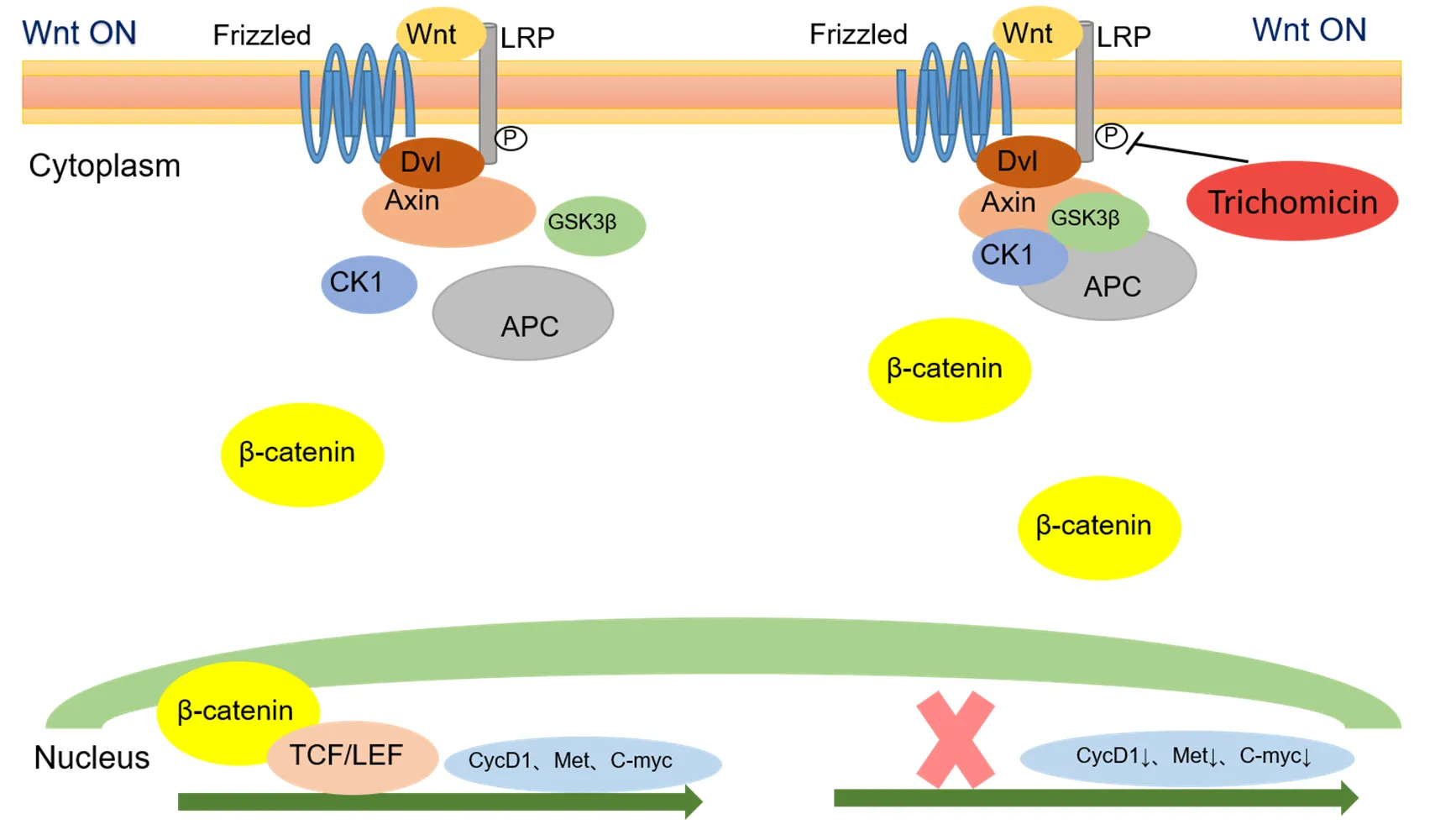
图 1 垂柯霉素抑制结肠癌中经典 Wnt 信号通路的机制图
Figure 1 Proposed mechanistic scheme of trichomicin suppressing the canonical Wnt signaling pathway in colorectal cancer
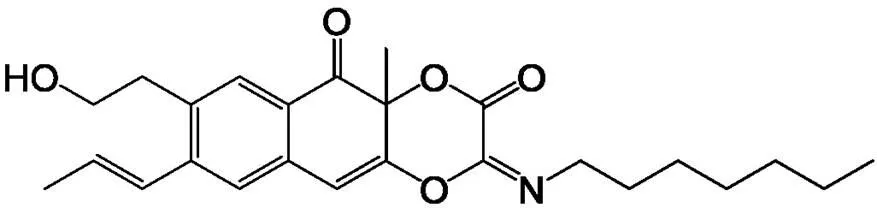
图 2 垂柯霉素化学结构式
Figure 2 The structure of trichomicin
1 材料与方法
1.1 材料
1.1.1 实验试剂 胎牛血清、0.25% 胰蛋白酶消化液(含 EDTA)购自 Gibco 公司;细胞培养基、青霉素/链霉素双抗溶液、磷酸盐缓冲液均购自 Hyclone 公司;30% 丙烯酰胺、聚丙烯酰胺、分离胶缓冲液、浓缩胶缓冲液、10 × 电泳缓冲液、10 × 电转移缓冲液、封闭专用脱脂奶粉、牛血清白蛋白 BSA、5 × 蛋白上样缓冲液、RIPA 裂解液、蛋白酶和磷酸酶抑制剂、BSA 蛋白定量标准品、BCA 蛋白定量试剂盒购自普利莱基因技术有限公司;过硫酸铵购自北京化工厂;预染分子量 marker 购自美国 Thermo 公司;化学发光 HRP 底物购自美国 Millipore 公司;结晶紫购自日本 Nacalai tesque 公司;4% 多聚甲醛通用型组织固定液购自 Biosharp 公司;甲醇购自北京市通广精细化工公司。
兔抗人抗体 P-LRP6(2568)、CycD1(2978)、Met(8198)、C-myc(5605),鼠抗人抗体 GAPDH 购自 Cell Signal Technology 公司;抗鼠抗体 Goat Anti Mouse IgG、抗兔抗体 Goat Anti Rabbit IgG 购自金普莱公司。
1.1.2 仪器与耗材 AE2000 倒置显微镜购自德国 Leica 公司;ChemiDocTMImaging System 凝胶成像系统、Power Pac Hc 蛋白电泳电源、Mini PROTEANTEtra system 蛋白电泳槽、CriterionTMBlotter Western blot 转膜仪购自美国 Bio-Rid 公司;Legend Micro 17 台式微型超速离心机、CO2细胞培养箱购自美国 Thermo Fisher 公司;Centrifuge 5430R 台式温控微量超速离心机购自德国 Eppendorf 公司;TDZ5-WS 台式低速离心机购自上海卢湘仪离心机仪器有限公司;IncuCyte 长时间动态活细胞成像仪购自美国 Essen BioScience 公司;TS-8 水平摇床购自海门其林贝尔公司;BT 25S 电子精密分析天平购自德国 Sartorius公司;MINIC-1001 迷你金属浴购自杭州米欧仪器有限公司;0.45 μm PVDF 膜购自美国 Millipore 公司;3422 Transwell 嵌套(6.5 mm,8.0 μm)、细胞培养瓶、细胞培养板等细胞实验耗材均购自美国 Corning 公司。
1.2 方法
1.2.1 细胞培养 人结肠癌 RKO、HCT116 和HT29 细胞均购自中国医学科学院基础医学研究所基础医学细胞中心,RKO 细胞使用 MEM 培养基,HCT116 细胞使用 IMEM 培养基,HT29 细胞使用 DMEM/Ham’s F-12 培养基,均加入 10% FBS 和 1% 双抗,置于 37 ℃、5% CO2培养箱中培养。细胞融合度达 80% ~ 90% 进行传代,用 PBS 洗涤细胞,并在胰蛋白酶消化后以 1000 r/min 离心 1 min 收获细胞,随后按比例分装至新培养瓶中,于培养箱中继续培养。
1.2.2 细胞克隆形成实验 将细胞以 2500 个/孔接种至六孔板中,加入含垂柯霉素的培养基,浓度为 2.5、5 和 10 μmol/L,每个浓度设置 3 个复孔;同时设置不含垂柯霉素的对照组。将细胞放入培养箱中培养 2 ~ 3 周。当形成细胞克隆集落时终止培养,用 0.1% 的结晶紫染液染色 20 min,再用 PBS 漂洗至背景透明,进行拍照计数。以≥ 50 个细胞/集落为标准计算克隆形成率,克隆形成率(%)=(细胞集落数/初始接种细胞数)× 100%。
1.2.3 细胞划痕愈合实验 取对数生长期的 HCT116 和 RKO 两种细胞用胰酶消化,调整细胞密度接种至 96 孔板中,使其于培养箱过夜孵育后铺满板底。次日用 PBS 洗涤细胞两次,将 96 孔板放入划痕盒中,进行划痕操作。随后经 PBS 洗涤划痕产生的细胞碎片,加入含 10 μmol/L垂柯霉素和不含垂柯霉素的无血清细胞培养基,放入 IncuCyte 长时间动态活细胞成像仪中,每 4 ~ 6 小时拍照记录,根据收集图片数据分析实验结果,计算细胞迁移率。细胞迁移率(%)=(0 h 细胞划痕面积– 不同时间后细胞划痕面积)/ 0 h 细胞划痕面积 × 100%。
1.2.4 Transwell 细胞侵袭实验 首先以含10 μmol/L浓度的垂柯霉素和不含垂柯霉素的培养基处理细胞 24 h,然后在不含 FBS 的培养基中饥饿处理细胞 12 h。用 Matrigel 基质胶包被 Transwell 小室底部膜的上室面以模拟细胞外基质,用不含 FBS 的培养基将细胞密度调整为 1 × 104个/ml,取 200 μl 细胞悬液加至 Transwell 小室的上室中;在下室加入 600 μl 含 10% FBS 的培养基,置于培养箱中孵育 24 h,每个浓度设置 3 个平行。培养结束后,用 0.1% 的结晶紫染色液室温染色 20 min,经 PBS 漂洗至细胞不再脱色为止,用湿棉签擦去基质胶和 Transwell 小室膜上层细胞,在显微镜下观察并拍照计数。
1.2.5 Western blot 实验检测蛋白水平变化 将细胞以 4 × 105个/孔的密度接种于六孔板,用浓度为2.5、5 和 10 μmol/L的垂柯霉素处理 24 h,同时设置不含垂柯霉素的对照组。随后将细胞用 RIPA 缓冲液裂解并煮沸 5 min,使用 BCA 蛋白质测定试剂盒定量蛋白浓度。将蛋白提取物进行 SDS-PAGE,然后转移至 PVDF 膜。用 5%脱脂牛奶封闭后,将膜分别与P-LRP6(2568)、Met(8198)、CycD1(2978)、C-myc(5605)、GAPDH(D3018)一抗在4 ℃下孵育过夜。次日使用辣根过氧化物酶标记的二抗室温孵育 1 h,在待测 PVDF 膜上方滴加 HRP 底物发光液后,利用 ChemiDocTMImaging System 凝胶成像系统进行扫描。
1.3 统计学处理
2 结果
2.1 垂柯霉素抑制细胞克隆形成
垂柯霉素对 HCT116、RKO 和 HT29 细胞的克隆形成率影响见图 3,3 种细胞的对照组克隆形成率分别为 15.0% ± 0.4%、10.8% ± 0.2% 和 36.2% ± 3.6%。随着垂柯霉素浓度增加,细胞克隆形成能力逐渐减弱,其中 HT29 细胞在 2.5 μmol/L 的垂柯霉素处理后克隆形成率与对照组呈显著性差异(< 0.05),在5 μmol/L 的垂柯霉素处理后与对照组呈极显著差异(< 0.01);HCT116 与 RKO 细胞 2.5 和 5 μmol/L 组分的克隆形成率均与对照组呈极显著差异(< 0.01);在垂柯霉素浓度达 10 μmol/L 时,细胞几乎不再形成克隆集落,表明垂柯霉素能够显著抑制结肠癌细胞的增殖。
2.2 垂柯霉素对 Wnt 通路的抑制
图 4 为不同浓度垂柯霉素处理 HCT116、RKO 和 HT29 细胞后,不同蛋白的表达情况。正常情况下,Wnt 通路激活后 LRP6 会被磷酸化,使得 P-LRP6 表达升高,促进 Axin/APC/GSK-3β 复合物解体,使得 β-catenin 不能被磷酸化,进而下游靶蛋白增多。而当垂柯霉素作用后,观察到下游的 CycD1、Met 和 C-myc 蛋白的表达减少,说明垂柯霉素可以抑制 Wnt 通路下游蛋白的表达。此外,垂柯霉素还使得 P-LRP6 表达下降,说明垂柯霉素可能是通过 LRP6 磷酸化减少,进而减少了复合物的解体,抑制了 β-catenin 进入细胞核,从而抑制下游靶蛋白的表达。

Figure 3 Effects of different concentration of trichomicin on the colony formation of HCT116, RKO and HT29 cells (*< 0.05,**< 0.01)
Figure 4 Different concentration of trichomicin inhibits the Wnt pathway in HCT116, RKO and HT29 cells
2.3 垂柯霉素抑制细胞划痕愈合能力
由于细胞克隆形成和 Western blot 实验中10 μmol/L 浓度的垂柯霉素对细胞增殖及蛋白表达的抑制作用最强,因而后续实验均采用 10 μmol/L 浓度的垂柯霉素进行。如图 5 所示,10 μmol/L 浓度的垂柯霉素作用于 HCT116 和 RKO 细胞后,细胞的迁移能力受到明显抑制。经 48 h 孵育后,HCT116 和 RKO 细胞经垂柯霉素作用后划痕愈合率虽有上升,但均明显低于对照组的 100% 划痕愈合率;其中 HCT116 细胞经垂柯霉素作用后于6 h 和对照组呈显著差异(< 0.05),12 ~ 48 h 均与对照组呈极显著差异(< 0.01),RKO 细胞于8 ~ 48 h 均与对照组呈极显著差异(< 0.01)。以上表明垂柯霉素能够明显抑制结肠癌细胞的划痕愈合能力。
Figure 5 Influence of trichomicin on the migration of HCT116 and RKO cells

Figure 6 Effects of trichomicin on HCT116 and RKO cells invasion (**< 0.01)
2.4 垂柯霉素抑制细胞侵袭
细胞侵袭实验结果如图 6 所示,垂柯霉素作用于 HCT116 和 RKO 细胞后,细胞的穿膜数量均明显减少。对比穿膜细胞数量发现,10 μmol/L 的垂柯霉素处理细胞时,100 倍显微镜下 HCT116 侵袭细胞数为 191.3 ± 49.1,显著低于对照组 688.0 ± 99.1(< 0.01);RKO 侵袭细胞数为 120.7 ± 17.0,显著低于对照组608.3 ± 105.7(< 0.01),表明垂柯霉素能够抑制结肠癌细胞的纵向侵袭能力。
3 讨论
Wnt 信号异常与多种癌症直接相关,包括结直肠癌、黑素瘤和肝细胞癌[11]。在结直肠癌中,Wnt 信号通路通过诱导肿瘤细胞增殖、迁移和侵袭在癌症进展中起重要作用,可作为结肠癌治疗的治疗靶标[12-13]。现已开发出多种 Wnt 信号通路抑制剂用于结肠癌治疗,包括天然产物(如维生素 D 和姜黄素)、非甾体抗炎药、小分子药物(如 MSAB和HI-B1)和生物制剂(如单克隆抗体 OMP-18R5 和 OMP-54F28)[13-15]。本文中选用的垂柯霉素是本课题组从木霉菌属哈茨木霉中分离得到的小分子化合物,对结肠癌细胞中的 JAK/Stat3 和 IKK/NF-κB 通路有抑制作用,具备显著的抗炎和抗肿瘤活性[10]。
小分子药物正广泛应用于肿瘤的治疗,其具有靶向性强,对正常组织的毒性较小的特点,因此成为预防和治疗癌症的更好选择。课题组先前已经通过人结肠癌细胞 HT29 裸鼠移植模型抗瘤实验证明,垂柯霉素能抑制 HT29 裸鼠移植瘤的生长,不同组间肿瘤组织中细胞因子检测结果显示,垂柯霉素作用后的肿瘤组织中 IL-6 及 TNF-α 含量显著降低[9]。本文中,首先通过细胞克隆形成实验、细胞划痕愈合实验和 Transwell 细胞侵袭实验证实了垂柯霉素可以显著抑制结肠癌细胞的克隆形成能力、划痕愈合能力以及纵向侵袭能力。为探究垂柯霉素抑制细胞增殖的分子机制,通过 Western blot 实验发现,经垂柯霉素处理的人结肠癌 HCT116、RKO 和 HT29 细胞中 P-LRP6 蛋白的表达降低,说明垂柯霉素降低了 LRP6 的磷酸化,减少GSK3β/APC/Axin/CK1 复合物的解体,进而使得进入细胞核中的β-catenin 减少,从而降低下游蛋白CycD1、Met 和 C-myc 的表达,阐明了垂柯霉素抑制结肠癌细胞增殖的分子机制。
综上所述,本研究对垂柯霉素处理后的人结肠癌细胞进行了研究,分析了垂柯霉素对结肠癌细胞增殖和迁移能力的影响。结果表明,垂柯霉素通过抑制 Wnt 通路 LRP6 磷酸化,使得下游 CycD1、Met 和 C-myc 蛋白的表达减少,从而对细胞的克隆形成能力及细胞迁移和侵袭能力都有明显的抑制作用,并且随着垂柯霉素剂量的增加,抑制作用更明显。本研究不仅通过细胞表型实验证实了垂柯霉素能够抑制结肠癌细胞的增殖和迁移,还探究了垂柯霉素调控结肠癌的分子机制,对于探讨结肠癌的发生机制及防治均具有重要意义。
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 2018, 68(6):394-424.
[2] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012. CA Cancer J Clin, 2015, 65(2):87-108.
[3] Lawdmann RG, Weiser MR. Surgical management of locally advanced and locally recurrent colon cancer. Clin Colon Rectal Surg, 2005, 18(3):182-189.
[4] Rodriguez-Salas N, Dominguez G, Barderas R, et al. Clinical relevance of colorectal cancer molecular subtypes. Crit Rev Oncol Hemat, 2017, 109:9-19.
[5] Clevers H, Nusse R. Wnt/β-catenin signaling and disease. Cell, 2012, 149(6):1192-1205.
[6] Clevers H. Wnt/β-catenin signaling in development and disease. Cell, 2006, 127(3):469-480.
[7] Reya T, Clevers H. Wnt signalling in stem cells and cancer. Nature, 2005, 434(7035):843-850.
[8] Giles RH, van Es JH, Clevers H. Caught up in a Wnt storm: Wnt signaling in cancer. Biochim Biophys Acta, 2003, 1653(1):1-24.
[9] Qi XQ, Zhu FC, Zhang Y, et al. Study of a novel compound 2460A with activities produced by fungus. Acta Pharm Sinica, 2011, 46(2): 165-169. (in Chinese)
齐小强, 朱凤昌, 张洋, 等. 真菌来源新活性化合物2460A的研究. 药学学报, 2011, 46(2):165-169.
[10] Zhao X, Qi X, Lian W, et al. Trichomicin suppresses colorectal cancer via comprehensive regulation of IL-6 and TNFα in tumor cells, TAMs, and CAFs. Front Pharmacol, 2020, 11:386.
[11] Yost C, Torres M, Miller JR, et al. The axisinducing activity, stability, and subcellular distribution of beta-catenin is regulated in Xenopus embryos by glycogen synthase kinase 3. Genes Dev, 1996, 10(12): 1443-1454.
[12] Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer. Nature, 2012, 487(7407):330-337.
[13] Cheng X, Xu X, Chen D, et al. Therapeutic potential of targeting the Wnt/beta-catenin signaling pathway in colorectal cancer. Biomed Pharmacother, 2019, 110:473-481.
[14] Hwang SY, Deng X, Byun S, et al. Direct targeting of β-catenin by a small molecule stimulates proteasomal degradation and suppresses oncogenic Wnt/β-Catenin signaling. Cell Rep, 2016, 16(1):28-36.
[15] Shin SH, Lim DY, Reddy K, et al. A small molecule inhibitor of the β-Catenin-TCF4 interaction suppresses colorectal Cancer growth in vitro and in vivo. EBioMedicine, 2017, 25:22-31.
The inhibitory effect of trichomicin on the proliferation and migration of colon cancer cells and its molecular mechanism
ZHUANG Zhuo-chen, TONG Xin, SU Li-ya, BAI Li-ping
NHC Key Laboratory of Biotechnology of Antibiotics, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China (ZHUANG Zhuo-chen, TONG Xin, BAI Li-ping); Clinical Medical Research Center, The Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010050, China (TONG Xin, SU Li-ya)
To explore the effect and molecular mechanism of trichomicin on colon cancer cell proliferation, invasion and migration.Human colon cancer HCT116, RKO and HT29 cells were treated with trichomicin. Effect of trichomicin on cell proliferation, migration and invasion were determined by cell clone formation assay, wound healing assay and Transwell invasion assay, respectively. The changes of P-LRP6, CycD1, Met and C-myc protein expression were detected by Western blot in the colon cancer cells.Trichomicin could significantly inhibit the colon cancer cell clone formation, thereby reducing the ability of cell proliferation. According to the results of wound healing assay and Transwell invasion assay, trichomicin could significantly inhibit the horizontal migration and vertical invasion of cells. Trichomicin could reduce the phosphorylation of LRP6 and the expression of proteins CycD1, Met and C-myc, as confirmed by the Western blot results.Trichomicin reduces the expression of proteins in the Wnt pathway by reducing the phosphorylation of LRP6, thereby inhibiting the proliferation, migration and invasion of colon cancer cells.
colorectal cancer; trichomicin; proliferation; LRP6; Wnt
BAI Li-ping, Email: lipingbai1973@163.com
10.3969/j.issn.1673-713X.2021.06.003
“重大新药创制”国家科技重大专项(2018ZX09711001- 007-003)
白利平,Email:lipingbai1973@163.com
2021-02-26

