培养基中细胞生长因子增强人间充质干细胞成瘤性风险
张可华,贾春翠,吴雪伶,纳涛,韩晓燕,吴婷婷,孟淑芳
·论著·
培养基中细胞生长因子增强人间充质干细胞成瘤性风险
张可华,贾春翠,吴雪伶,纳涛,韩晓燕,吴婷婷,孟淑芳
100050 中国食品药品检定研究院生物制品检定所细胞资源保藏研究中心
本中心在人间充质干细胞(hMSCs)第三方复核检验中发现某些无血清培养基会促使 hMSCs 在软琼脂克隆试验中呈现阳性结果。为进一步明确该现象,探索促使 hMSCs 软琼脂克隆阳性的培养基成分并深入分析其风险。比较几种不同品牌的商品化无血清培养基对 hMSCs 软琼脂克隆形成的影响,通过细胞因子抗体芯片和 ELISA 定量检测筛选并初步确定促使软琼脂克隆形成的培养基成分,通过在培养基中添加特定成分进一步明确该成分对 hMSCs 成瘤性的影响,并通过长期添加试验和细胞转录组测序分析该培养基成分持续作用对 hMSCs 生长和基因转录方面的影响。研究结果显示,部分品牌无血清培养基可促使 hMSCs 在软琼脂克隆形成试验中呈现阳性。培养基成分分析显示这些培养基中表皮细胞生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)和血小板源性生长因子(PDGF-BB)呈现出较高水平。在含 10% FBS 的完全培养基中分别或组合添加EGF(50 ng/ml)、bFGF(50 ng/ml)和 PDGF-BB(10 ng/ml),均可促使 hMSCs 软琼脂克隆形成。以上述浓度添加生长因子持续培养 hMSCs 10 代后,再撤掉生长因子继续培养 3 代,细胞增殖和基因转录发生显著改变。培养基中含有的高浓度 EGF、bFGF 和 PDGD-BB 等生长因子成分能够增强 hMSCs 成瘤性风险,用这些生长因子长期培养 hMSCs 可对细胞增殖和基因转录造成显著影响。本研究提示在 hMSCs 类细胞治疗产品工艺研发中,需高度关注培养基关键成分对 hMSCs 特性的影响,结合成瘤性分析优化并筛选最适培养基。
间充质干细胞; 成瘤性; 表皮细胞生长因子; 成纤维细胞生长因子; 血小板源性生长因子; 软琼脂克隆形成试验
人间充质干细胞(human mesenchymal stem cells,hMSCs)是一类具有一定程度的自我复制更新、多谱系分化能力的成体干细胞,广泛存在于人体各组织中,具有独特的免疫调控和促进组织再生功能[1-3]。由于 hMSCs 来源相对容易和制备方法相对简单,具有十分广泛的临床适应证,已成为目前干细胞治疗研究领域中发展最为迅速的一类[4-7]。截至 2021 年第一季度,国际上有 10 余例 hMSCs 类药物问世,在我国有 13 项 hMSCs 临床试验获国家药品审评中心默示许可,此外还有 60 余项 hMSCs 干细胞临床研究项目在国家卫生健康委和国家药品监督管理局成功备案。
尽管与胚胎干细胞、iPSC 等多能干细胞相比,研究普遍认为 hMSCs 成瘤性风险较小,但成瘤性检查仍是 hMSCs 安全性风险重要考虑因素之一。采用裸鼠体内接种法进行细胞成瘤性检查是各国药典收录且被监管部门广为接受的标准性试验方法,但同时,对于某些弱成瘤性细胞,体外成瘤性检查方法也能够反映细胞成瘤性的一种或几种性质,可作为体内法的补充和参考。软琼脂克隆形成试验是常用的体外成瘤性检查方法之一,它可以评价细胞的锚定非依赖性生长能力,而这种锚定非依赖性生长也是肿瘤细胞、转化细胞所具有的生长特性之一[8],可以间接地反映细胞成瘤性风险。我们前期大量的研究数据显示,不同来源的 hMSCs 普遍表现为成瘤性阴性的特性,即裸鼠体内接种试验阴性,即在接种部位以及各脏器不会形成结节;体外软琼脂克隆形成阴性,即在软琼脂中不会形成包含 16 个以上活细胞的细胞克隆;端粒酶活性阴性。
但随着 hMSCs 产业化进程,hMSCs 培养体系出现多样化,如科研常用的含胎牛血清(FBS)或牛血清提取物的培养体系、含人血液来源成分(如血小板裂解物)的培养体系以及成分明确的无血清培养体系。不论是从降低外源因子污染引入风险,还是从培养基生产可控性以及监管角度来讲,作为治疗用药品开发的 hMSCs 产品也在被推荐或建议使用无血清培养体系,目前国内外已开发出几种适用于 hMSCs 的成分明确的无血清培养基,已申报干细胞临床备案第三方复核检验的研发机构中,自 2018 年以来有 38.2% 开始采用成分无血清培养基进行 hMSCs 培养。但这些成分明确的无血清培养基中常常会添加多种促进细胞增殖的细胞生长因子、激素或小分子化合物,如成纤维细胞生长因子(FGF)、血小板源性生长因子(PDGF)、表皮生长因子(EGF)和转化生长因子(TGF-β)等,这些添加物的成分和浓度与细胞在体内时的环境差别可能相对较大,除有效促进细胞生长外,对细胞产品的安全性和有效性影响尚不明确。
近年来,我们中心在 hMSCs 第三方复核检验过程中陆续发现某些无血清培养基可促使 hMSCs 出现软琼脂克隆形成阳性,提示成瘤性风险可能有所增大,因此,为进一步明确该问题,并分析造成此结果的原因,我们开展了相关研究。
1 材料和方法
1.1 材料
1.1.1 细胞及培养 CCRC1-hMSCs-S1 为本中心收集和保藏并用于试验对照的脐带来源 hMSCs[9];其他脐带来源 hMSCs 为在本中心进行第三方复核的样本,并均在本中心完成了全面的 hMSCs 检验,检验内容包括细胞鉴别、活性、纯度、微生物学安全性、分化能力、免疫调控能力检测以及体内外成瘤性检测等。
hMSCs 常规培养培养基为含 10% FBS的 α-MEM。阳性对照细胞 HeLa-S3 为本室保存,细胞编号为 CCBC003,代次为 Pn10 ~ Pn14,STR 图谱正确,无细菌及支原体污染,培养基为含 10% FBS 的 α-MEM。
1.1.2 试剂 α-MEM 培养基、磷酸盐缓冲液(PBS)购自美国 Hyclone 公司;FBS、胰蛋白酶、Trizol 为美国 Thermo Fisher Scientific 的 Gibco 品牌;琼脂糖、结晶紫购自美国 Sigma-Aldrich 公司;bFGF、EGF、PDGF-BB 购自 Peprotech;bFGF和 EGF ED50< 0.1 ng/ml,相应的比活性≥ 1 ×107units/mg,PDGF-BB ED50为 1.0 ~ 3.0 ng/ml;Human EGF ELISA Kit 和 Human FGF basic ELISA Kit 购自爱必信(上海)生物科技有限公司;Human PDGF-BB Quantikine ELISA Kit 购自美国R&D 公司;抗体芯片 Human Cytokine Antibody Array G-Series 2000 为美国 Raybiotech 公司产品;转录组测序建库试剂盒为 VAHTS Universal V6 RNA-seq Library Prep Kit for Illumina;本研究中所分析的 6 种不同品牌的无血清培养基 SFM 1 ~ 6 均为 hMSCs 产品研发机构常用的商品化无血清培养基。
1.1.3 关键设备 Cytation 5 细胞成像多模式检测仪为美国 Biotek 公司产品;GenePix 4000B 芯片扫描仪购自美国 Molecular Devices 公司;IX53 倒置荧光显微镜购自日本 Olympus 公司;转录组测序由武汉华大基因科技有限公司完成,所用测序仪为 Illumina Hiseq 平台。
1.2 方法
1.2.1 软琼脂克隆形成试验 待检细胞和阳性对照细胞用 0.25% 胰蛋白酶消化成单细胞,离心重悬后用细胞筛过滤计数。琼脂糖用 PBS 配制成 5% 浓度,经高压灭菌后形成 5% 琼脂糖凝胶,稍待冷却后与预热至 39 ℃的含 FBS 培养基或无血清培养基混匀配成 0.5% 底层凝胶,以 1.5 ml/孔加到 6 孔板中,置于4 ℃冷却备用。将 5% 琼脂糖凝胶、相应的细胞培养基、细胞悬液三者混匀制备成终浓度为 0.3% 琼脂糖和 2000 个/ml 的上层凝胶,混匀后以 1.5 ml/孔加到底层凝胶上,立即置于 4 ℃环境中,约 10 min 上层琼脂凝固。从4 ℃取出加入 1 ~ 2 ml 相应的细胞培养基覆盖于凝胶表面,置于细胞培养箱中培养 3 周,期间每3 ~ 5 天更换表层培养基。培养终止后用 0.025% 结晶紫染料或 Hoechst 33342 荧光染料对细胞染色,在显微镜下观察细胞克隆形成情况。细胞克隆计数采用细胞成像多模式检测仪拍照、计数并计算每一个细胞克隆的面积,克隆内细胞数≥ 16 个或克隆面积≥ 1000 μm2视为阳性克隆。
1.2.2 抗体芯片检测 取新鲜配制的含 10% FBS 的 α-MEM 培养基和各品牌的无血清培养基检测。检测步骤按照试剂盒说明书进行,简要描述如下:将玻片取出,室温干燥 2 h,每孔加入 100 μl 的封闭液,室温摇床上孵育 30 min。吸弃缓冲液后加入 100 μl样品到孔中,设复孔,4 ℃孵育过夜。吸弃样本,150 μl洗液 I 洗 5 次,150 μl洗液 II 洗5 次,每次洗时在摇床上振荡 5 min。加入新鲜配好的检测抗体 80 μl/孔,室温摇床上孵育 1.5 h 后用洗液 I 和洗液 II 洗涤。加入 Cy3-链霉亲和素80 μl/孔,在摇床上避光孵育 1 h 后用洗液 I 清洗5 次,洗液 II 清洗 5 次。拆掉玻片框架,用洗液 I 洗 10 min,洗液 II 洗 2 min,去离子水冲洗玻片,避光晾干。用芯片扫描仪采集信号,采用 Cy3 或者绿色通道(激发频率= 532 nm)。
1.2.3 ELISA 检测 将各品牌无血清培养基用试剂盒中的稀释液分别稀释 10、100 和 1000 倍检测。bFGF、EGF、PDGF-BB 检测按照厂家说明书进行。简述如下:按照试剂盒说明系列稀释配置标准溶液,将稀释液、标准溶液和样品分别加入到相应孔中,100 μl/孔,设复孔。室温孵育 2 h,用 1 × 洗涤液洗板 3 次。加入 100 μl链霉亲和素-HRP,室温孵育 20 min,用 1 × 洗涤液洗板 3 次。加入新鲜配制的显色底物 100 μl,室温孵育 15 min,加入 50 μl终止液。使用酶标仪检测 450 nm处吸光度值(450),参考波长设为 540 nm。将每个标准品和样品的校正吸光度值(450~540)复孔读数取平均值,然后减去零标准品平均值。采用四参数逻辑回归曲线(4-PL)拟合创建标准曲线并计算出样本浓度,乘以稀释倍数后即为待测样本实际含量。
1.2.4 转录组测序 收集添加不同生长因子培养至各个代次的 CCRC1-hMSCs-S1约 5 × 106个,用 PBS 洗涤后加入 1 ml Trizol 试剂,提取总 RNA。使用 DNaseI 消化后,应用 Agilent 2100 Bioanalyzer 检测 RNA 浓度和完整性,用带有 Oligo(dT)的磁珠富集 mRNA,加入破碎缓冲液将其打断成短片段,以 mRNA 为模板,用六碱基随机引物合成第一条 cDNA 链,然后加入 RNase H 和 DNA 聚合酶 I 合成第二条 cDNA 链。经纯化后的双链 cDNA 末端修复、加 poly A 尾并连接测序接头,PCR 扩增,使用 Agilent 2100 Bioanalyzer 对文库的插入片段范围进行检测以及使用 ABI StepOnePlus Real-Time PCR System 对文库的浓度进行定量,质检合格后,使用 Illumina HiSeq 测序仪进行测序。
对测序得到的 raw data 过滤后得到 clean reads 比对到参考序列 hg19。基于比对结果进行基因定量分析,根据基因在不同样品组中的表达量进行差异表达分析,对筛选出的差异表达基因进行GO 功能分析、KEGG 通路功能分析、聚类分析等。
1.2.5 数据分析 抗体芯片数据分析、转录组数据分析、细胞克隆数量和面积分析以及做图采用 R语言中的 tidyverse、ggplot2、pheatmap、factoextra、DESeq2 和 clusterProfiler 等包。转录组测序热图分析采用 pheatmap 包,各组待分析细胞的筛选条件为 CV(FPKM)> 0.5且 max(FPKM)> 10。
2 结果
2.1 无血清培养促使 hMSCs 软琼脂克隆试验结果阳性
在 hMSCs 第三方质量复核检验过程中发现一些使用无血清培养基工艺生产的 hMSCs 软琼脂克隆试验呈现阳性结果,为进一步证实该现象,我们选用一株常规用含 10% FBS 的 α-MEM 完全培养基培养且软琼脂克隆试验阴性的脐带来源 hMSCs 细胞株进行研究。对该细胞用 6 种无血清培养基 SFM 1 ~ 6 或 10% FBS 的培养基配制琼脂糖胶进行软琼脂克隆形成试验,培养 21 d 后对细胞克隆形成数量和克隆面积进行分析。结果显示在 SFM 4、5 和 6 无血清培养基组可见一定数目的明显的阳性细胞克隆,克隆数分别为 24、32 和 21 个,阳性克隆的平均面积为 1627.7、1865.3 和 1958.5 μm2,而在含 10% FBS 培养基和 SFM 1、2 和 3 无血清培养基组中未见到阳性克隆形成(表 1,图 1)。阳性对照细胞 HeLa-S3 结果为阳性,表明试验成立。
2.2 促使软琼脂克隆阳性的无血清培养基含有较高的生长因子
为了研究无血清培养基促进细胞软琼脂克隆形成的原因,通过细胞因子抗体芯片分析了 4 种无血清培养基(SFM 1、SFM 4、SFM 5、SFM 6)中 174 种细胞生长因子的情况。这 4 种无血清培养基中均检测到了大量的细胞因子、生长因子、趋化因子。分析结果显示,在这些检测到的因子中,与其他细胞因子相比,PDGF-BB、EGF 和 bFGF 这3 种生长因子在 4 种无血清培养基中的含量均排在前列(图 2A),其中 EGF 在 SFM 4、5 和 6 中的含量明显高于 SFM 1(图 2B)。对这4 种无血清培养基中的 EGF、bFGF 和 PDGF-BB 3 种生长因子的定量检测结果显示,不同的无血清中添加的这 3 种因子的含量差别明显,其中 EGF 在 SFM 4、5 和 6 中含量均比较高,分别为41.2、63.0 和 11.7 ng/ml,在 SFM 1 ~ 3 中则均< 1.1 ng/ml。bFGF 在 SFM 4 中含量最高,为55.0 ng/ml,其他组均 < 3.6 ng/ml。PDGF-BB 则在 SFM 6、1 和 5 中表达最高,分别为 5.1、3.8 和1.8 ng/ml,其他组均 < 0.8 ng/ml(图 2C)。

表 1 不同的培养基条件下 hMSCs 软琼脂克隆形成情况

图 1 不同培养基对 hMSCs 软琼脂克隆形成的作用(A:hMSCs 在不同培养基条件下形成克隆的数量和面积,SFM:无血清培养基;PS:阳性对照细胞 HeLa-S3;B:细胞克隆的代表性图片,比例尺:500 μm)
Figure 1 Cell colony formation in soft agar of hMSCs under different culture conditions (A: Numbers and areas of cell colonies formed by hMSCs, SFM: Serum free medium; PS: Positive control cell HeLa-S3; B: Representive picture of cell colonies, scale:500 μm)
2.3 添加生长因子促使 hMSCs 软琼脂克隆试验结果阳性
为进一步验证这 3 种生长因子对 hMSCs 成瘤性的影响,我们用前期开发的 hMSCs标准细胞株 CCRC1-hMSCs-S1 进行了分析,该细胞在含 10% FBS 的 α-MEM 完全培养基培养中软琼脂克隆检测为阴性。在含血清的完全培养基中将这 3 种细胞因子分别或组合添加后进行软琼脂克隆形成试验,终浓度分别为 EGF 50 ng/ml、bFGF 50 ng/ml 及 PDGF-BB 10 ng/ml。结果显示在完全培养基中分别添加 EGF(E 组)、bFGF(F 组)、PDGF-BB(P 组)以及混合添加 3 种因子(E/F/P 组)克隆形成为阳性,阳性克隆数分别为 6、23、5 和25 个/孔,且 3 种因子混合添加组(E/F/P 组)阳性克隆面积最大,最大克隆达到 3389 μm2,阳性克隆平均面积(2058.3 ± 1092.1)μm2(图 3,表 2)。这些结果表明细胞培养基中的 EGF、bFGF 和 PDGF-BB 细胞生长因子水平升高到一定浓度时能促使原本软琼脂克隆阴性的 hMSCs 转为阳性,有可能增加 hMSCs 成瘤的安全性风险。
2.4 添加生长因子长期培养后hMSCs基因表达发生不可逆的改变
为了进一步阐明含有较高浓度的 EGF、bFGF 和 PDGF-BB 的培养基长期培养 hMSCs 后会对细胞产生的影响,仍以 CCRC1-hMSCs-S1 为模型,在培养基中按如上浓度分别或混合添加这3种生长因子,将 hMSCs 从 P10 代培养至 P20 代,之后再更换为未添加生长因子的原培养基继续培养至 P23 代(图 4A)。结果显示,添加细胞生长因子后细胞形态变得更小更细长,增殖速度明显加快(图 4B),其中以添加 bFGF 组和 3 种生长因子组变化更为显著。随着培养时间延长,添加生长因子组和未添加的对照组相比,形态和增殖变化差异逐渐变小,培养到 P20 时不同组之间基本未见差异。然而,撤出生长因子后,添加因子组细胞明显呈现形态大而扁圆的老化特征,尤其是再次培养3 代后,撤出生长因子组细胞宽度显著增大(图 4C、4D),细胞增殖速度也相应降低。

图 2 无血清培养基成分检测(A:细胞因子抗体芯片检测 SFM 1、4、5、6 中细胞因子水平,图示平均水平最高的 36 种细胞因子;B:表达水平最高的 9 种细胞因子分别在 SFM 1、4、5、6 中的表达情况;C:ELISA 测定 SFM 1、2、3、4、5 和 6 中 EGF、bFGF 和 PDGF-BB 的浓度)
Figure 2 SFM composition analysis (A: The level of 36 cytokines in SFM 1, 4, 5, and 6 semi-quantified by cytokine antibody array; B: The level of top 9 cytokines in SFMs; C: EGF, bFGF, and PDGF-BB levels in SFMs quantified by ELISA)
取添加生长因子后培养至 P15 代、P17 代、P20 代以及撤掉因子后至 P23 代的hMSCs 细胞进行转录组测序,结果显示各组细胞在添加生长因子后基因表达出现显著变化,尤其是培养到 P20 后同初始细胞相比出现完全不同的基因表达模式,撤出生长因子后基因表达模式再次发生改变,且同最初始状态 P10 代细胞存在显著差异(图 5A)。这些结果表明较高浓度生长因子长期培养 hMSCs 的基因表达模式同基础培养条件下存在显著差异,且差异不因生长因子的撤除而发生逆转。以 E/F/P 组为代表进行差异表达基因分析,结果显示同初始细胞状态相比,表达倍数改变在 2 倍以上的差异基因在 P20 和 P23 代显著增多,P20 代细胞上调、下调基因分别为 445 和 950 个,P23 代细胞分别为 406 和 1218 个(图 5B)。对 E/F/P组差异基因进行 KEGG 信号通路分析,P20 代细胞上调基因多为参与蛋白合成和丝裂原活化蛋白激酶通路相关蛋白,下调基因多为负调控细胞周期和有丝分裂的蛋白以及细胞衰老相关蛋白(图 5C);相反,P23 代细胞上调基因则多为细胞衰老和 TGF-β 信号通路相关蛋白,而下调蛋白则多为 DNA 复制和蛋白质合成的相关基因(图 5D)。基因表达信号通路分析结果与细胞增殖和衰老表现相一致。此外,还观察到肿瘤相关基因、matrix metallopeptidase 1(1)、RAS like proto-oncogene A()在添加生长因子培养至 P17 ~ P20 代时 mRNA 表达水平显著上调,特别是 E/F/P 组表达水平最高。在撤除生长因子后这些基因水平将会下降至低于对照组水平(图 5E)。
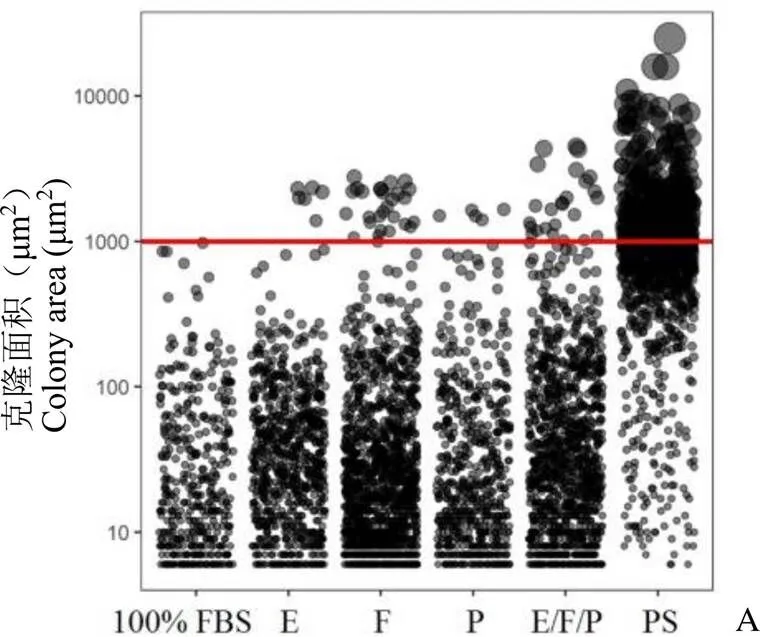
Figure 3 Cytokines could induce colony formation of hMSCs in soft agar (A: Numbers and areas of colonies formed by CCRC1-hMSCs-S1 under different conditions; B: Showed the representive colonies, scale: 500 μm)

表 2 添加生长因子 hMSCs 软琼脂克隆形成情况
3 讨论
细胞在琼脂内非锚定性生长是恶性肿瘤细胞的重要特性之一,软琼脂克隆形成试验是研究细胞恶性转化的金标准,也常常用来评价细胞恶性程度,作为抗肿瘤药物筛选指标。许多研究表明,软琼脂克隆形成能力与动物体内成瘤性具有相关性。例如,在研究肿瘤组织中存在少量侧群细胞(SP)的特性时发现,多种肿瘤细胞(卵巢癌、宫颈癌、肺癌等)的 SP 细胞软琼脂克隆形成率较非侧群细胞明显升高,且注射到免疫缺陷小鼠体内肿瘤形成率和肿瘤的大小均明显高于非侧群细胞,两者具有高度的一致性[10-12]。在对一些关键致癌基因过表达或敲除后,癌细胞软琼脂克隆阳性特性和体内成瘤性同时增强或减弱,两者也呈现一致性[13-15]。软琼脂克隆形成所反映的细胞非锚定性生长能力是与体内成瘤最相关的转化细胞特性[16],而且该试验具有检测时限短,待测细胞需要量少,符合动物福利 3R 原则,在国际及国外相关法规或指导原则中,将其作为体内成瘤性检查的补充。另外,软琼脂克隆形成试验检测灵敏度较动物体内接种法更高,有研究者将软琼脂克隆形成试验同荧光染色和图像捕捉和识别技术相结合,检测 hMSCs 中混有的 HeLa 细胞时的最低检测限(LOD)可达到 0.00001%,即单个 HeLa 细胞即可检测出[17]。相比较而言,免疫缺陷动物体内接种 HeLa 细胞,检出限通常在 104细胞/只动物,当前最灵敏的检测方法也至少需要 101个 HeLa 细胞[18]。这些特点使得软琼脂克隆形成试验特别适用于细胞治疗类产品的成瘤性检查[19-22]。本研究发现,可促使软琼脂克隆形成阳性的无血清培养基培养的 hMSCs 进行裸鼠体内接种法检查,在接种部位未观察到结节,这表明此条件下(一般为培养 5 ~ 10 代)细胞发生转化程度未达到体内成瘤,但已到达软琼脂克隆形成检测的灵敏度范围,提示具有成瘤性风险。
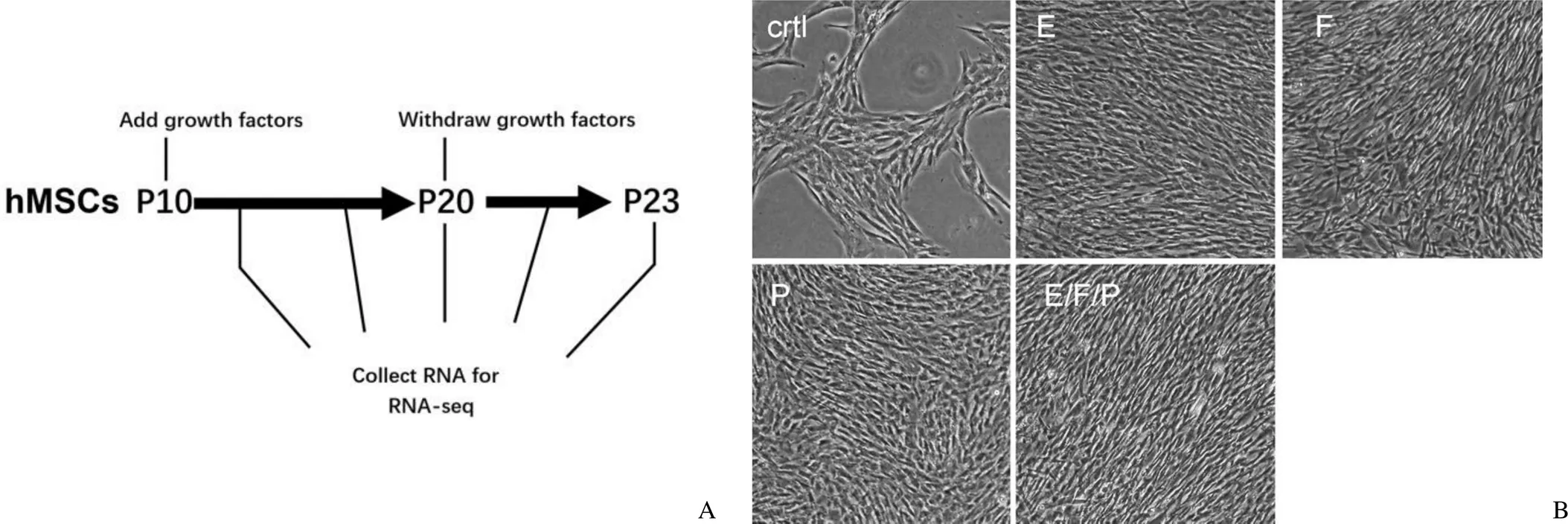
Figure 4 Morphologic changes of hMSCs after growth factors treatment [A: Schematic illustrating of the experiment. HMSCs before P10 were grown in complete culture medium containing 10% FBS. From P10 to P20, the cells were treated with 50 ng/ml of EGF, 50 ng/ml of bFGF, 10 ng/ml of PDGF-BB, and then were passaged to P23 with complete cultrue medium. The cells of P10, P15, P17, P20 and P23 were collected for RNA-Seq; B: Morphologic changes of hMSCs in treatment of growth factors (ctl: control; E: EGF; F: bFGF; P: PDGF-BB); C: Cell width of hMSCs with different treatments; D: The representive figure of hMSCs (ctl vs E/F/P)]
含 FBS 的培养基是 hMSCs 前期研究中最常用的培养基,hMSCs 的大多数生物学特性包括低成瘤性风险的资料大都是在此培养条件下得到的。在 hMSCs 临床转化或药物开发过程中,国内外监管部门基于安全性考虑建议尽可能替换掉动物源性原材料,改为更加安全的成分明确的培养基。在这一原则下,许多国内干细胞研发机构在进行培养基的更新选择。但本研究结果明确了某些无血清培养基促使 hMSCs 出现软琼脂克隆形成阳性,培养基中添加的 bFGF、EGF和 PDGF-BB 三种生长因子可以促使原本不具有锚定非依赖性生长能力的 hMSCs 获得此能力。此外,高浓度生长因子长期培养的 hMSCs 生长特性和基因转录组会发生显著变化。同时,从本研究也明确提示,无血清培养基成分选择和配比对细胞生物学特性有非常大的影响,选择无血清培养基时不仅要考察细胞的增殖、老化、凋亡等活性因素,促使分化、免疫调控等干性和生物学有效性因素,同样要关注细胞成瘤性风险。
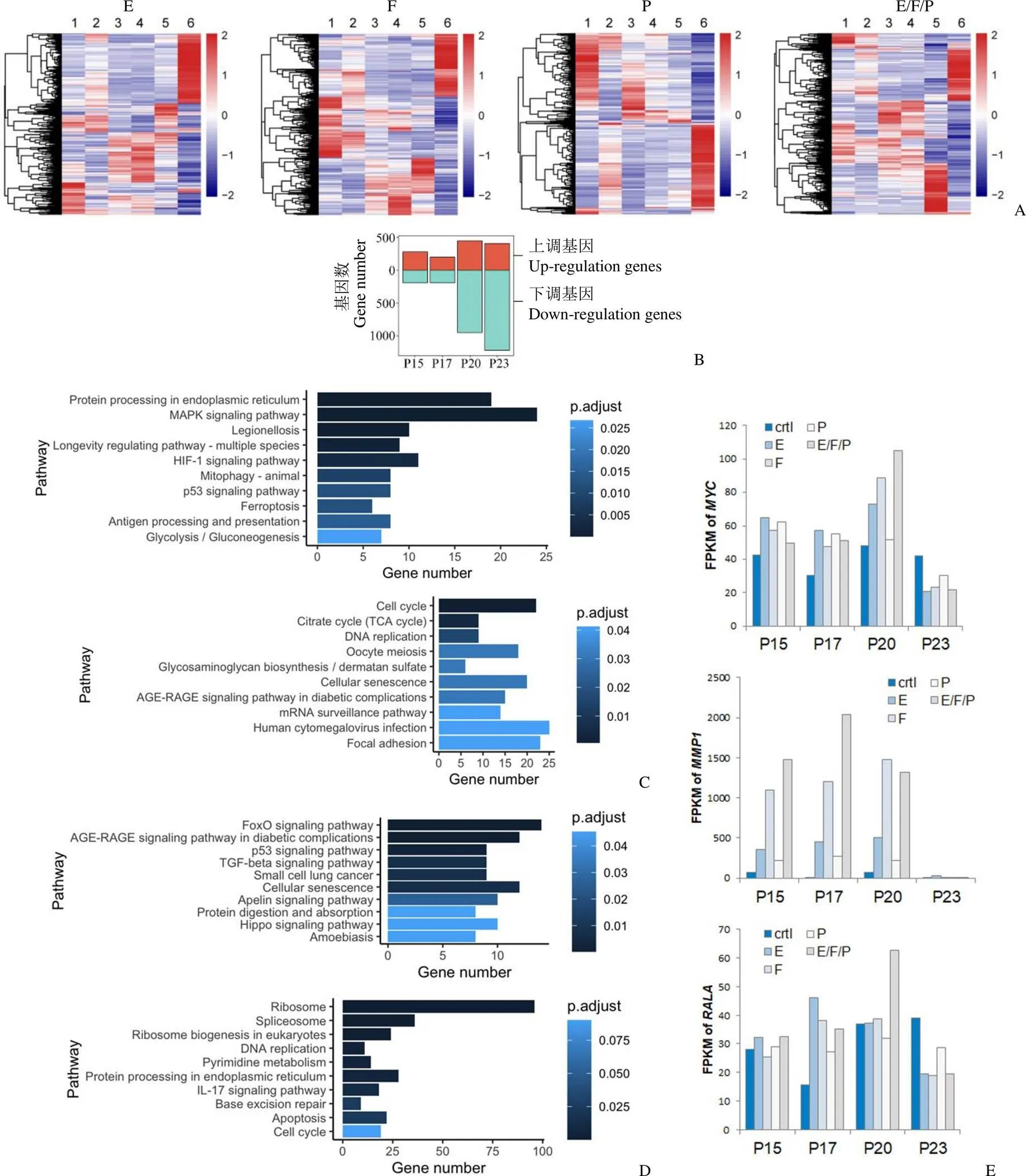
图 5 生长因子长期处理hMSCs 转录组分析[A:转录组测序热图分析,1 ~ 5 分别为图 4A 所示 P10、P15、P17、P20 和P23 代细胞,6 为未添加生长因子从 P10 传代至 P23 代细胞;B:E/F/P 组各代次细胞同P10 代细胞相比,差异表达基因数量,其中FoldChange > 2 视为上调基因,FoldChange < 0.5 视为下调基因;C ~ D:E/F/P 组P20 代细胞(C)以及 P23 代细胞(D)与初始P10 代细胞差异基因的KEGG 通路分析,上图为上调基因,下图为下调基因;E:Myc、MMP1 和RALA基因在各组表达情况]
Figure 5 RNA-seq analysis of hMSCs treated with grow factors [A: Heat map analysis of gene expression of hMSCs. 1 - 5: P10, P15, P17, P20 and P23 cells as described in Fig4 A; 6: control P23 cells which were expanded from P10 without any additional grow factors during the whole procedure of culture; B: Numbers of differentally expressed gene between P10 and other passages in hMSCs treated with E/F/P. Genes with Foldchange > 2 were regarded as up-regulated genes, and those with Foldchange < 0.5 were regarded as down-regulated gene; C - D: KEGG pathway analysis of gene expression of hMSCs between P10 and P20 (C), or P10 and P23 (D); Upper: up-regulated genes; bottom: down-regulated genes; E: Gene expression levels (FPKM values) of,1, andin different groups of cells as indicated in figure]
据报道,bFGF、PDGF 均可促使二倍体成纤维细胞发生锚定非依赖性生长[23-25],其中 PDGF-D 甚至促使 NIH3T3 成纤维细胞发生显著恶性转化,不仅软琼脂克隆阳性,且在裸鼠体内成瘤[24, 26-28]。EGF 和 TGF-β 组合也具有相似的作用[26]。细胞生长因子通过细胞表面受体激活受体酪氨酸激酶,进而激活 MAPK-PI3K-Akt 通路、STAT 家族、Src 家族酪氨酸激酶,磷脂酶 C-γ、SHP-2 酪氨酸磷酸酶通路等向细胞传递促进增殖、存活和迁移的信号。生长因子信号通路过度激活与肿瘤发生密切相关。不仅如此,FGF、EGF、PDGF 以及TGF-β 等有细胞转化作用的生长因子胞内信号通路之间存在一定程度的交叉和协同促进作用,多种生长因子的组合会使细胞转化的风险大大增加。本研究中也发现添加 EGF、bFGF和 PDGF-BB 培养 hMSCs7 代以后肿瘤相关基因、1和表达水平均有显著升高,高于单独添加其中一种生长因子组。EGF、bFGF 和 PDGF-BB 长期培养除了增加 hMSCs 成瘤性风险以外,结果还表明会对细胞增殖产生极大影响。表现为在完全培养基中添加生长因子高度促进细胞增殖,细胞形态发生高速增殖相应的变化,如细胞变小,更细长,折光明显;然而撤掉生长因子后细胞明显出现增殖缓慢,甚至生长停滞。推测其原因一方面是由于生长因子促进细胞增殖,细胞的群体倍增时间缩短,细胞形态变小,会导致同样传代至 P20 代,实际扩增倍数(实际代次)远高于未添加生长因子组,因此撤掉生长因子后细胞老化程度更加明显。另一方面,生长因子持续处理导致细胞本身逐渐适应高水平生长因子环境,基因表达也发生了改变,撤掉生长因子后则不能适应低生长因子环境。在临床应用细胞治疗时,此类 hMSCs 进入人体后将会由高浓度生长因子环境改变为体内环境,其体内增殖、老化和生物学活性需要进一步研究和阐明。
本研究中所用到的标准细胞株 CCRC1-hMSCs-S1 为一株符合 MSC 质量标准、各质量属性均具代表性的脐带组织来源 MSC,在含 FBS 的培养条件下可传代至 30 代后出现衰老特征,稳定性检测表明在 20 代之前细胞活性、生物学有效性等质量属性均稳定,具有较好的代表性。临床应用 hMSCs 代次常在 P5 代之前,生长特性和成瘤性特性可能存在不同,需要进一步阐明。综上所述,hMSCs 类细胞治疗产品在工艺研发中,需高度关注培养基关键成分对hMSCs 特性的影响,特别是对于 EGF、bFGF 和 PDGF 这类能促进成瘤性的细胞因子,对其添加量、组合配比进行详细研究,对细胞成瘤性、活性以及生物学有效性等方面综合考察,选择适宜的培养基。
[1] Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adult human mesenchymal stem cells. Science, 1999, 284(5411): 143-147.
[2] Parekkadan B, Milwid JM. Mesenchymal stem cells as therapeutics. Annu Rev Biomed Eng, 2010, 12:87-117.
[3] Zhang KH, Na T, Han XY, et al. Immunomodulatory properties-based strategy for the assessment of biological effectiveness of mesenchymaistem cells. Chin J New Drugs, 2016, 25(3):283-290. (in Chinese)
张可华, 纳涛, 韩晓燕, 等. 基于免疫调控功能的间充质干细胞生物学有效性质量评价策略. 中国新药杂志, 2016, 25(3):283-290.
[4] Wang Y, Chen X, Cao W, et al. Plasticity of mesenchymal stem cells in immunomodulation: pathological and therapeutic implications. Nat Immunol, 2014, 15(11):1009-1016.
[5] Alfaifi M, Eom YW, Newsome PN, et al. Mesenchymal stromal cell therapy for liver diseases. J Hepatol, 2018, 68(6):1272-1285.
[6] Moreira A, Kahlenberg S, Hornsby P. Therapeutic potential of mesenchymal stem cells for diabetes. J Mol Endocrinol, 2017, 59(3): R109-R120.
[7] Volkman R, Offen D. Concise review: mesenchymal stem cells in neurodegenerative diseases. Stem Cells, 2017, 35(8):1867-1880.
[8] Sato Y, Bando H, Di Piazza M, et al. Tumorigenicity assessment of cell therapy products: The need for global consensus and points to consider. Cytotherapy, 2019, 21(11):1095-1111.
[9] Zhang KH, Na T, Han XY, et al. Establishment of a reference cell line, CCRC-hMSC-S1, for the evaluation of biological effectiveness of human mesenchymal stem cells. Chin J New Drugs, 2020, 29(21): 2502-2510. (in Chinese)
张可华, 纳涛, 韩晓燕, 等. 人间充质干细胞生物学有效性质量评价用标准细胞株CCRC-hMSC-S1的建立及评价. 中国新药杂志, 2020, 29(21):2502-2510.
[10] Wei Z, Lv S, Wang Y, et al. Biological characteristics of side population cells in a self-established human ovarian cancer cell line. Oncol Lett, 2016, 12(1):41-48.
[11] Wei ZT, Yu XW, He JX, et al. Characteristics of primary side population cervical cancer cells. Oncol Lett, 2017, 14(3):3536-3544.
[12] Xie T, Mo L, Li L, et al. Identification of side population cells in human lung adenocarcinoma A549 cell line and elucidation of the underlying roles in lung cancer. Oncol Lett, 2018, 15(4):4900-4906.
[13] Zhou CF, Ji J, Cai Q. MTA2 enhances colony formation and tumor growth of gastric cancer cells through IL-11. BMC Cancer, 2015, 15:343.
[14] Lennartsson J, Ma H, Wardega P, et al. The Fer tyrosine kinase is important for platelet-derived growth factor-BB-induced signal transducer and activator of transcription 3(STAT3) protein phosphorylation, colony formation in soft agar, and tumor growth in vivo. J Biol Chem, 2013, 288(22):15736-15744.
[15] Lombardi APG, Cavalheiro RP, Porto CS, et al. Estrogen receptor signaling pathways involved in invasion and colony formation of androgen-independent prostate cancer cells PC-3. Int J Mol Sci, 2021, 22(3):1153-1168.
[16] Shin SI, Freedman VH, Risser R, et al. Tumorigenicity of virus-transformed cells in nude mice is correlated specifically with anchorage independent growth in vitro. Proc Natl Acad Sci U S A, 1975, 72(11):4435-4439.
[17] Kusakawa S, Yasuda S, Kuroda T, et al. Ultra-sensitive detection of tumorigenic cellular impurities in human cell-processed therapeutic products by digital analysis of soft agar colony formation. Sci Rep, 2015, 5:17892.
[18] Kanemura H, Go MJ, Shikamura M, et al. Tumorigenicity studies of induced pluripotent stem cell (iPSC)-derived retinal pigment epithelium (RPE) for the treatment of age-related macular degeneration. PLoS One, 2014, 9(1):e85336.
[19] Yin Z, Wang Q, Li Y, et al. A novel method for banking stem cells from human exfoliated deciduous teeth: lentiviral TERT immortalization and phenotypical analysis. Stem Cell Res Ther, 2016, 7:50.
[20] Kuroda T, Yasuda S, Kusakawa S, et al. Highly sensitive in vitro methods for detection of residual undifferentiated cells in retinal pigment epithelial cells derived from human iPS cells. PLoS One, 2012, 7(5):e37342.
[21] Qin SQ, Kusuma GD, Al-Sowayan B, et al. Establishment and characterization of fetal and maternal mesenchymal stem/stromal cell lines from the human term placenta. Placenta, 2016, 39:134-146.
[22] Matheni C, Dsouza W. Xeno-free human Wharton's Jelly mesenchymal stromal cells maintain their characteristic properties after long-term cryopreservation. Cell J, 2021, 23(2):145-153.
[23] Wieder R, Wang H, Shirke S, et al. Low level expression of basic FGF upregulates Bcl-2 and delays apoptosis,but high intracellular levels are required to induce transformation in NIH 3T3 cells. Growth Factors, 1997, 15(1):41-60.
[24] Li H, Fredriksson L, Li X, et al. PDGF-D is a potent transforming and angiogenic growth factor. Oncogene, 2003, 22(10):1501-1510.
[25] Kwan RW, Wong RW, Chan SY. Expression of full length or truncated epidermal growth factor precursor transforms NIH3T3 fibroblasts. Int J Oncol, 1999, 15(2):281-284.
[26] Palmer H, Maher VM, McCormick JJ. Platelet-derived growth factor or basic fibroblast growth factor induce anchorage-independent growth of human fibroblasts. J Cell Physiol, 1988, 137(3):588-592.
[27] Kim HR, Upadhyay S, Korsmeyer S, et al. Platelet-derived growth factor (PDGF) B and A homodimers transform murine fibroblasts depending on the genetic background of the cell. J Biol Chem, 1994, 269(48):30604-30608.
[28] Forough R, Xi Z, MacPhee M, et al. Differential transforming abilities of non-secreted and secreted forms of human fibroblast growth factor-1. J Biol Chem, 1993, 268(4):2960-2968.
Growth factors in a culture medium may enhance tumorigenic potency of human mesenchymal stem cells
ZHANG Ke-hua, JIA Chun-cui, WU Xue-ling, NA Tao, HAN Xiao-yan, WU Ting-ting, MENG Shu-fang
Cell Collection and Research Center, Institutes for Biological Products Control, National Institutes for Food and Drug Control, Beijing 100050, China
In the third-party review of human mesenchymal stem cells (hMSCs), some serum-free mediums were found to promote colony formation of hMSCs in soft agar gels. In order to further clarify this phenomenon, this study was conducted to explore the components of the medium that led to the positive cloning of hMSCs soft agar and to further analyze their risks.Colony formation abilities were compared between hMSCs grown under different brands of commercial serum-free medium. The components of these culture media that promoted the colony formation of cells were screened and determined by cytokine antibody chip assay and ELISA. Tumor promotion ability of these components was further confirmed by adding these specific components to the medium. Long term effects of these components on the growth and gene transcription of hMSCs were further clarified through culturing cells for a long period with those gradients.This study confirmed that some brands of serum-free medium could promote the colony formation of hMSCs in soft agar. The data from medium composition analysis showed the high levels of epidermal growth factor (EGF), basic fibroblast growth factor (bFGF) and platelet-derived growth factor (PDGF-BB) in these media. Adding EGF (50 ng/ml), bFGF (50 ng/ml) and PDGF-BB(10 ng/ml) to the complete medium containing 10% FBS could induce the colony formation of hMSCs in soft agar. The proliferation and gene transcription of hMSCs were significantly changed after 10 passages of culture with the above concentration of growth factors and additional 3 passages of culture without these growth factors.High concentration of growth factors, such asEGF, bFGF, and PDGF-BB, in cell culture medium can enhance the tumorigenicity risk of hMSCs. Long term culture of hMSCs with these growth factors can cause significant effects on cell proliferation and gene expression profiles. This study suggests that the researchers and developers of hMSCs products should pay close attention in the critical components in cell culture media and analyze their effects on tumorigenicityduring the development of hMSCs products.
mesenchymal stem cells; tumorigenicity; epithelial growth factors; fibroblast growth factor; platelet-derived growth factor; soft agar colony formation
MENG Shu-fang, Email: mengsf@nifdc.org.cn
10.3969/j.issn.1673-713X.2021.06.001
中国科学院战略性先导科技专项(XDA16040502);中国药品监管科学行动计划细胞和基因治疗产品技术评价与监管体系研究
孟淑芳,Email:mengsf@nifdc.org.cn
2021-05-24

