微生物来源的PCSK9转录抑制剂的发现及活性研究
何维,杨雨欣,李怡宏,李晓茜,李星星,侍媛媛,孙红敏,王丽,解云英,洪斌
·论著·
微生物来源的PCSK9转录抑制剂的发现及活性研究
何维*,杨雨欣*,李怡宏,李晓茜,李星星,侍媛媛,孙红敏,王丽,解云英,洪斌
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所卫健委抗生素生物工程重点实验室(何维、杨雨欣、李怡宏、李星星、侍媛媛、孙红敏、王丽、洪斌),医科院药物合成生物学重点实验室(李怡宏、李晓茜、李星星、侍媛媛、孙红敏、解云英、洪斌)
拟通过筛选寻找具有 PCSK9 表达抑制活性的菌株发酵液及其活性组分,通过对其活性进行初步研究,以期获得能够用于治疗或预防动脉粥样硬化的先导化合物或药物候选物。利用前期工作构建的 PCSK9 转录抑制剂高通量筛选模型对国家新药(微生物)筛选中心发酵液样品库进行筛选,对阳性发酵液进行分离提取以获得具有 PCSK9 表达抑制活性的小分子化合物,利用蛋白免疫印迹方法检测化合物对相关蛋白表达的影响,利用流式细胞术检测肝细胞摄取 LDL-C 情况的变化。获得阳性菌株 I03A-00300 及其活性组分杀粉蝶菌素 A1。杀粉蝶菌素 A1在低浓度时即可显著抑制 HepG2 细胞中 PCSK9 的表达,进而增加LDLR 的表达。还可以促进 LDLR 介导的肝细胞对 LDL-C 的摄取功能增加约一倍。杀粉蝶菌素 A1 作为 PCSK9 抑制剂,在细胞水平证实可上调 PCSK9 调控的下游基因 LDLR 的表达及其介导的 LDL 胆固醇的摄取作用,证明该化合物有望发展为新型抗动脉粥样硬化先导化合物。
动脉粥样硬化; PCSK9; 高通量筛选; 低密度脂蛋白胆固醇; 杀粉蝶菌素 A1
心血管疾病(cardiovascular disease,CVD)是全世界人类健康的主要威胁之一,其中低密度脂蛋白胆固醇(LDL-C)是动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)发展的重要危险因素之一[1]。因此,降低 LDL-C 的水平对于治疗心血管疾病具有重要意义。PCSK9 是 2003 年被发现并被证明为心血管疾病的第三个易感基因[2-3],它可以通过调节肝脏 LDLR 的降解来调控 LDL-C 的水平,抑制 PCSK9 可以有效地降低 LDL-C 的水平[4-5]。目前已成功上市的 PCSK9 抑制剂是两种单克隆抗体,分别是 alirocumab(Praluent®)和 evolocumab(Repatha®),临床数据表明这两个单克隆抗体均可以有效地降低心血管疾病的发生率[6]。除此之外,Alnylam/The Medicines Company 研发的干扰肝脏中 PCSK9 合成的 siRNA 药物 inclisiran(Leqvio®)于 2020 年 12 月在欧盟获得批准[7]。虽然 PCSK9 单克隆抗体或 siRNA 药物具有良好的疗效,但是也存在着价格昂贵、储存运输不便、给药方式限制等问题。小分子药物具有易合成、价格低、给药方式便捷等优势,因此寻找 PCSK9 小分子抑制剂成为研究热点。
微生物是天然产物的重要来源。在这些天然产物中已经发现了许多具有药物活性的小分子化合物。据统计,自从 1928 年青霉素发现以来,人们已经鉴定出了超过 2.3 万个微生物来源的天然产物,其中大部分是由细菌特别是放线菌产生的[8]。同样,治疗心血管疾病的他汀类药物也是发现于真菌[9]。近年来很多国家和研究机构开始建立微生物粗提品库,并利用新型筛选模型对其进行大规模筛选,以期发现具有新活性、新结构的天然产物。与化合物库及其他筛选文库相比,微生物粗提品库的生产成本较低,并且富含多种天然产物,为新结构、新活性天然产物药物的发现提供了更大的可能性。本研究所国家新药(微生物)筛选发酵液粗提品库,目前已拥有 76 000 个菌株的发酵液粗提品样品,且样品来源广泛,为大规模筛选提供了保障。
本研究利用本课题组前期成功构建的 PCSK9 转录抑制剂的高通量筛选模型对本所国家新药(微生物)筛选中心发酵液粗提品库进行高通量筛选,以期获得可以抑制 PCSK9 表达的发酵液样品,对相应菌株进行重新发酵及活性确证后找到活性较好且可稳定培养与发酵的阳性菌株,对其发酵液以活性为导向,进行一系列的分离提取、结构鉴定,最终找到具有 PCSK9 表达抑制活性的小分子化合物杀粉蝶菌素 A1,其在细胞水平显著影响 PCSK9 基因的表达及其介导的功能,有望发展为治疗抗动脉粥样硬化的先导化合物。
1 材料与方法
1.1 材料
1.1.1 实验材料 重组报告基因质粒 pGL4-PCSK9-D1/D2/D3/D4/D5/D6/D7 及人肝癌细胞 HepG2、pGL4-PCSK9-P HepG2 细胞株均为本室保存[10];MEM培养基、胎牛血清、0.25% 胰酶均购自美国 Gibco 公司;MTT 溶液购自北京索莱宝科技有限公司;萤火虫荧光素酶试剂盒购自美国 Promega 公司;10 × 蛋白电泳转移缓冲液、10 × 封闭-洗涤缓冲液(TBST)购自北京普利莱基因技术有限公司;增强型 HRP 底物(ECL 发光液)购自美国 Millipore 公司;人血浆低密度脂蛋白(DiI-LDL)DiI-labeled 购自 ADI Alpha Diagnostic International 公司。
1.1.2 仪器 EPS 301 电泳仪为美国 Amersham Biosciences 公司产品;Gel Doc XR 凝胶成像系统为美国 Bio-Rad 公司产品;VICTOR X5 多标记微孔板检测仪为美国 PerkinElmer 公司产品;HERAcell 150 CO2培养箱为美国 Thermo Scientific 公司产品;CKX41 倒置显微镜为日本 Olympus 公司产品;NovoCyte 流式细胞仪为美国 ACEA Biosciences 公司产品;LC-20AD 高效液相色谱仪为日本 Shimadzu 公司产品。
1.2 方法
1.2.1 发酵液样品的筛选 将国家新药(微生物)筛选中心发酵液样品用 100% DMSO 稀释 5 倍作为待筛样品。筛选使用 96 孔板,PCSK9 表达抑制剂筛选模型细胞(pGL4-PCSK9-P HepG2 细胞)密度为 6 × 106个/ml,每孔 100 μl 铺板,培养 24 h 后替换为无血清培养基,每孔 200 μl,每孔加入待测样品 1 μl,继续培养 24 h 后进行细胞荧光素酶活性检测。
1.2.2 化合物分离纯化和鉴定 将菌株 I03A-00300 的斜面培养物接种于种子培养基 ISP2(酵母浸粉 0.4%,麦芽浸粉 1%,葡萄糖 0.4%,琼脂 1.5%,去离子水 1000 ml)中得种子培养物,以 5% ~ 10% 接种量转接于 A1 发酵培养基(葡萄糖 0.5%,麦芽膏 1%,棉籽饼粉 1%,可溶性淀粉 2%,酵母膏 0.5%,K2HPO40.05%,CaCO30.3%,NaCl 0.1%,自来水 1000 ml)28 ℃、220 r/min,培养 5 d,获得菌株发酵液样品。将发酵液离心后得到上清液和菌丝体部分,上清液上大孔树脂柱,依次用去离子水、30% 丙酮、100% 丙酮洗脱得 P1 组分;菌体部分使用丙酮萃取,旋转蒸发浓缩后,粗品复溶于 90% 甲醇水溶液中,用石油醚进行萃取,保留石油醚部分,真空浓缩后得菌丝体提取物 P2。合并 P1 和 P2 部分,复溶于 80% 甲醇水溶液中,采用半制备 HPLC 纯化各组分,按峰收集制备,真空浓缩干燥得不同组分后溶于氘代 DMSO 制成为待检测样品。经高分辨质谱(HRESI-MS)及核磁共振(NMR)分析,确证化合物结构。
1.2.3 化合物毒性实验 将处于对数生长期的 HepG2 细胞,经漂洗、消化吹打成单细胞悬液后按照 5 × 105个/ml 密度接种 96 孔板中,培养24 h 后加入无血清 MEM 培养基倍比稀释后的待测样品,并设置空白对照,继续培养 24 h;每孔加入 10 μl 的 0.5% MTT 溶液,MTT 的终浓度为 0.5 mg/ml,继续孵育 4 h,PBS 漂洗后每孔加入 100 μl 的 DMSO,确定结晶物都已溶解后,在570 nm 波长处检测吸光值,计算细胞存活率。细胞存活率(%)=(加药组光吸收值/对照组光吸收值)× 100%。
1.2.4 蛋白免疫印迹 将 HepG2 细胞接种于12 孔板中培养 24 h,加入含待测化合物的无血清 MEM 培养基,同时设立空白对照,继续培养 24 h;用 RIPA 裂解液裂解细胞,裂解后的蛋白样品用 10% SDS-聚丙烯酰胺凝胶分离电泳(PAGE),然后电印迹在 0.45 μm PVDF 膜上,PVDF 膜与抗 PCSK9、LDLR 或 GAPDH 的一抗 4 ℃孵育过夜,TBST 冲洗后,与辣根过氧化物酶(HRP)结合的二抗在室温下孵育 1 h,加入 HRP 底物发光液 ECL 进行检测。
1.2.5 流式细胞术 将 HepG2 细胞以 8 ×105个/ml 的密度接种于 12 孔板中,放入细胞培养箱中过夜;移除旧培养基,加入含待测化合物的无血清 MEM 培养基,同时设立空白对照,继续培养24 h;加入无血清培养基稀释的 2 μg/ml DiI-LDL,避光孵育 4 h,移去培养基,用预冷的 PBS 漂洗后,加入胰酶消化并加入含血清的培养基吹打成单细胞悬液,1000 r/min 离心 3 min,用 PBS 重悬细胞并经 300 目网筛过滤,用流式细胞仪进行检测。
1.2.6 细胞瞬时转染 将细胞按 3 × 104个/孔接种于 96 孔板中,放入培养箱中。过夜后按照每孔 100 ng 质粒加入 5 μl opti-MEM 培养基及 0.2 μl 的 P3000 试剂中,同时用 5 μl opti-MEM 培养基稀释 0.3 μl 转染试剂 lipo 3000,然后将两种混合液混匀后室温孵育 10 ~ 15 min。吸除板中的旧培养基,每孔加入 100 μl 转染混合溶液。孵育 6 h 后,加入不同浓度的杀粉蝶菌素 A1 后放入培养箱中,24 h 后测定荧光素酶活性。
1.3 统计学处理

2 结果
2.1 PCSK9 基因表达抑制剂杀粉蝶菌素 A1 的发现及初步评价
本工作对国家新药(微生物)筛选中心发酵液粗提品库共计 12 560 样次的发酵液粗提品进行初步筛选,使用萤火虫荧光素酶检测系统,以抑制率 > 50% 设置为初筛阳性。筛选结果如图 1A 所示,初筛共获得 350 个阳性发酵液样品,阳性率为 2.8%,通过对阳性发酵液进行重新检测、稀释、相应菌株重新发酵再检测后,最终获得 6 株活性较好且可以重复的阳性菌株。我们对其中活性最好的 I03A-00300 在 PCSK9 表达抑制剂筛选模型上进行了进一步量效分析,结果如图 1B 所示,其发酵液可显著下调 PCSK9 的表达活性。以 PCSK9 基因表达抑制活性为导向,对菌株 I03A-00300 进行扩大发酵与分离提取及结构鉴定,最终确定活性菌株 I03A-00300 的发酵液中具有 PCSK9 表达抑制活性的小分子化合物杀粉蝶菌素 A1(图 1C)。
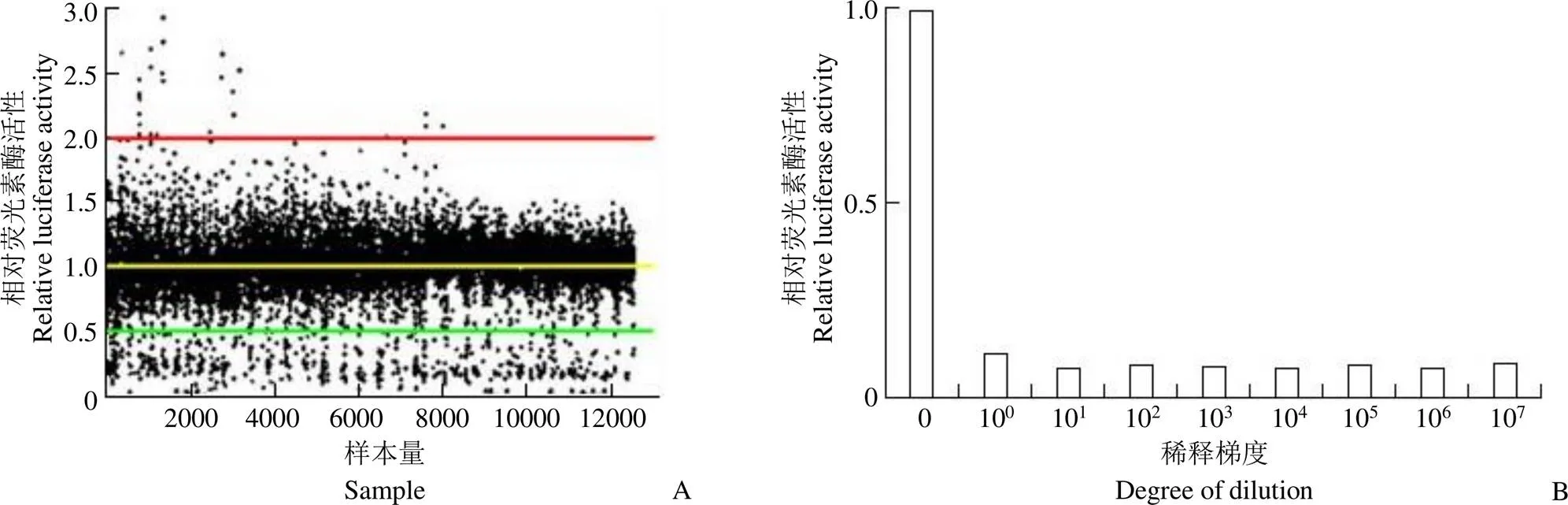
Figure 1 Discovery of strains with PCSK9 inhibitory activity and the isolation, extraction and identification of active components [A: Screening results of crude extracts from fermentation broth by PCSK9 transcriptional inhibitor screening assay; B: The dose-effect of positive fermentation broth I03A-00300 on the PCSK9 transcriptional inhibitor screening assay; C: HPLC chromatogram of fermentation broth I03A-00300 and effects of each component on the protein levels of PCSK9 and LDLR in HepG2 cells (F4 was confirmed to be piericidin A1 by structural identification) ]
对活性组分杀粉蝶菌素 A1 的量效关系进行检测,将杀粉蝶菌素 A1 以 10 倍比梯度稀释后作用于 PCSK9 表达抑制剂筛选模型上,荧光素酶活性检测结果显示,杀粉蝶菌素 A1 可剂量依赖地抑制 PCSK9 转录活性,量效关系曲线如图 2A 所示,经计算其 IC50为 2.98 nmol/L。为检测化合物的细胞毒性,利用 MTT 法检测杀粉蝶菌素 A1 在不同浓度下对 HepG2 细胞存活和生长的影响。结果显示,在浓度 0 ~ 40 μg/ml(0 ~ 100 μmol/L)之间时,细胞存活率均为对照组的 90% 以上,即对细胞的生长存活几乎没有影响(图2B)。
2.2 化合物杀粉蝶菌素 A1 对 HepG2 细胞中 PCSK9 及 LDLR 蛋白水平的影响
利用 PCSK9 转录抑制剂高通量筛选模型获得的微生物来源的活性化合物杀粉蝶菌素 A1,前期结果表明可剂量依赖性地抑制 PCSK9 启动子活性,因此为了进一步验证其是否影响 PCSK9 基因的表达,我们检测了 HepG2 细胞中 PCSK9 的蛋白的表达水平。首先将不同浓度的杀粉蝶菌素 A1 与 HepG2 细胞共同孵育 24 h,随后提取细胞总蛋白进行 Western blot 实验分析。结果显示,杀粉蝶菌素 A1 可以显著抑制 HepG2 细胞中 PCSK9 蛋白表达(图 3A)。
PCSK9 可以与肝细胞表面的 LDLR 中表皮生长因子 A(EGF-A)样结构域特异性结合并形成 PCSK9/LDLR 复合物,介导其进入溶酶体降解,导致细胞表面的 LDLR 减少,进而减少 LDL-C 的摄取[4]。因此我们进而检测了杀粉蝶菌素 A1 对 HepG2 细胞中 LDLR 蛋白水平的影响。结果显示,杀粉蝶菌素 A1 可以显著上调 LDLR 蛋白表达,且呈剂量依赖性(图 3B)。
2.3 化合物杀粉蝶菌素 A1 对 HepG2 细胞摄取 LDL-C 的影响
LDL-C 是一种运载胆固醇进入外周组织细胞的脂蛋白颗粒,当 LDL-C 过量时,它携带的胆固醇便积存在动脉壁上,促使动脉粥样硬化的产生和发展。LDLR 可以与 LDL-C结合,介导 LDL 被细胞内吞,循环中 70% 的 LDL 在肝脏被摄取并代谢掉。
DiI 全称为1,1'-双十八烷基-3,3,3',3'-四甲基吲哚羰基花青高氯酸盐,是最常用的细胞膜荧光探针之一,进入细胞膜后可以侧向扩散逐渐使整个细胞膜被染色,当与细胞膜结合后其荧光强度大大增强,被激发后可以发出橙红色的荧光。荧光标记的人源低密度脂蛋白(human DiI-LDL)是标记荧光探针 DiI 的 LDL,可用来评估细胞 LDLR 摄取LDL-C 的能力。因此我们利用 DiI-LDL 检测杀粉蝶菌素 A1对HepG2 细胞摄取 LDL-C 的影响,验证其对 LDLR 介导的肝细胞摄取 LDL-C 功能的影响。将不同浓度的杀粉蝶菌素 A1 作用 HepG2 细胞 24 h 后,加入 DiI-LDL 孵育 4 h,流式细胞术检测摄取情况。结果显示,与对照组相比,不同浓度的杀粉蝶菌素 A1 可以不同程度地增加 HepG2 细胞摄取 LDL 的能力,当杀粉蝶菌素 A1 作用浓度为 1 μmol/L时,肝细胞 HepG2 对 DiI-LDL 摄取能力为对照的 2.1 倍(图 4)。
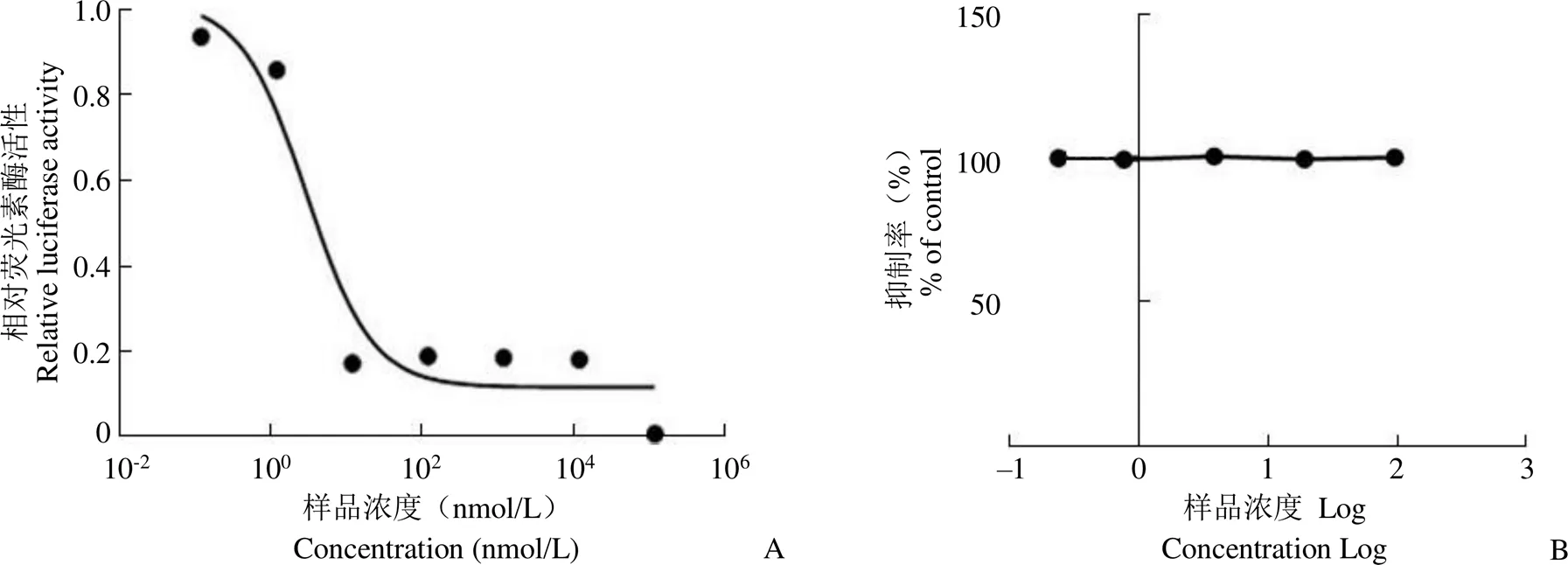
图 2 化合物杀粉蝶菌素 A1 的初步活性验证(A:在 PCSK9 表达抑制剂筛选模型上的量效关系曲线;B:在 HepG2 细胞上的细胞毒性检测)
Figure 2 Preliminary evaluation of piericidin A1 (A: The dose-effective curve of piericidin A1 on the PCSK9 transcriptional inhibitor screening assay; B: Effects of piericidin A1 on cell proliferation and cytotoxicity)

图 3 化合物杀粉蝶菌素 A1 对 HepG2 细胞 PCSK9(A)及 LDLR(B)蛋白水平的影响
Figure 3 Effects of piericidin A1 on PCSK9 (A) and LDLR (B) protein levels in HepG2 cells
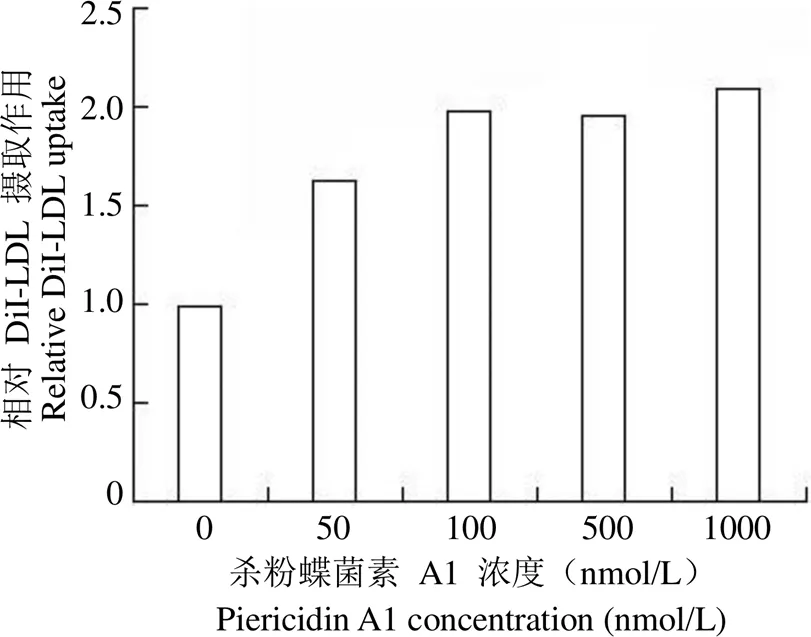
图 4 化合物杀粉蝶菌素A1 对HepG2 细胞摄取DiI-LDL 的影响
Figure 4 Effects of the piericidin A1 on DiI-LDL uptake in HepG2 cells
2.4 杀粉蝶菌素 A1通过转录因子 HNF1α 和 HINFP 调节 PCSK9 的表达
为了研究杀粉蝶菌素 A1 介导 PCSK9 转录抑制的机制,我们采用前期构建的含有人 PCSK9 基因不同缺失启动子区(D1 ~ D7,图 5A)的荧光素酶报告质粒分别转染 HepG2 细胞,进而加入杀粉蝶菌素 A1 共孵育后检测荧光素酶活性,以分析其对不同区段 PCSK9 启动子转录活性的影响。结果显示,D1 ~ D5 的荧光素酶活性在杀粉蝶菌素 A1 作用后显著降低,在缺失–392 ~–351 bp 之间的序列后,该抑制作用被抵消,说明该段区域均对杀粉蝶菌素 A1 介导的 PCSK9 转录抑制活性发挥了重要调控作用(D5 vs. D6,图 5B)。而以该段序列为结合位点的转录因子主要包括 HNF1α、HINFP。综上结果表明杀粉蝶菌素 A1可能通过作用于HNF1α、HINFP 等转录因子,从而介导了 PCSK9 的表达下调以及随后 LDLR 表达的上调、肝细胞对 LDL-C 摄取的增加。
3 讨论
由于 PCSK9 蛋白表面没有天然的结合口袋,PCSK9 和 LDLR 结合结构域(EGFA 结构域)均由平坦、无特征的表面组成,在大的表面积上表现出疏水相互作用,小分子很难与其结合[11],因此开发抑制 PCSK9 与 LDLR 相互作用的小分子药物非常困难[12]。近年来,有更多的研究转向 PCSK9基因转录与表达途径的小分子抑制剂的发现上。一些天然产物,如小檗碱(berberine,BBR)[13]、丹参酮 IIA[14]等已被发现可降低 PCSK9 的转录和表达,但由于它们广泛的调节作用,尚未开发为 PCSK9 抑制剂。Pfizer 公司通过高通量筛选找到了 R-IMPP,其可以靶向人 80S 核糖体,进而抑制 PCSK9 蛋白合成[15],但由于它的药代动力学性质不尽人意,已停止开发。除此之外,近年有研究通过寻找对 PCSK9 有高度亲和力的小分子,制备与其配合使用的异双功能分子,作为 PCSK9 的高亲和力配体,与多种泛素-蛋白酶体系统(UPS)募集元件连接,从而促进 PCSK9 的降解[16]。本工作利用实验室前期构建的 PCSK9 转录抑制剂筛选细胞模型,以期筛选到作用于 PCSK9 转录水平的小分子抑制剂。
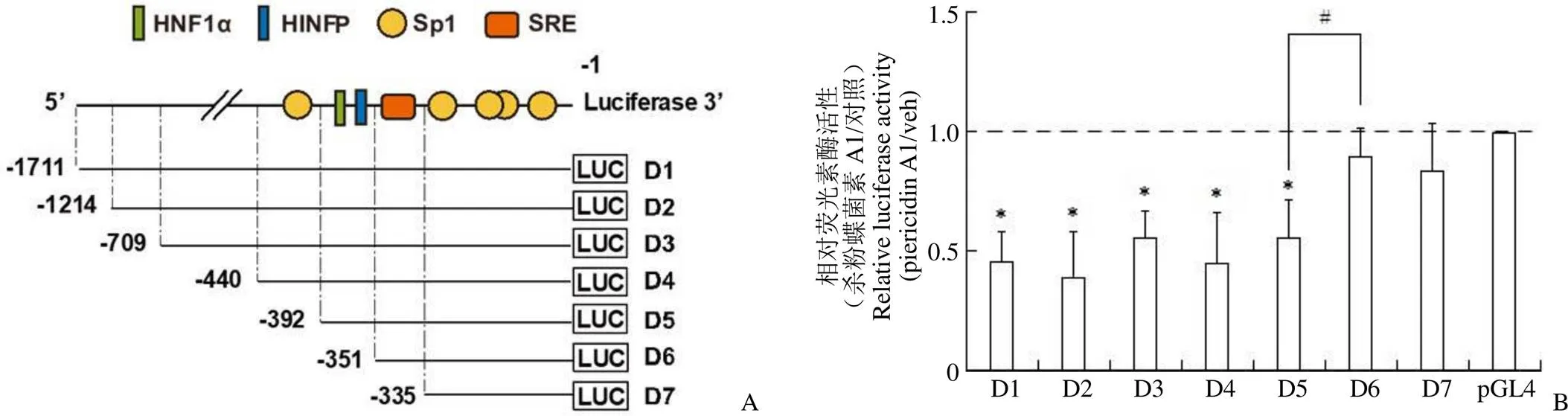
图 5 杀粉蝶菌素A1 可能通过HNF1α 和HINFP 下调 PCSK9的转录活性(A:含有全长或不同缺失的人 PCSK9 启动子重组荧光素酶报告基因的构建示意图,ATG 起始密码子前的核苷酸指定为 +1,-1 是 PCSK9 启动子插入片段的3' 末端;B:杀粉蝶菌素A1 对转染含有不同区段缺失启动子 D1 ~ D7 的 PCSK9 荧光素酶报告质粒转染的 HepG2 细胞荧光素酶活性的影响;与溶剂对照相比,*P < 0.05,与 D5 相比#P < 0.05,n = 3)
Figure 5 Piericidin A1 may downregulates PCSK9 transcriptional expression through HNF1α and HINFP (A: The schematic diagram of the recombinant luciferase reporter constructs containing full-length or different truncated human PCSK9 promoter region. Position +1 was designated as the nucleotide preceding the ATG start codon. Position -1 was the 3' end of PCSK9 promoter inserts; B: Effects of piericidin A1 on the luciferase activity of D1-D7 in HepG2 cells.*< 0.05 vs. vehicle in the corresponding group,#< 0.05 vs. D5, n = 3)
目前使用较广泛的高通量筛选形式主要建立在分子水平或细胞水平的筛选模型,以微孔板形式为载体对样品库进行高效筛选。本工作中采用的 PCSK9 表达抑制剂筛选模型是以细胞为载体,在 96 孔板上对微生物发酵液粗提品库进行高通量筛选。相较基于分子水平的筛选,细胞水平的筛选更接近体内的生理生化过程,获得的阳性样品活性更准确真实,且便于后续对样品的生物活性进行综合评价。
杀粉蝶菌素 A 是 1963 年被 Takahashi 及其同事首次从土壤来源链霉菌 Streptomyces mobaraensis 中分离得到的具有杀虫活性的新化合物[17]。其整体结构类似辅酶 Q,可作为辅酶 Q 拮抗剂,是线粒体传递链中特异和强效的 NADH-泛醌氧化还原酶(complex I)抑制剂[18]。除了最初发现的杀虫活性,研究还发现杀粉蝶菌素 A1 具有抗菌活性及抗肿瘤活性[19-22],而杀粉蝶菌素 A1 在胆固醇代谢中的作用尚未见报道。
本工作利用实验室前期构建的 PCSK9 转录抑制剂筛选模型对发酵液粗提品库进行筛选,获得了具有 PCSK9 表达抑制活性的阳性发酵液样品及其活性组分杀粉蝶菌素 A1;经实验证实粉蝶菌素 A1 在纳摩尔浓度时即可显著抑制 HepG2 细胞中 PCSK9 的表达,增加 LDLR 的表达,还可以促进 LDLR 介导的肝细胞对 LDL-C 的摄取功能;初步机制研究发现该化合物可能通过作用于 HNF1α、HINFP 等转录因子从而调控 PCSK9 转录活性。综上结果证明粉蝶菌素 A1 有望发展为新型抗动脉粥样硬化先导化合物。
[1] Bulbulia R, Armitage J. LDL cholesterol targets-how low to go? Curr Opin Lipidol, 2012, 23(4):265-270.
[2] Seidah NG, Benjannet S, Wickham L, et al. The secretory proprotein convertase neural apoptosis-regulated convertase 1 (NARC-1): Liver regeneration and neuronal differentiation. Proc Natl Acad Sci U S A, 2003, 100(3):928-933.
[3] Timms KM, Wagner S, Samuels ME, et al. A mutation in PCSK9 causing autosomal-dominant hypercholesterolemia in a Utah pedigree. Human Genetics, 2004, 114(4):349-353.
[4] Zhang DW, Lagace TA, Garuti R, et al. Binding of proprotein convertase subtilisin/kexin type 9 to epidermal growth factor-like repeat A of low density lipoprotein receptor decreases receptor recycling and increases degradation. J Biol Chem, 2007, 282(25): 18602-18612.
[5] Benjannet S, Rhainds D, Essalmani R, et al. NARC-1/PCSK9 and its natural mutants: Zymogen cleavage and effects on the low density lipoprotein (LDL) receptor and LDL cholesterol. J Biol Chem, 2004, 279(47):48865-48875.
[6] Mullard A. Nine paths to PCSK9 inhibition. Nat Rev Drug Discov, 2017, 16(5):299-301.
[7] Lamb YN. Inclisiran: first approval. Drugs, 2021, 81(3):389-395.
[8] Bérdy J. Thoughts and facts about antibiotics: Where we are now and where we are heading. J Antibiot (Tokyo), 2012, 65(8):385-395.
[9] Endo A, Kuroda M, Tanzawa K. Competitive inhibition of 3-hydroxy-3-methylglutaryl coenzyme A reductase by ML-236A and ML-236B fungal metabolites, having hypocholesterolemic activity. 1976. Atheroscler Suppl, 2004, 5(3):39-42.
[10] Wang X, Chen X, Zhang X, et al. A small-molecule inhibitor of PCSK9 transcription ameliorates atherosclerosis through the modulation of FoxO1/3 and HNF1α. EBioMedicine, 2020, 52:102650.
[11] Lo Surdo P, Bottomley MJ, Calzetta A, et al. Mechanistic implications for LDL receptor degradation from the PCSK9/LDLR structure at neutral pH. EMBO Rep, 2011, 12(12):1300-1305.
[12] Pettersen D, Fjellström O. Small molecule modulators of PCSK9 - A literature and patent overview. Bioorg Med Chem Lett, 2018, 28(7): 1155-1160.
[13] Cameron J, Ranheim T, Kulseth MA, et al. Berberine decreases PCSK9 expression in HepG2 cells. Atherosclerosis, 2008, 201(2):266-273.
[14] Chen HC, Chen PY, Wu MJ, et al. Tanshinone IIA modulates low density lipoprotein uptake via down-regulation of PCSK9 gene expression in HepG2 cells. PLoS One, 2016, 11(9):e0162414.
[15] Petersen DN, Hawkins J, Ruangsiriluk W, et al. A Small-molecule anti-secretagogue of PCSK9 targets the 80S ribosome to inhibit PCSK9 protein translation. Cell Chem Biol, 2016, 23(11):1362-1371.
[16] Petrilli WL, Adam GC, Erdmann RS, et al. From screening to targeted degradation: strategies for the discovery and optimization of small molecule ligands for PCSK9. Cell Chem Biol, 2020, 27(1):32-40, e3.
[17] Tamura S, Takahashi N, Miyamoto S, et al. Isolation and physiological activities of piericidin a, A natural insecticide produced by streptomyces. Agric Biol Chem, 1963, 27(8):576-582.
[18] Hall C, Wu M, Crane FL, et al. Piericidin A: a new inhibitor of mitochondrial electron transport. Biochem Biophys Res Commun, 1966, 25(4):373-377.
[19] Muhayimana S, Zhang X, Xu J, et al. Cytotoxic selectivity and apoptosis induction of piericidin A contributes potentially to its insecticidal effect against Mythimna separata (Lepidoptera: Noctuidae) larvae. Pestic Biochem Physiol, 2019, 157:19-25.
[20] Morgan JM, Duncan MC, Johnson KS, et al. Piericidin A1 blocks yersinia ysc type III secretion system needle assembly. mSphere, 2017, 2(1):e00030-17.
[21] Zhou X, Liang Z, Li K, et al. Exploring the natural piericidins as anti-renal cell carcinoma agents targeting peroxiredoxin 1. J Med Chem, 2019, 62(15):7058-7069.
[22] Zhou X, Fenical W. The unique chemistry and biology of the piericidins. J Antibiot (Tokyo), 2016, 69(8):582-593.
Discovery and activity of transcriptional inhibitors of PCSK9 derived from microorganism
HE Wei, YANG Yu-xin, LI Yi-hong, LI Xiao-qian, LI Xing-xing, SHI Yuan-yuan, SUN Hong-min, WANG Li, XIE Yun-ying,HONG Bin
NHC Key Laboratory of Biotechnology of Antibiotics (HE Wei, YANG Yu-xin, LI Yi-hong, LI Xing-xing, SHI Yuan-yuan, SUN Hong-min, WANG Li, HONG Bin), CAMS Key Laboratory of Synthetic Biology for Drug Innovation (LI Yi-hong, LI Xiao-qian, LI Xing-xing, SHI Yuan-yuan, SUN Hong-min, XIE Yun-ying, HONG Bin), Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
We aimed to obtain active fermentation broth of strains and its active components targeting PCSK9 transcriptional activity through screening. The active compounds are potential to be developed to leading compounds or drug candidates that can be used for the treatment or prevention of atherosclerosis.The constructed high-throughput drug screening assay targeting PCSK9 transcriptional expression was applied to screen fermentation broth samples from the national new drug (microorganism) screening laboratory. The positive fermentation broth was isolated and extracted to obtain small molecular compounds with PCSK9 transcriptional inhibitory activity. Western blot was used to detect the effects of the active compounds on PCSK9 and LDLR expression, and flow cytometry was used to evaluate the changes on LDL-C uptake by HepG2 cells.The positive strain I03A-00300 and its active component, piericidin A1 were obtained. Piericidin A1 significantly inhibited the expression of PCSK9, followed by increased LDLR protein level and enhanced LDLR-mediated uptake of LDL-C in HepG2 cells at a relatively lower concentration.As PCSK9 inhibitor, piericidin A1 up-regulates the expression of downstream gene LDLR and LDLR-mediated LDL cholesterol uptake by targeting PCSK9 transcription at the cellular level. This proves that piericidin A1 is expected to be developed as a new lead compound for anti-atherosclerosis.
atherosclerosis; PCSK9; high-throughput screening; LDL-C; piericidin A1
WANG Li, Email: wangli_imb@163.com; HONG Bin, Email: binhong69@hotmail.com
10.3969/j.issn.1673-713X.2021.06.002
国家自然科学基金(81473214)
王丽,Email:wangli_imb@163.com;洪斌,Email:binhong69@hotmail.com
2021-04-15
*同为第一作者

