重组抗VEGF单抗工艺特异性宿主细胞蛋白质残留ELISA检测方法的建立与验证
邓春平,梅雄,王星,刘翠华
·论著·
重组抗VEGF单抗工艺特异性宿主细胞蛋白质残留ELISA检测方法的建立与验证
邓春平,梅雄,王星,刘翠华
519085 广州,百奥泰生物制药股份有限公司(邓春平、梅雄、刘翠华);63110 St. Louis,ArrayBridge Inc.(王星)
建立重组抗 VEGF 单抗中 CHO 宿主细胞蛋白质(HCPs)残留的 ELISA 检测方法,并对方法进行验证。采用空载 CHO 细胞制备工艺特异 HCPs,并进行二维电泳表征;采用二维电泳-Western blot(2D SDS-PAGE/Western blot)法对 6 种抗 CHO HCPs 多克隆抗体(C3、C6、C7、AB000103-A、AB000103-C、3G-0016-AF)识别重组抗 VEGF 单抗工艺特异性 HCPs 的覆盖率进行测定;选择覆盖率最高的多抗作为检测抗体,建立制品工艺特异性 HCPs ELISA检测方法,并对方法的线性、基质干扰、稀释线性、灵敏度、精密度和准确性进行验证;此外对该方法与商业化通用检测方法进行了桥接对比研究。制备的工艺特异性 HCPs 蛋白质谱分布广泛;筛选得到覆盖率为 59% 的 C6 兔抗 CHO HCPs 多抗作为检测抗体,并建立了夹心 ELISA 检测法;该方法不受原液基质干扰,HCPs 标准品在 3.33 ~ 810 ng/ml 浓度范围曲线拟合良好,原液在 1 ~ 8 倍范围内有良好的稀释线性;检测限 0.075 ng/ml,定量限 20 ng/ml;试验内和试验间变异系数均不超过 10%;30、150 及 300 ng/ml 浓度的 HCPs 标准品的回收率分别为 107%、107% 和 95%;工艺特异性 ELISA法测得的结果显著高于商业化通用检测方法。建立了重组抗 VEGF 单抗工艺特异性 HCPs ELISA 检测方法,该方法具有良好的检出率、灵敏度、精密度、准确性和线性,适用于该制品 HCPs 残留检测。
重组抗 VEGF 单抗; CHO 细胞; 宿主细胞蛋白质; 酶联免疫吸附法
宿主细胞蛋白质(host cell proteins,HCPs)是由宿主细胞产生或编码的与预期目标药物无关的蛋白质,其组成复杂,主要与宿主表达系统和活性成分的表达方式有关[1]。由于 HCPs 来源于非人表达系统,其外来或“非自身”的特性决定几乎任何单个 HCP 都有可能在人体内引发免疫反应[2]。HCPs 在人体内的不良反应包括:诱导机体产生抗 HCPs 抗体,从而引起过敏反应,或发挥“佐剂效应”诱发机体产生抗药抗体[3-4];有些来源于哺乳动物细胞的 HCPs 具有生物学活性,可能在人体内发挥作用(如细胞因子和趋化因子家族)[5],从而影响药物的安全性和有效性;HCPs 中的蛋白酶还会影响细胞培养上清中的 HCPs 组成,从而影响后续纯化工艺对 HCPs 的清除[4, 6];另外 HCPs 的蛋白酶活性会降解药物蛋白或促进蛋白制剂中的聚山梨酯降解而影响药物蛋白的稳定性[2, 7-8]。鉴于 HCPs 对患者的安全性和产品的有效性的潜在影响,在纯化工艺中必须对 HCPs 进行监测和控制,有效去除 HCPs,并保持工艺的稳健性。
目前 HCPs 分析和检测的主要方法有一维电泳(1D SDS-PAGE)或二维电泳法(2D SDS-PAGE)、高效液相色谱法、毛细管电泳法、质谱法和酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)等[6, 9-10]。不同的分析方法各有其优缺点,其中 ELISA 法因高特异性、高灵敏度、数据定量及通量高等优点,广泛应用于重组生物制品的质量控制[1, 9]。抗 HCPs 多克隆抗体和 HCPs 标准品是 ELISA 法的关键试剂,该多抗对重组生物制品中 HCPs 的识别能力可直接影响 HCPs 的测定结果;因此,需对检测用 HCPs 多抗识别 HCPs 的能力(一般称为覆盖率)进行分析[9, 11];理想的多克隆抗体应能识别大部分 HCPs 蛋白[11]。
本研究采用 2D SDS-PAGE/Western blot 法对 6 种抗 CHO HCPs 多抗识别重组抗 VEGF 单抗工艺特异性 HCPs 的覆盖率进行分析测定,并挑选覆盖率最高的一种多抗作为检测用抗体,建立测定该单抗制品中残留 HCPs 的夹心 ELISA 法,并对方法进行验证。
1 材料与方法
1.1 材料
1.1.1 细胞与样品 CHO-K1 细胞(含空载质粒)及重组人抗 VEGF 单抗原液均由百奥泰生物制药股份有限公司制备和保存。
1.1.2 主要试剂与仪器 兔抗 CHO HCPs 多抗(编号:C3, C6, C7, AB000103-A, AB000103-C)为美国ArrayBridge 公司专有产品;生物素标记的兔抗 CHO HCPs 多抗(编号:C6-Biotin)、辣根过氧化物酶(horseradish peroxidase,HRP)标记的链霉亲和素及 TMB 底物溶液购自淄博云桥生物技术有限公司;山羊抗 CHO HCPs 多抗(编号:3G-0016-AF)和 HCPs ELISA 试剂盒(F550)均购自美国 Cygnus 公司;荧光染料 Sypro Ruby Protein Blot Stain 购自美国 Thermo Scientific公司;IRDye 800CW 标记的驴抗山羊 IgG 复合物和 IRDye 800CW 标记的驴抗兔 IgG 复合物均购自美国 Li-COR 公司;ETTAN IPGphor 3 等电聚焦仪和 ETTAN DALTsix 电泳槽为美国 GE Healthcare 公司产品;ScanMaker i800 扫描仪为上海中晶科技有限公司产品;PROTEAN i12TMIEF Cell 等电聚焦仪、Mini-PROTEAN Tetra System 电泳槽及 ChemiDoc 成像系统购自美国 Bio-Rad 公司;SpectraMax M4 酶标仪为美国 Molecular Device 公司产品。
1.2 方法
1.2.1 工艺特异性 HCPs 的制备 参照文献[11-12],转染空载质粒的 CHO-K1 细胞采用相同的生产培养基模拟重组人抗 VEGF 单抗上游细胞培养工艺制备细胞培养上清液,经超滤浓缩置换缓冲液后获得上游工艺特异性 HCPs,经 BCA 法测定蛋白质含量后,作为建立 ELISA 法的标准品。
1.2.2 工艺特异性 HCPs 的二维电泳表征 HCPs标准品经丙酮沉淀处理后,用 Bradford 法测定蛋白质含量。第一维等电聚焦电泳的 HCPs 上样量 300 μg,采用 17 cm/pH 3 ~ 10 干胶条在 ETTANIPGphor 3 等电聚焦仪上先进行等电聚焦分离;第二维 SDS-PAGE 采用 12.5% 分离胶,在 ETTAN DALTsix 电泳槽上进行分离;银染法对凝胶进行蛋白质染色,而后对凝胶进行扫描与拍照;采用 GE Image Master 2D platinum 5.0 分析软件对凝胶上的斑点数目进行分析统计。
1.2.3 HCPs 多抗识别 HCPs 的覆盖率分析 第一维等电聚焦电泳的 HCPs 标准品上样量 1 mg,采用 18 cm/pH 3 ~ 10 干胶条在 PROTEAN i12TMIEF Cell 等电聚焦仪上先进行等电聚焦分离;第二维 SDS-PAGE 采用 4% ~ 20% 梯度分离胶,在 Mini-PROTEAN 电泳槽上进行分离;采用荧光染料 Sypro Ruby 对凝胶进行总蛋白质染色后,ChemiDoc 成像系统对凝胶进行曝光拍照或对凝胶进行转印硝酸纤维素膜后,1% 牛血清白蛋白(BSA)于室温下封闭 2 h;分别加入 5 种兔抗 CHO HCPs 多抗(稀释终浓度为 2.7 μg/ml)及山羊抗 CHO HCPs 多抗(稀释终浓度为 0.53 μg/ml),室温孵育 90 min;洗涤后加入 IRDye 800CW 标记的驴抗兔 IgG 复合物(1:5000 稀释)或 IRDye 800CW 标记的驴抗山羊 IgG 复合物(1:5000 稀释),室温孵育 60 min,洗涤后,采用 Li-Cor Odyssey 红外荧光成像系统进行曝光拍照;凝胶图片及 2D SDS-PAGE/Western blot 图片采用 Bio-Rad PDQuest 双向电泳图像分析软件进行分析,软件自动识别并统计图谱上的斑点数目,计算不同 CHO HCPs 多克隆抗体识别 HCPs 的覆盖率,选择覆盖率最高的多抗作为检测抗体。
1.2.4 ELISA 方法的建立 以 1.2.3 项筛选得到的兔抗 CHOHCPs 多抗作为包被检测抗体,以5 μg/ml 包被酶标板,1% BSA 封闭后,以 100 μl/孔加入 HCPs 标准品及待测样品,室温反应 1.5 h;洗涤 3 次,100 μl/孔加入终浓度为 1.25 μg/ml 的生物素标记的兔抗 CHO HCPs 多抗,室温反应50 min;洗涤 3 次,100 μl/孔加入终浓度为 0.1 μg/ml 的 HRP 标记的链霉亲和素,室温反应 0.5 h;洗涤 3 次,100 μl/孔加入四甲基联苯胺(TMB)底物显色液,室温下孵育 5 min;100 μl/孔加入终止液。酶标仪在 450 nm 处测定吸光度(A);以不同浓度 HCPs 标准品为横坐标,A值为纵坐标,采用四参数拟合方式绘制标准曲线,根据标准曲线计算待测样品中宿主细胞蛋白含量。
1.2.5 方法学验证
1.2.5.1 线性与范围 在用兔抗 CHOHCPs 多抗包被的酶标板中以 100 μl/孔,分别加入 0、3.33、10、30、90、270 和 810 ng/ml的 HCPs 标准品,按 1.2.4 项进行操作并绘制四参数标准曲线。
1.2.5.2 基质干扰 取原液样品,按 3:1 的比例加入 600 ng/ml HCPs 标准品;以相同比例在原液中加入 0 ng/ml HCPs 标准品的混合溶液作为空白对照,按照 1.2.4 项进行测定,扣除原液基质的 HCPs,计算 HCPs 标准品的回收率;回收率若处于 80% ~ 120% 则表明原液基质不干扰 HCPs 检测;否则存在干扰,原液需进行适当稀释后再进行检测。
1.2.5.3 样品稀释线性 将原液样品分别稀释 1、2、4、8 倍后按照 1.2.4 项进行测定,计算4 个稀释度的 HCPs 检测结果;同时计算相邻两个稀释度所测结果之间的百分比。

1.2.5.5 精密度 同一名分析人员对低、中、高(分别为25、150、600 ng/ml)浓度的 HCPs 标准品,在同一次试验内每个浓度重复测定 3 份,计算CV,即为试验内精密度;两名分析人员分别对上述 3 个浓度的 HCPs 标准品进行测定,计算CV,即为不同人员试验之间精密度。
1.2.5.6 准确性 将原液样品分别与 60、300 和 600 ng/ml HCPs 标准品等体积混合,另设添加等体积 0 ng/ml HCPs 标准品的原液样品混合液作为空白对照,重复检测 3 次,测定混合样品的 HCPs 含量,扣除空白后,计算 HCPs 标准品的回收率及CV。
1.2.6 工艺特异性和商业化通用 HCPs ELISA 方法桥接 采用 1.2.4 项建立的工艺特异性 HCPs ELISA 方法和商业化通用 HCPs ELISA 试剂盒同时对 5 批原液样品进行检测。
2 结果
2.1 工艺特异性HCPs 的二维电泳表征
二维电泳银染图谱显示,制备的工艺特异性 HCPs 中含有大量蛋白质,等电点从 3 ~ 10,分子量从 10 ~ 180 kD 范围内均有分布;经分析统计共识别出 863 个蛋白质斑点(图 1),表明制备的工艺特异性 HCPs 蛋白质谱广泛,可用作 HCPs 含量测定标准品。

图 1 工艺特异性 HCPs 标准品的二维电泳银染图
Figure 1 2D SDS-PAGE of process-specific HCPs stained with silver
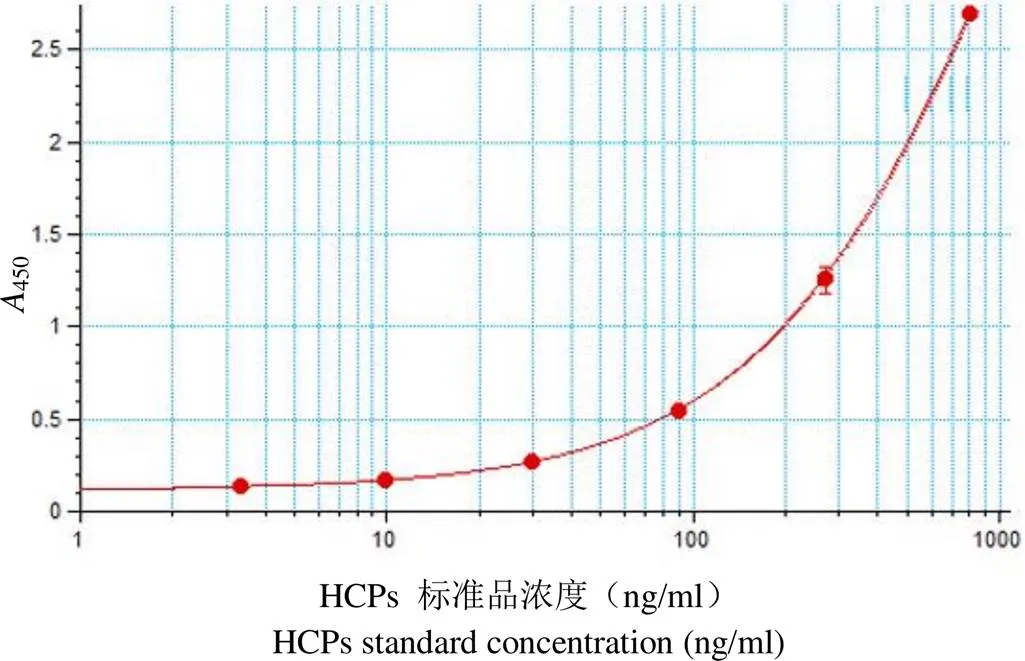
图 2 HCPs 标准品的四参数拟合曲线
Figure 2 Fitting curve of HCPs standard with four parameter logistic model
2.2 HCPs 多抗识别HCPs 的覆盖率
分析结果显示,5 种编号分别为 C3、C6、C9、AB000103-A 和 AB000103-C 的兔抗 CHO HCPs 多抗识别工艺特异性 HCPs 的覆盖率分别为 24%、59%、57%、32% 和 34%;编号为 3G-0016-AF 的山羊抗 CHO HCPs 多抗覆盖率则为 28%;其中编号 C6 多抗的覆盖率最高,接近 60%,故选择该多抗作为检测抗体。
2.3 方法学验证
2.3.1 线性与范围 HCPs 标准品在 3.33 ~810 ng/ml 范围与450值的四参数曲线方程为 y =(0.11 – 7.2)/[1 +(/ 1427^0.991)]+ 7.2,2= 1,具有良好的曲线拟合,见图 2。
2.3.2 基质干扰 HCPs 标准品的理论值为150 ng/ml,实际测定值为 136 ng/ml,回收率 91%,表明原液样品基质对 HCPs 测定没有干扰。
2.3.3 样品稀释线性 原液样品稀释 1、2、4、8 倍后测得的 HCPs 结果如表 1 所示。结果表明,样品稀释 1 ~ 8 倍时,相邻两个稀释度所测结果之间的百分比在 80% ~ 120% 之间,原液样品稀释1 ~ 8 倍存在稀释线性。
2.3.4 灵敏度 经检测与计算,方法的检测限为 0.075 ng/ml。10 ng/ml、15 ng/ml 和 20 ng/ml 的 HCPs 标准品和原液样品混合的加标回收率分别为 16.8%、67.3% 和 74.4%,CV分别为 2.6%、3.2% 和 2.3%,因此该方法的定量限为 20 ng/ml。
2.3.5 精密度 低、中、高三个浓度 HCPs 标准品的试验内CV 分别为 1.1%、9.2% 和 3.8%;试验间 CV 分别为 5.0%、8.1% 和 3.9%;方法的精密度良好,见表 2。
2.3.6 准确性 低、中、高三个浓度 HCPs 标准品测得的回收率分别为 107%、107% 和 95%;CV 分别为18.4%、10.0% 和 9.4%,见表 3;方法的准确性良好。

表 1 原液稀释线性
2.4 工艺特异性和商业化通用 HCPs ELISA 方法桥接
表 4 结果显示,工艺特异性 HCPs ELISA 方法测定 5 批原液的 HCPs 残留结果在 10 ~ 20 ppm范围内,显著高于商业化通用 ELISA 检测试剂盒测得的结果(0.8 ~ 1.6 ppm)。
3 讨论
由于 HCPs 对重组生物制品的质量、疗效以及患者安全的潜在影响,同时 HCPs 的监测是下游纯化工艺开发的一个重要指标,因此重组生物治疗产品中残留 HCPs 的含量通常被认为是一个关键质量属性(CQA),一般需要纳入生产过程控制及原液批放行检测[1, 4]。重组生物制品终产品中 HCPs 应控制在一个可接受的低水平,一般行业共识和监管部门要求是不超过 100 ppm[1, 4]。HCPs 组成成分复杂和多样且受到多个因素的影响,比如与宿主表达系统、目标蛋白的表达方式、细胞培养和下游纯化工艺等因素有关[1, 3, 13],这些都给 HCPs 的检测和控制带来重大挑战。检测 HCPs 的方法较多,但夹心 ELISA 法因独特优势,仍然是目前 HCPs 检测使用最广泛的方法。大多数生物制药公司在产品开发早期阶段通常采用商业化通用HCPs ELISA 试剂盒对下游纯化过程中间产物及原液中的 HCPs 进行检测和控制,但商业化 ELISA 试剂盒使用的 HCPs 标准品往往与特定产品的 HCPs 种类存在较大差异,且商业化 ELISA 试剂盒使用的 HCPs 多抗可能未必适用于特定产品;因此,一般在产品开发的后期(如 III 期临床或工艺验证前)需要开发产品工艺特异性 ELISA 检测方法[13]。目前部分已上市重组生物制品的研发单位通过开发产品工艺特异性 HCPs ELISA 检测方法来解决商业化试剂盒的不足,但产品工艺特异性的检测方法开发周期较长、成本高昂,且有研究发现,产品工艺特异性 HCPs ELISA 检测方法也不能保证回收率优于商业化 ELISA 试剂盒[3, 14]。有研究建议,在 HCPs 抗体覆盖率达到一定水平时,通过开发产品工艺特异性标准品,建立产品特异性 ELISA 检测法可能是一种较好的解决方案[3, 9]。无论采用产品工艺特异性 HCPs ELISA检测方法还是商业化检测试剂盒,都需预先对所使用的 HCPs 抗体识别 HCPs 的能力(覆盖率)进行分析[11]。
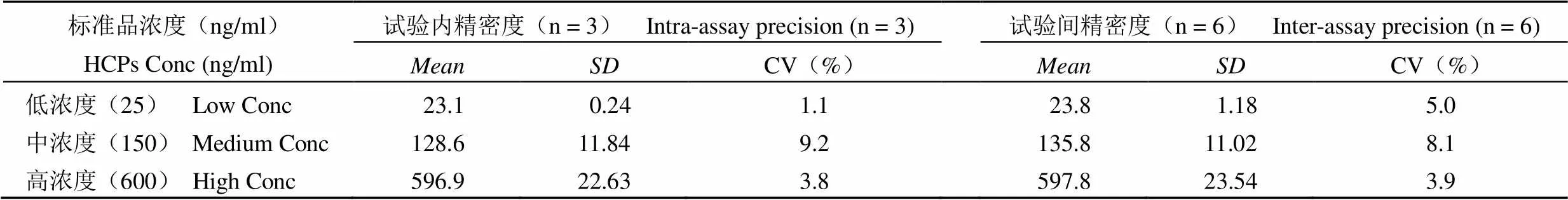
表 2 精密度验证

表 4 工艺特异性和商业化 ELISA 方法检测原液中 HCPs 残留的结果(ppm)
研究首先制备了上游工艺特异性 HCPs,经二维电泳分析显示 HCP 蛋白谱分布广泛;而后采用 2D SDS-PAGE/Western blot 法对 6 种抗 CHO HCPs 多抗识别重组抗VEGF 单抗工艺特异性 HCPs 的覆盖率进行检测分析,筛选到覆盖率达 59% 的 C6 多抗(经重复分析覆盖率为 69%)作为检测抗体,建立了产品工艺特异性 HCPs 夹心 ELISA 检测法。验证结果显示,该方法的 LOD 和 LOQ 分别为 0.075和 20 ng/ml;试验内、试验间精密度及准确性均符合要求;方法的测定范围为 20 ~ 810 ng/ml;原液基质对测定没有干扰。此外,由于重组抗 VEGF 单抗早期临床开发阶段采用的是商业化通用 ELISA 检测试剂盒,因此采用本研究建立的工艺特异性 HCPs ELISA 检测法与早期通用检测方法进行了桥接对比研究,结果显示工艺特异性检测方法获得的结果显著高于通用检测方法,这也与该通用检测试剂盒所使用的 HCPs 多抗(编号 3G-0016-PA)覆盖率低相印证。
本研究成功建立了重组抗 VEGF 单抗残留 HCPs 的 ELISA 检测方法,该方法具有良好的检出率、灵敏度、准确性、精密度和线性,可用于该产品中 HCPs 残留的检测。本方法比从头开发一个新的产品或工艺特异性 ELISA 检测方法节省几个月的时间,同时又可以提供比较高的抗体覆盖率以满足药物监管机构的要求。此研究也为其他重组生物制品的残留 HCPs 检测方法的开发提供参考。
[1] Wang X, Hunter AK, Mozier NM. Host cell proteins in biologics development: identification, quantitation and risk assessment. Biotechnol Bioeng, 2009, 103(3):446-458.
[2] Liu GF, Liu XZ, Gao J, et al. Effect of host cell residual proteins on the quality and their quality control of monoclonal antibody. China Biotechnol, 2019, 39(10):105-111. (in Chinese)
刘国芳, 刘晓志, 高健, 等. 宿主细胞残留蛋白质对单克隆抗体药物质量影响及其质量控制. 中国生物工程杂志, 2019, 39(10):105- 111.
[3] Zhang F, Dong YD, Guo S, et al. Comparison of three types of residual Chinese hamster ovary cell protein detection kits. Chin Pharm J, 2016, 51(13):1107-1112. (in Chinese)
张峰, 董衍东, 郭莎, 等. 3种中国仓鼠卵巢细胞蛋白残留量检测试剂盒的比较研究. 中国药学杂志, 2016, 51(13):1107-1112.
[4] Cui XL, Zhu T, Ying WT. Research progress on host cell proteins of genetically engineered pharmaceuticals. Chin J Pharm Anal, 2019, 39(9):1533-1541. (in Chinese)
崔新玲, 朱涛, 应万涛. 基因工程药物宿主细胞蛋白的研究进展. 药物分析杂志, 2019, 39(9):1533-1541.
[5] Beatsob R, Sproviero D, Maher J, et al. Transforming growth factor-beta1 is constitutively secreted by Chinese hamster ovary cells and is functional in human cells. Biotechnol Bioeng, 2011, 108(11): 2759-2764.
[6] Tscheliessnig AL, Konrath J, Bates R, et al. Host cell protein analysis in therapeutic protein bioprocessing-methods and applications. Biotechnol J, 2013, 8(6):655-670.
[7] Chiu J, Valente KN, Levy NE, et al. Knockout of a difficult-to-remove CHO host cell protein, lipoprotein lipase, for improved polysorbate stability in monoclonal antibody formulations. Biotechnol Bioeng, 2017, 114(5):1006-1015.
[8] Hall T, Sandefur SL, Frye CC, et al. Polysorbates 20 and 80 degradation by group XV lysosomal phospholipase A2 isomer X1 in monoclonal antibody formulations. J Pharm Sci, 2016, 105(5):1633- 1642.
[9] Deng CP, Mei X, Chen H, et al. Development and validation of a sandwich ELISA for residual host cell protein of CHO cells in recombinant human anti-TNFα monoclonal antibody. Chin J Biol, 2020, 33(8):925-928, 933. (in Chinese)
邓春平, 梅雄, 陈航, 等. 重组人抗TNFα单抗制品中CHO宿主细胞蛋白质残留夹心ELISA检测方法的建立及验证. 中国生物制品学杂志, 2020, 33(8):925-928, 933.
[10] Wang ZM. Detection and control of host cell proteins in genetic engineering pharmaceuticals. Chin J New Drugs, 2016, 25(22):2550- 2557. (in Chinese)
王志明. 基因工程药物中宿主细胞蛋白的检测与控制. 中国新药杂志, 2016, 25(22):2550-2557.
[11] Residual host cell protein measurement in biopharmaceuticals//The United States Pharmacopeia Convention. United States Pharmacopeia. Rockville, MD: United States Pharmacopeia Convention Press, 2017:1511-1532.
[12] Savino E, Hu B, Sellers J, et al. Development of an in-house,process-specific ELISA for detecting HCP in a therapeutic antibody, Part 1. BioProcess Int, 2011, 9(3):38-47.
[13] Gao Q, Yu Y, Cai JX. Research of the host cell protein species with different exogenous gene backgrounds in CHO cells. Chin Med Biotechnol, 2020, 15(2):171-177. (in Chinese)
高侨, 余垚, 蔡洁行. 不同外源基因拷贝数背景 CHO 细胞的宿主细胞蛋白种类的研究. 中国医药生物技术, 2020, 15(2):171-177.
[14] Liu HY, Riches W, Hylans M, et al. HCP antigens and antibodies from different CHO cell lines. BioProcess Int, 2017, 15(1):28, 30, 32, 34- 39.
Development and validation of a process-specific ELISA assay for detection of residual host cell proteins in recombinant anti-VEGF monoclonal antibody
DENG Chun-ping, MEI Xiong, WANG Xing, LIU Cui-hua
Bio-Thera Solutions, Ltd., Guangzhou 519085, China (DENG Chun-ping, MEI Xiong, LIU Cui-hua); ArrayBridge Inc., St. Louis, 63110, USA (WANG Xing)
To develop and validate an ELISA assay for testing residual CHO host cell proteins (HCPs) in recombinant anti-VEGF monoclonal antibody.The process-specific HCPs were prepared using mock-transfected null CHO cells and then characterized by 2D-SDS PAGE. The coverage of the process-specific HCPs population of recombinant anti-VEGF monoclonal antibody recognized by six anti-CHO HCPs polyclonal antibodies (C3, C6, C7, AB000103-A, AB000103-C, 3G-0016-AF) was evaluated by two-dimensional electrophoresis coupled with Western blot (2D SDS-PAGE/Western blot). The polyclonal antibody with the highest coverage was chosen as a testing antibody, based on which the process-specific ELISA for the measurement of residual HCPs in products was developed and validated with respect to the linearity, matrix interference, dilution linearity, sensitivity, precision and accuracy. In addition, a bridging comparison study was performed between the established process-specific ELISA and commercial generic detection method.The process-specific HCPs showed a broad spectrum of proteins. Rabbit anti-CHO HCPs polyclonal antibodies (C6) with coverage of 59% was screened as a testing antibody, and a sandwich ELISA was accordingly established. The ELISA method was not interfered by drug substance matrix; the curve of HCPs standard fit well in the range of 3.33 - 810 ng/ml; the drug substance showed a good dilution linearity in the range of 1 - 8. The limit of detection and quantitative of the method was 0.075 ng/ml and 20 ng/ml, respectively, both the CVs in intra- and inter-assays were less than 10%, while the recovery of HCPs standard at 30, 150 and 300 ng/ml was 107%, 107% and 95%, respectively. The results obtained by process-specific ELISA from drug substance were significantly higher than those obtained by commercial generic detection method.A process-specific ELISA method has been successfully established, which shows appropriate coverage, sensitivity, accuracy, precision and linearity, and is suitable for detection of the residual HCPs in recombinant anti-VEGF monoclonal antibody.
recombinant anti-VEGF monoclonal antibody; CHO cells; host cell proteins; ELISA
LIU Cui-hua, Email: chliu@bio-thera.com
10.3969/j.issn.1673-713X.2021.06.004
“重大新药创制”国家科技重大专项(2013ZX09401001);广东省引进创新创业团队资助项目(2013Y116)
刘翠华,Email:chliu@bio-thera.com
2021-04-12

