尿素测定试剂盒质量分析探索
高飞,胡泽斌,孙楠,贾峥,游延军,孙晶,曲守方,黄杰
·技术与方法·
尿素测定试剂盒质量分析探索
高飞*,胡泽斌*,孙楠,贾峥,游延军,孙晶,曲守方,黄杰
100050 北京,中国食品药品检定研究院体外诊断试剂检定所(高飞、胡泽斌、孙楠、贾峥、孙晶、曲守方、黄杰);610015 成都,四川省药品技术检查中心(游延军)
尿素(BUN)是客观反映肾小球滤过率的常规检测指标,可运用于临床评估肾功能的损害[1]。近来,该项指标用于妊娠期孕妇检查的研究较多,对于减少妊娠并发症,保证宫内胎儿正常发育具有重要意义[2]。也有报道显示,该项指标也可用于急性上消化道出血[3]及慢性心力衰竭患者血清的检测[4-5],说明尿素检测在临床具备广泛的应用价值。我国临床检测尿素的浓度值广泛采用紫外分光光度生化分析法。目前,作为适用于全自动生化分析检测的体外诊断试剂,尿素测定试剂盒在国内的应用存在三大特点:一是检测平台多,常见平台有日立系列、贝克曼系列、奥林巴斯系列、东芝系列、罗氏系列、西门子系列、雅培系列、迈瑞系列等;二是参考品种类多,国内企业采用的溯源至参考物质的定标校准品和准确度检测用参考品种类繁多,常见的有日本 JCCRM521、美国 SRM-909c、中检院 360012-201601 等;三是考核指标及考核样本种类多[6],国内企业制订的技术要求中的考核指标不一致,特别是准确度项目,用来考核的样本种类有企业校准品、企业自产质控品、进口质控品、国产质控品、进口参考物质和国产参考物质。因此,通过对市场现有的试剂盒进行准确度方法学评价可为统一技术标准奠定基础,保障不同来源的参考物质具有可比性,减少临床重复检测。同时,通过采用不同来源标准品对试剂盒准确度技术指标的检测,可以达到质量评价与控制的目的。准确度是客观评价测定值与标示值之间符合程度的重要指标。通过对不同来源参考物质的对比检测分析,可以考核测试结果与标示值间的一致程度并分析比较参考物质之间的差异性,从而明确试剂检测尿素的结果是否满足临床检测的需要。因此,本次研究计划选择准确度这项重要指标,使用 5 种不同靶值的国际和国家参考物质,以相同的方式配制样本,在不同生产企业各自适用的平台上进行测试,以期实现检验结果的横向比较。
1 材料与方法
1.1 仪器与样本
1.1.1 仪器 7180 全自动生化分析仪为日本日立公司产品;UPS-B6K 纯水仪为北京天创尚邦仪器设备有限公司产品;5 ~ 1000 μl 移液器为德国 Eppendorf 公司产品。
1.1.2 样本 自北京、上海、天津、河北、江苏、江西、四川、贵州、山东、安徽、湖南、浙江、吉林、辽宁、广西、福建、河南、湖北、广东抽取有效监督抽验的试剂盒 42 批,其中国产试剂盒 37 批次,进口试剂盒 5 批次。各试剂盒配套质控品及抽检企业提供工作校准品及主校准品。临床用尿素国际有证参考物质有日本 ReCCS 标准品,批号:JCCRM521-13M、H、HH,靶值:(4.1 ± 0.1)、(9.8 ± 0.2)、(16.1 ± 0.2)mmol/L;美国 NIST 标准品[7],批号:SRM-909c,靶值:(4.321 ± 0.089)mmol/L;中国食品药品检定研究院尿素、尿酸和总蛋白复合冰冻人血清国家标准品,批号:360012-201601,靶值:(5.68 ± 0.17)mmol/L。
1.2 方法
1.2.1 尿素测定试剂盒的采集 经查阅国家药品监督管理局相关资料及官网数据,在全国范围内 19 个省和直辖市共抽取了 42 家生产企业的共计 42 批尿素测定试剂盒,涉及 39 个批准文号。同时采用具有溯源性的国际和国家标准品对不同来源的尿素测定试剂盒的准确度指标进行检测。
1.2.2 检测平台的确定 利用分光光度比色法测定尿素中酶催化反应产物的吸光度值从而判断尿素含量。本次实验采用应用上述原理的全自动生化分析仪平台进行检测。
1.2.3 结果判定方法 采用行业标准进行结果判定,依据中华人民共和国医药行业标准《尿素测定试剂盒(酶偶联监测法)》(YY/T 1201-2013)[8]对标准品的测定值与标示值计算相对偏差。标准规定,尿素的实测值与标示值的相对偏差应在 ±15.0% 范围内。
2 结果
2.1 国家标准品准确度检测结果
尿素、尿酸和总蛋白复合冰冻人血清国家标准品的检测结果符合包括:42 批试剂盒中相对偏差值在 ±15.0% 范围的数量为 36 批,符合率为 85.7%;相对偏差值在 ±5.0% 范围的数量为 28 批,符合率为 66.7%(图 1)。
2.2 国际标准品准确度检测结果
日本 ReCCS 标准品 JCCRM521-13M、H、HH 的检测结果符合包括 42 批试剂盒中相对偏差值在 ±15.0% 范围的数量分别为 35 批、36 批、36 批,符合率分别为 83.3%、85.7%、85.7%;相对偏差值在 ±5.0% 范围的数量为 27批、26 批、22 批,符合率分别为 64.3%、61.9%、52.4%。结果统计详见图 2。
美国 NIST 标准品的检测结果符合包括 42 批试剂盒中相对偏差值在 ±15.0% 范围的数量为 31 批,符合率为73.8%;相对偏差值在 ±5.0% 范围的数量为 4 批,符合率为 9.5%。结果统计详见图 3。

图 1 国家参考品相对偏差符合结果分布
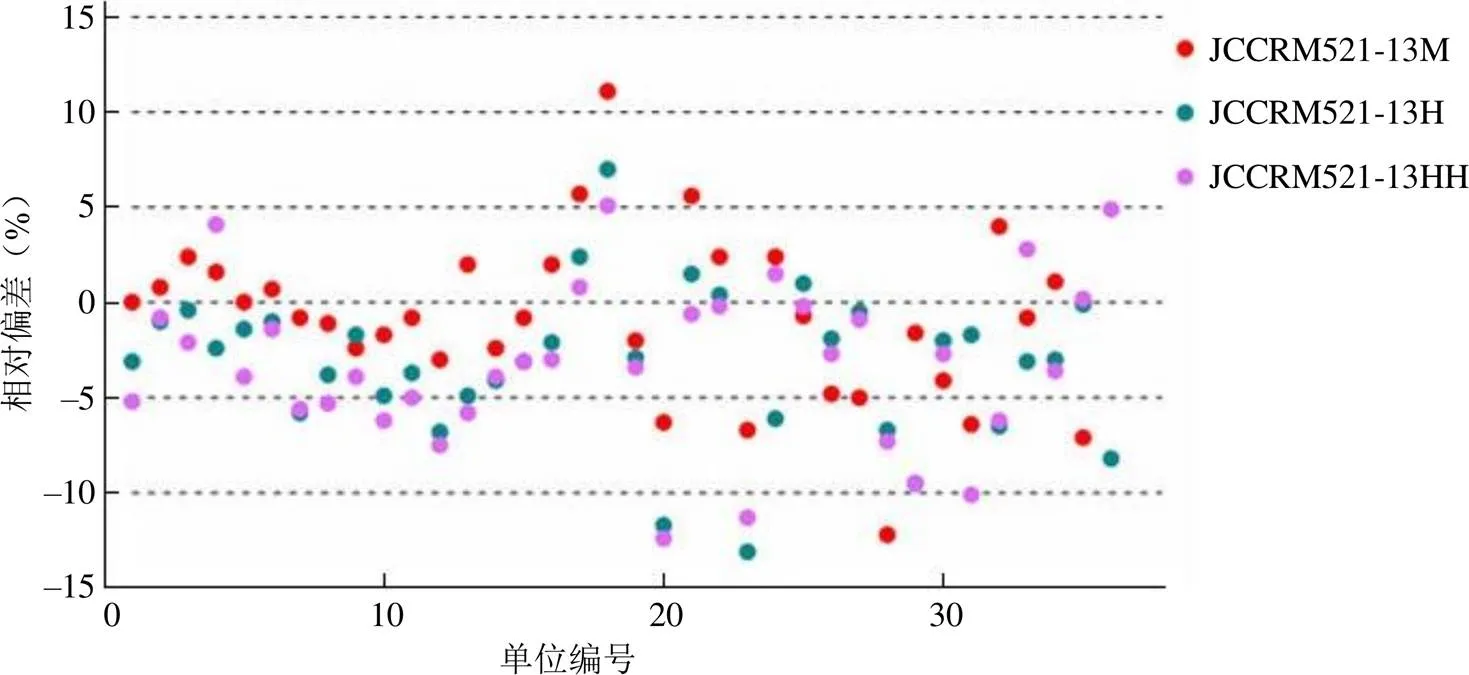
图 2 日本 ReCCS 标准品相对偏差符合结果分布
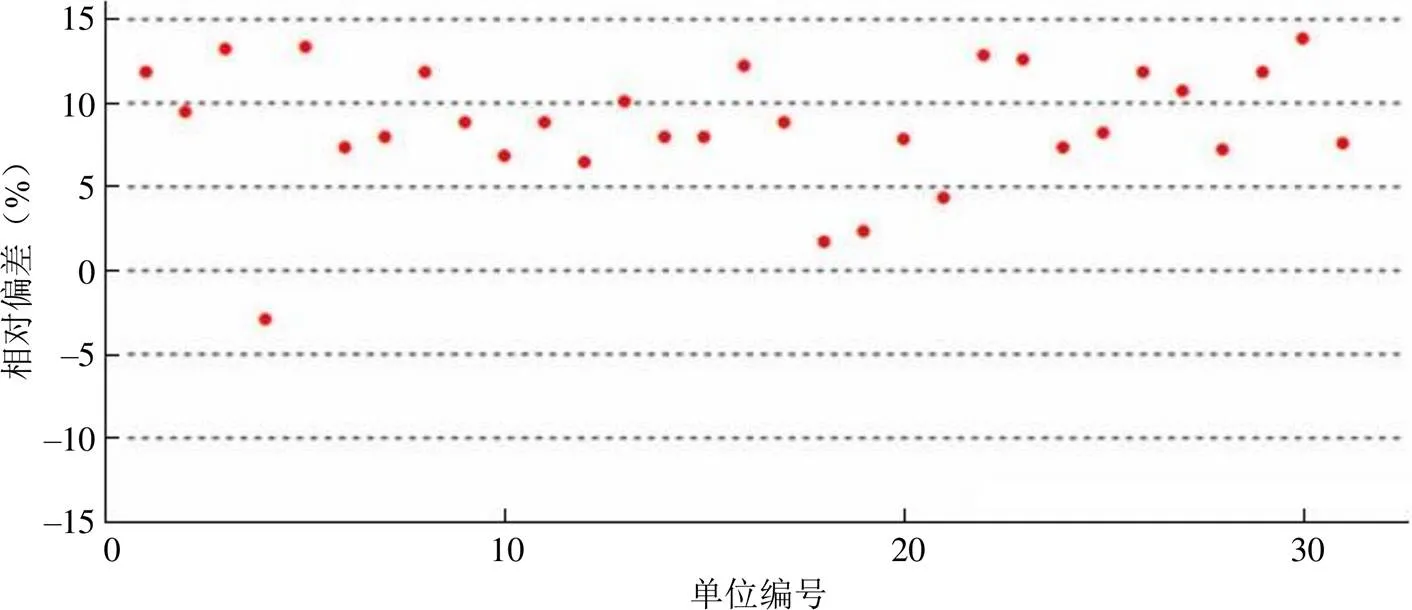
图 3 美国 NIST 标准品相对偏差符合结果分布
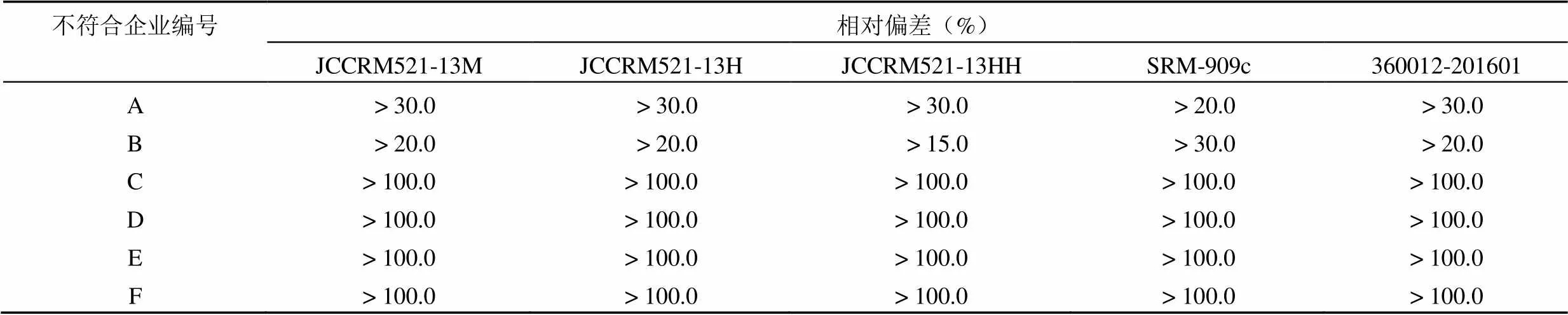
表 1 5 种标准品准确度结果均不符合的偏差程度
2.3 准确度不符合结果的5 种标准品的偏差程度
42 批次产品中5 种不同靶值的标准品检测结果均不符合为 6 批,不符合率为 14.3%,其偏差程度详见表1。
3 讨论
准确性是指测得量值与真量值间的一致程度,用于评价产品测量结果的可信性。如果准确性程度不高,测试结果就会存在假阴性与假阳性,给临床使用造成误导。本次研究中各企业试剂盒的准确度项目数据有一定差异,且个别企业的产品偏差程度较高。分析原因可能为除了没有使用统一的参考物质[9]导致产品溯源不一致外,还包括各家试剂盒试剂原料来源不同、稳定剂选择不一致。究其原因主要是由于没有强制性标准导致当前国内生产的参考物质没有得到企业的重视,缺乏普遍的实际应用性。这种情况客观上也加大了监督抽验及注册检验监管的难度,导致无法客观地评价试剂盒的重要指标。因此,就更需要企业在试剂盒的研发中尽量做到溯源一致,才能便于监督抽验与考核,也更便于临床检测出现问题时的产品溯源。本次研究采用相同的国际及国家标准品对不同来源的尿素测定试剂盒进行检测也是追求采用统一标准物质对产品同一个性能指标进行考核的探索和尝试。
目前,国产尿素测定试剂盒采用的开放检测平台及参考物质种类繁多,部分平台的参考物质具有特殊的溯源性,不利于该类产品的监管,通过对市场现有的试剂盒进行方法学检测评价可为统一技术标准奠定基础,保障不同原理检测方法具有可比性,减少临床重复检测,而采用具有溯源性的参考物质作为方法学评价的工具是保证量值可以有效传递的重要手段[10]。并且,开放平台具备采用统一溯源性参考物质[11]作为定标校准品溯源物质的可能性。因此,建议企业尽量采用国内现有的具有溯源性的参考物质作为定标校准品[12]的溯源物质,同时依据行标采用具有溯源性的国际或国家参考物质作为准确性检测的样本,这样不但可以增强监督检验考核的客观性与公正性,也可以促进企业提升试剂盒的质量以满足参考物质的要求,进而确保临床检测结果的真实有效[9]及可溯源性,从而更有利于保障广大人民群众的生命健康。
[1] Wei ZQ. Application value of serum cystatin C, blood urea nitrogen and creatinine in diagnosis of renal injury. Contemp Med Forum, 2014, 12(6):67-68. (in Chinese)
韦振勤. 血清胱抑素C、血尿素氮和肌酐检测在肾损伤诊断中的应用价值. 当代医药论丛, 2014, 12(6):67-68.
[2] Xiao Y, Shen YP, Wang CY, et al. Application of urea nitrogen, creatinine, uric acid combined detection in kidney damage assessment of pregnancy-induced hypertension. Anhui Med Pharm J, 2016, 20(5): 921-922, 923. (in Chinese)
肖云, 沈漪萍, 王翠玉, 等. 尿素氮、肌酐、尿酸联合检测在妊娠期高血压疾病肾损害评估中的应用. 安徽医药, 2016, 20(5):921- 922, 923.
[3] Chen HR, Xiong AY, Mu CM. Analysis of serum urea nitrogen and creatinine in pregnant women. Diet Health, 2019, 6(5):55. (in Chinese)
陈怀容, 熊安英, 牟昌明. 孕妇血清尿素氮和肌酐结果分析. 饮食保健, 2019, 6(5):55.
[4] Yu M, Fu JJ. Application of blood urea nitrogen creatinine curve in the of bleeding volume in patients with acute upper gastrointestinal hemorrhage and its clinical value. Chin J Clin Gastroenterol, 2019, 31(5):289-293. (in Chinese)
於敏, 付金金. 急性上消化道出血患者出血量估算中血尿素氮肌酐变化曲线的应用及其临床价值探讨. 临床消化病杂志, 2019, 31(5):289-293.
[5] Li TT, Sun YZ, An Y. Clinical significance of detection of BUN, UA and Cr in chronic heart failure. Int J Lab Med, 2018, 39(6):721-723. (in Chinese)
李婷婷, 孙玉真, 安园. 慢性心力衰竭患者血清BUN、UA、Cr检测的临床意义. 国际检验医学杂志, 2018, 39(6):721-723.
[6] Li YH, Zhang SQ. Review and prospect of in vitro diagnostic reagent industry. Lab Med Clin, 2017, 14(2):299-301. (in Chinese)
李耀华, 张世庆. 体外诊断试剂行业发展回顾与展望. 检验医学与临床, 2017, 14(2):299-301.
[7] Choquette SJ, Duewer DL, Sharpless KE, et al. NIST reference materials: utility and future. Annu Rev Anal Chem (Palo Alto Calif), 2020, 13(1):453-474.
[8] China Food and Drug Administration. YY/T 1201-2013 Urea assay kit (Enzyme coupling kinetic method). Beijing: China Standards Press, 2013. (in Chinese)
国家食品药品监督管理总局. YY/T 1201-2013 尿素测定试剂盒尿素测定试剂盒(酶偶联监测法). 北京: 中国标准出版社, 2013.
[9] Wu JY, Chen B, Hu HN, et al. Problems and countermeasures of sample management of in vitro diagnostic reagents in clinical trials. Int J Lab Med, 2020, 41(1):123-126. (in Chinese)
吴建元, 陈博, 胡汉宁, 等. 体外诊断试剂临床试验样本管理的问题及对策. 国际检验医学杂志, 2020, 41(1):123-126.
[10] Fu Y, Gao XN, Huang J. Quality evaluation of in vitro diagnostic reagents and traceability of reference materials. J Mol Diagn Ther, 2017, 9(2):73-77, 87. (in Chinese)
付岳, 高旭年, 黄杰. 体外诊断试剂质量评价与标准物质溯源. 分子诊断与治疗杂志, 2017, 9(2):73-77, 87.
[11] Ou YZ, Chen BR, Ju Y. Current situation of standardization of clinical chemistry measurement. Lab Med, 2021, 36(3):240-244. (in Chinese)
欧元祝, 陈宝荣, 居漪. 临床化学检测的标准化现状. 检验医学, 2021, 36(3):240-244.
[12] Liang CY, Li XJ, Chen HZ. Analysis on traceability of calibration products of in vitro diagnostic reagents. Clin Lab J (Electronic Ed), 2020, 9(1):247-249. (in Chinese)
梁春滢, 李小江, 陈虹蓁. 体外诊断试剂校准品溯源工作现状分析. 临床检验杂志(电子版), 2020, 9(1):247-249.
10.3969/j.issn.1673-713X.2021.06.010
黄杰,Email:jhuang5522@126.com;曲守方,Email:qushoufang@126.com
2021-09-10
*同为第一作者

