PAPSS1的表达与脑胶质瘤临床指标和预后的相关性及对细胞增殖和凋亡的影响
沈晓莹,胡泽斌,张小燕,朱智东,亓垚,陈明敏,杨国翠,刘晶晶,任燕,徐成香,郜恒骏
·论著·
PAPSS1的表达与脑胶质瘤临床指标和预后的相关性及对细胞增殖和凋亡的影响
沈晓莹*,胡泽斌*,张小燕,朱智东,亓垚,陈明敏,杨国翠,刘晶晶,任燕,徐成香,郜恒骏
201203 上海芯超生物科技有限公司(沈晓莹、张小燕、朱智东、亓垚、陈明敏、杨国翠、刘晶晶、任燕、徐成香、郜恒骏);100850 北京,中国食品药品检定研究院体外诊断试剂所(胡泽斌)
研究 PAPSS1 表达与脑胶质瘤临床指标和预后的相关性,及其对细胞增殖和凋亡的影响。采用免疫组化方法检测 PAPSS1、PDL1 蛋白在脑胶质瘤样本的表达,并纳入 SPSS 统计学分析。其中,PAPSS1 和 PDL1 之间及其与临床指标的相关性分析采用 Spearman 法;生存期单因素分析采用Kaplan-Meier 法和 log-rank 检验,将单因素分析中具有统计学意义的变量纳入 COX 多元回归生存分析。使用 siRNA 技术降低 PAPSS1 在脑胶质瘤细胞的表达。转染 48 h 后,利用 MTT 法检测细胞增殖比率,利用 Hochest/PI 法检测细胞凋亡率;PAPSS1、PDL1、ki67 和 Bcl2 等基因的表达变化使用qPCR 检测。上述实验数据采用 GraphPad 软件分析。< 0.05 为有统计学意义。IHC 数据分析显示,癌组织PAPSS1 浆表达和患者年龄、病理分级、复发等显著正相关,而PAPSS1 核表达和各临床指标均无关,PDL1 表达仅和年龄有关;PAPSS1 浆表达和 PDL1 表达之间也显著正相关。生存分析显示,PAPSS1 浆高表达的脑胶质瘤患者拥有更差的总生存期和无病生存期;PAPSS1 核表达和 PDL1 表达都与预后无关。当使用 siRNA 技术降低了 PAPSS1 在癌细胞的表达时,细胞增殖比率出现下降而凋亡率上升,PDL1、ki67 和 Bcl2 等基因的 mRNA 表达水平出现显著下调。本研究发现 PAPSS1 浆表达与脑胶质瘤患者的年龄、病理分级、复发及更短的预后显著相关;降低 PAPSS1 表达能抑制细胞增殖并促进凋亡,同时也下调了 PDL1、ki67、Bcl2等基因的表达水平,提示 PAPSS1 与脑胶质瘤的个性化治疗相关,值得进一步研究和探讨。
PAPSS1; 脑胶质瘤; 细胞增殖; 细胞凋亡
大多数脑肿瘤是起源于胶质细胞的胶质瘤,常被诊断为恶性脑肿瘤[1]。根据 WHO 病理分级系统,胶质瘤分为四级(I ~ IV 级)[2]。其中,III 级和 IV 级是高级别,预后差,需要积极的治疗[3-5]。胶质瘤的确切病因尚不清楚,患者在诊断和积极治疗后的平均预期寿命只有约 14 个月[6]。因此,非常有必要寻找更有效的分子预后标志物用于脑胶质瘤患者的临床预测和治疗。
3'-磷酸腺苷-5'-磷酸硫酸合酶(3'-phosphoadenosine 5'-phosphosulfate synthase,PAPSS)是一种能产生硫酸盐供体3'-磷酸腺苷-5'-磷酸硫酸盐(PAPS)的酶[7]。PAPSS 分为两个独立的亚型:PAPSS1 和 PAPSS2。其中,PAPSS1 的总长度约为 108 kb,定位于人类染色体 4q24[8]。有限的研究证实,PAPSS1 参与了乙型肝炎感染过程[9],并在逆转录病毒感染中起着尚未明确的作用[10];PAPSS1 可能参与了雌激素对乳腺癌的调控通路[11],其过表达还可能对肺癌的化疗产生抵抗作用[12-13]。2018 年关于脑胶质瘤的文献显示,包括 PAPSS1 和 PAPSS2 在内的多个代谢相关的酶的基因在脑胶质瘤组织的表达显著高于瘤旁组织,但该文献并没有就 PAPSS1 基因的分子生物学功能进行详细研究[14]。另一方面,最近针对程序性死亡受体蛋白 1(PD-1)及其配体(PDL1)的免疫治疗在许多癌症中取得了突破,但仍然没有在胶质瘤中获得比较确定的疗效,其机制研究也不甚清晰。
因此,本研究采用免疫组化技术研究 PAPSS1 和 PDL1 在脑胶质瘤样本的表达,并分析两个抗体之间以及它们和临床指标及患者预后的相关性;然后,选择其中和预后显著相关的基因,采用 siRNA 技术降低其在肿瘤细胞中的表达,研究其对细胞增殖和凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 组织芯片 脑胶质瘤组织芯片(HBraG180Su02)购自上海芯超生物科技有限公司,包含180 例脑胶质瘤样本。病人的手术时间为 2008 年 2 月到 2011 年 10 月,随访到 2017 年 7 月,随访时间为 69 ~ 113 个月,失访 1 例。
1.1.2 实验试剂 一抗 PAPSS1(14708-1-AP)购买于 Proteintech 公司;一抗 PDL1(GT2280)购于基因科技股份有限公司;HRP 标记的二抗(DM827)和二氨基联苯胺(DAB)购自 DAKO公司;脑胶质瘤细胞株 U87MG 和 U251MG 购自中国科学院上海生命科学研究院;10% 胎牛血清和 DMEM 培养液购自 Gibco 公司;转染试剂 Lipofectamine 2000 和逆转录酶SuperScript IV Reverse Transcriptase均购自 Thermo Fisher公司;小干扰RNAsiRNA-PAPSS1(简称 si-PAPSS1)和 siRNA-NC(简称NC)由基因制药公司合成;检测细胞增殖的 CCK8 试剂盒购自 Vazyme 公司;凋亡染色液 Hochest 和 PI 采购于 Beyotime Biotechnology 公司;Trizol 试剂购自美国 Sigma 公司;qPCR 反应试剂 SYBR®预混料 Ex-Taq™ II(Tli RNaseH Plus)购自 Takara 公司;各基因的 qPCR 引物由上海生工合成。
1.1.3 实验仪器 CO2培养箱(HCP-80)购自海尔公司;酶标仪(ARM-100)购自 All For Life Science 公司;ACUMEN eX3 扫描仪购自 TTP-LabTech 公司;荧光定量 PCR 仪(LightCycler480)购自罗氏公司。
1.2 方法
1.2.1 免疫组织化学实验(IHC) 组织芯片进行脱蜡和抗原修复,再分别加入一抗 PAPSS1(1:1000)和 PDL1(即用型)4 ℃孵育过夜。然后,添加 HRP 标记的二抗孵育 20 min,用 PBST 缓冲液冲洗,使用二氨基联苯胺(DAB)显色,最后封片并判读。选择典型染色视野,分别判读癌细胞的平均染色强度和染色百分率。染色强度评分为:无染色(0 分)、弱染色(1 分)、中等染色(2 分)和强染色(3 分)。染色百分率评分为:0%(0 分)、1% ~ 20%(1 分)、21% ~ 40%(2 分)、41% ~ 60%(3 分)、61% ~ 80%(4分)、81% ~ 100%(5 分)。染色总分 = 染色强度评分 × 染色百分率评分。PAPSS1 的胞浆和胞核染色分别判读评分,PDL1 的浆染色和膜染色因无法区分而一起判读评分。
1.2.2 细胞培养和细胞转染实验 脑胶质瘤细胞株 U87MG 和 U251MG 被接种于含有10% 胎牛血清的 DMEM 培养液中,在37 ℃的 5% CO2的培养箱中培养至对数期。接着,重新调节细胞密度至100 000/ml,向6 孔板的每孔加入2 ml 细胞悬浮液,37 ℃培养24 h。随后去除原培养基,轻柔清洗细胞,加入转染试剂 Lipofectamine 2000 和siRNA,37 ℃转染6 h 后更换为含 90% DMEM 和 10% 胎牛血清的完全培养基。
1.2.3 细胞增殖实验 将转染 24 h 的肿瘤细胞接种在96 孔板中,每孔加入100 μl 细胞悬液。培养 24 h 后,每孔加入 10 μl CCK8 于 37 ℃孵育 1.5 h,使用酶标仪在 450 nm 测定吸光度。细胞增殖率计算公式如下:细胞增殖率 =(实验组–空白组)/(对照组–空白组)× 100%。
1.2.4 细胞凋亡实验 将转染 24 h 的肿瘤细胞接种在 96 孔板中,每孔加入 100 μl细胞悬液。培养 24 h 后,每孔加入 100 μl染色液Hochest/PI,37 ℃避光染色 20 min。使用ACUMEN 仪器扫描判读。
1.2.5 RNA 抽提和荧光定量 PCR 实验(qPCR) 转染 48 h 后的癌细胞被消化和收集。使用 Trizol 法提取总 RNA,然后使用逆转录酶 SuperScript IV Reverse Transcriptase 合成 cDNA。采用qPCR 实验检测PAPSS1、PDL1、ki67、Bcl2 等基因在各组细胞的表达水平,Actin 作为内参。qPCR 实验的每孔反应总体积为 50 μl,其中包括 2 μl 0.4 μmol/L 引物混合物、25 μl SYBR 绿色母料混合物、4 μl DNA 模板和 16 μl无 RNase/Dnase 无菌水。qPCR 实验的程序设置如下:初始变性为 95 ℃反应 30 s;然后,95 ℃反应 5 s,60 ℃反应 30 s,40 个循环,在 60 ℃延伸阶段收集荧光数据;最后,在 95 ℃下反应 5 s,60 ℃反应1 min,95 ℃结束,在 60 ~ 90 ℃阶段收集荧光数据。用于 qPCR 实验的基因引物序列见表 1。
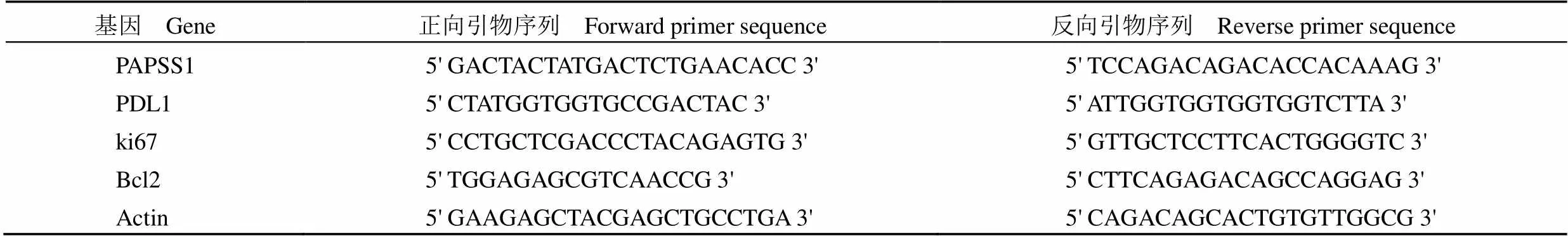
表 1 qPCR 实验的基因引物序列
1.3 统计学处理
排除脱落的组织点,实际获得 177 例病人的 IHC 染色数据。数据被纳入SPSS 软件进行统计学分析。其中,抗体表达与临床指标的相关性、抗体表达之间的相关性分析采用Spearman 法,各指标和生存期的单因素分析采用 Kaplan-Meier 法和 log-rank 检验,将单因素分析中具有统计学意义的变量纳入 COX 多元回归生存分析。细胞增殖实验、细胞凋亡实验和 qPCR 实验数据都纳入 GraphPad 软件进行统计学分析。< 0.05 为有统计学意义。
2 结果
2.1 PAPSS1 浆表达与脑胶质瘤病人的年龄、病理分级、复发以及更差的预后显著相关
IHC 染色结果表明,PAPSS1 在脑胶质瘤样本的胞浆和胞核均有表达,且所有样本均显示出阳性染色,没有阴性染色病例(图 1A);PDL1 主要表达在脑胶质瘤组织的胞浆和胞膜,但仅有约 21% 的样本显示阳性染色,约 79% 的样本为阴性染色(图 1B)。
Spearman 相关性分析显示:PAPSS1 的浆表达分别和患者的年龄、病理分级、复发等显著正相关(0.259,= 0.001)(= 0.445,= 0.000)(= 0.406,= 0.000),而其核表达与各临床指标均没有相关性(> 0.05);PDL1 表达则仅和患者年龄显著正相关(= 0.149,= 0.047)(表 2)。分析还发现,PDL1 在脑胶质瘤组织的表达与 PAPSS1 浆表达显著正相关(= 0.153,= 0.043),而与 PAPSS1 核表达无关(= 0.688);PAPSS1 的浆表达与核表达之间也没有相关性(= 0.827)(表 3)。
生存期单因素分析显示,PAPSS1 浆高表达的脑胶质瘤病人拥有更短的总生存期和无病生存期(50.0% 比 78.3%,= 0.000)(22.9% 比 61.3%,= 0.000)(图 2A),而PAPSS1 核表达(图 2B)、PDL1 表达(图 2C)等均与预后无关(> 0.05)。随后的 COX 多元回归分析表明 PAPSS1 浆表达并不是两种生存期的独立预测因素(= 0.117,= 0.783),而年龄、病理分级等指标分别是脑胶质瘤病人预后的独立预测因子(< 0.01)(表 4、表 5)。
2.2 减少 PAPSS1 表达能显著抑制脑胶质瘤细胞的增殖并促进凋亡
由于 PAPSS1 表达与病人临床指标及预后显著相关,使用siRNA-PAPSS1(简写 si-PAPSS1)和 siRNA-NC(简写 NC)分别转染了脑胶质瘤细胞 U87MG 和 U251MG。qPCR 检测显示,和对照组 NC 相比,si-PAPSS1 组的 PAPSS1 的表达水平出现了显著减少,分别在细胞 U87MG 和 U251MG 降低了 84.8% 和 92.5%(= 0.000,= 0.000)(图 3)。随后的细胞实验发现:与对照组细胞相比较,转染 si-PAPSS1 的脑胶质瘤细胞株的细胞增殖显著降低而细胞凋亡显著增加。其中,U87MG 细胞的增殖率降低 25.4%(= 0.001),凋亡率增加 215.7%(= 0.000);U251MG 细胞的增殖率降低 18%(= 0.001),凋亡率增加 85.0%(= 0.000)(图 4)。
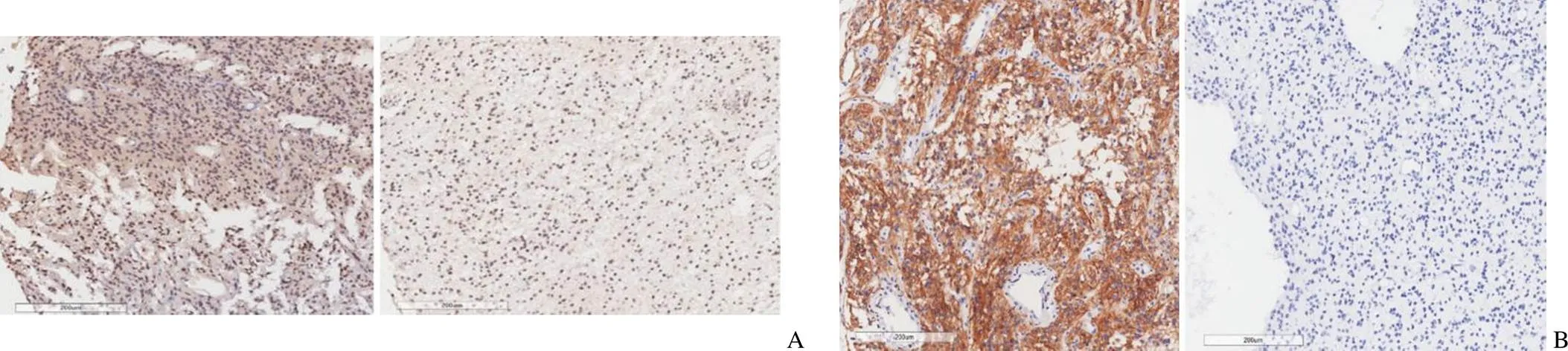
图 1 PAPSS1(A)、PDL1(B)在脑胶质瘤样本的免疫组化染色图片
Figure 1 Immunohistochemical staining of PAPSS1(A) and PDL1(B) in glioma samples
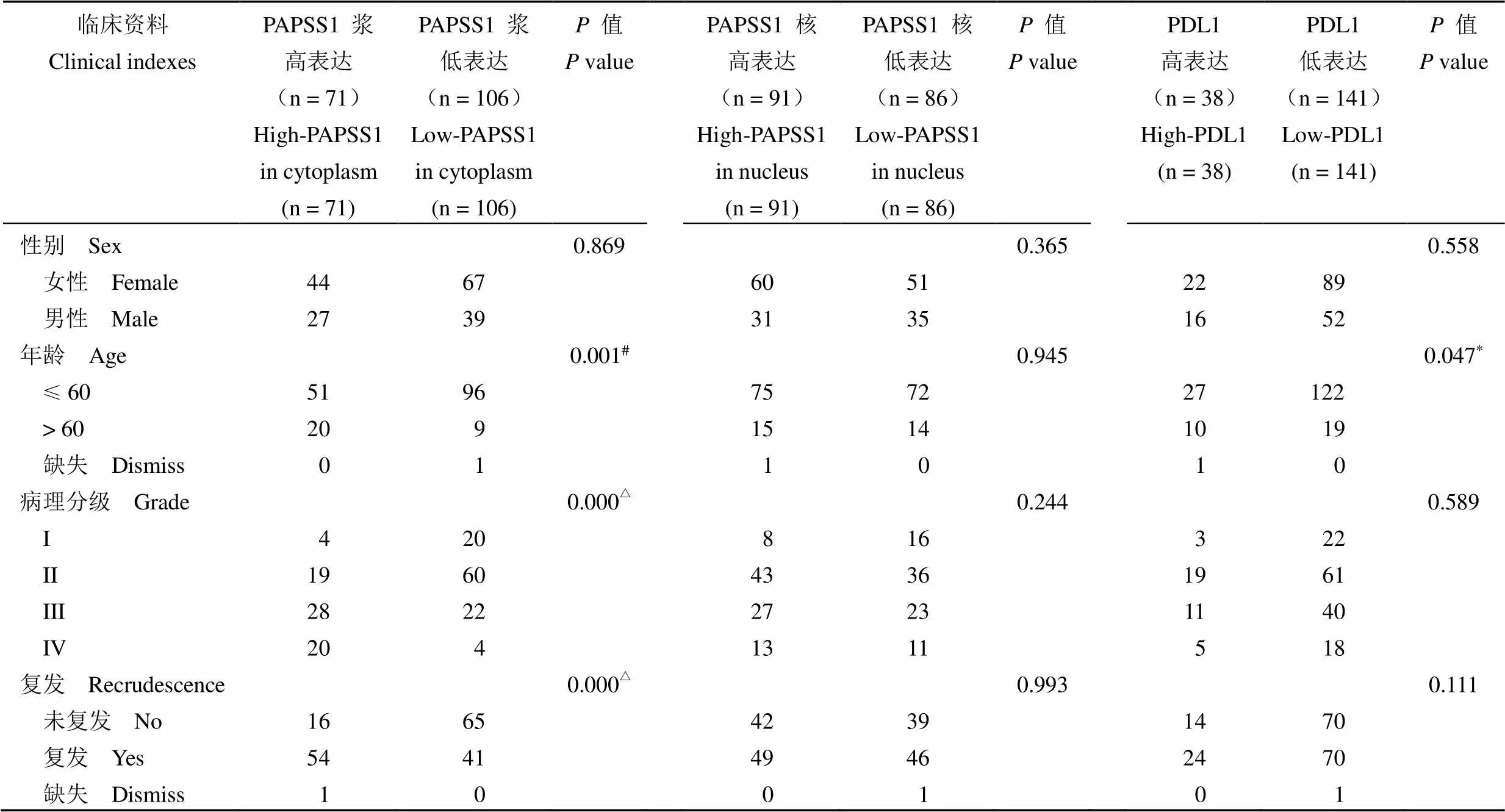
表 2 脑胶质瘤病人的临床指标和 PAPSS1、PDL1 表达的相关性分析
注:*< 0.05,#< 0.01,△< 0.001。
Note:*< 0.05,#< 0.01,△< 0.001.
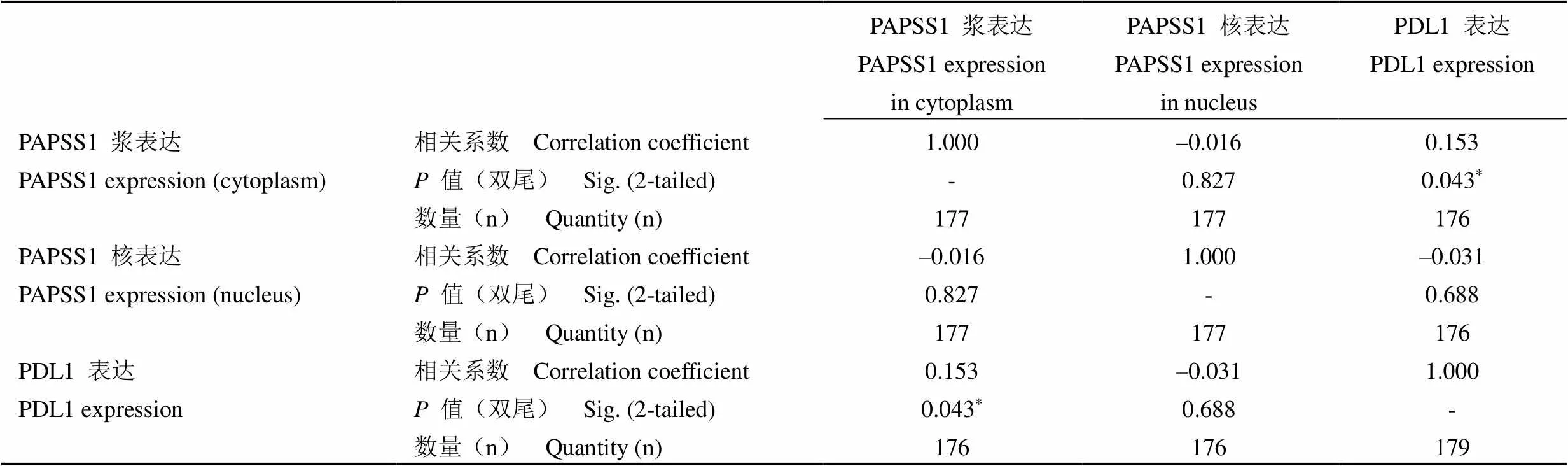
表3 PAPSS1 和 PDL1 在脑胶质瘤样本表达的相关性分析
注:*< 0.05,#< 0.01,△< 0.001。
Note:*< 0.05,#< 0.01,△< 0.001.
2.3 下调 PAPSS1 表达能减少 PDL1、ki67 和 Bcl2 等基因在脑胶质瘤细胞的表达水平
利用 qPCR 方法检测了 PDL1、促增殖基因ki67 和抗凋亡基因Bcl2 在转染 48 h 后的癌细胞中的表达变化。结果显示:和对照组相比,PDL1、ki67 和Bcl2 等基因的 mRNA 表达水平在两个转染 si-PAPSS1 的脑胶质瘤细胞中都出现了显著下调。其中,PDL1、ki67 和Bcl2 表达在细胞U87MG 分别降低了 43.6%(< 0.001)、20.1%(= 0.002)、32.0%(= 0.001),在细胞 U251MG 分别降低了 27.4%(< 0.001)、29.9%(< 0.001)、24.4%(= 0.030)(图 3)。
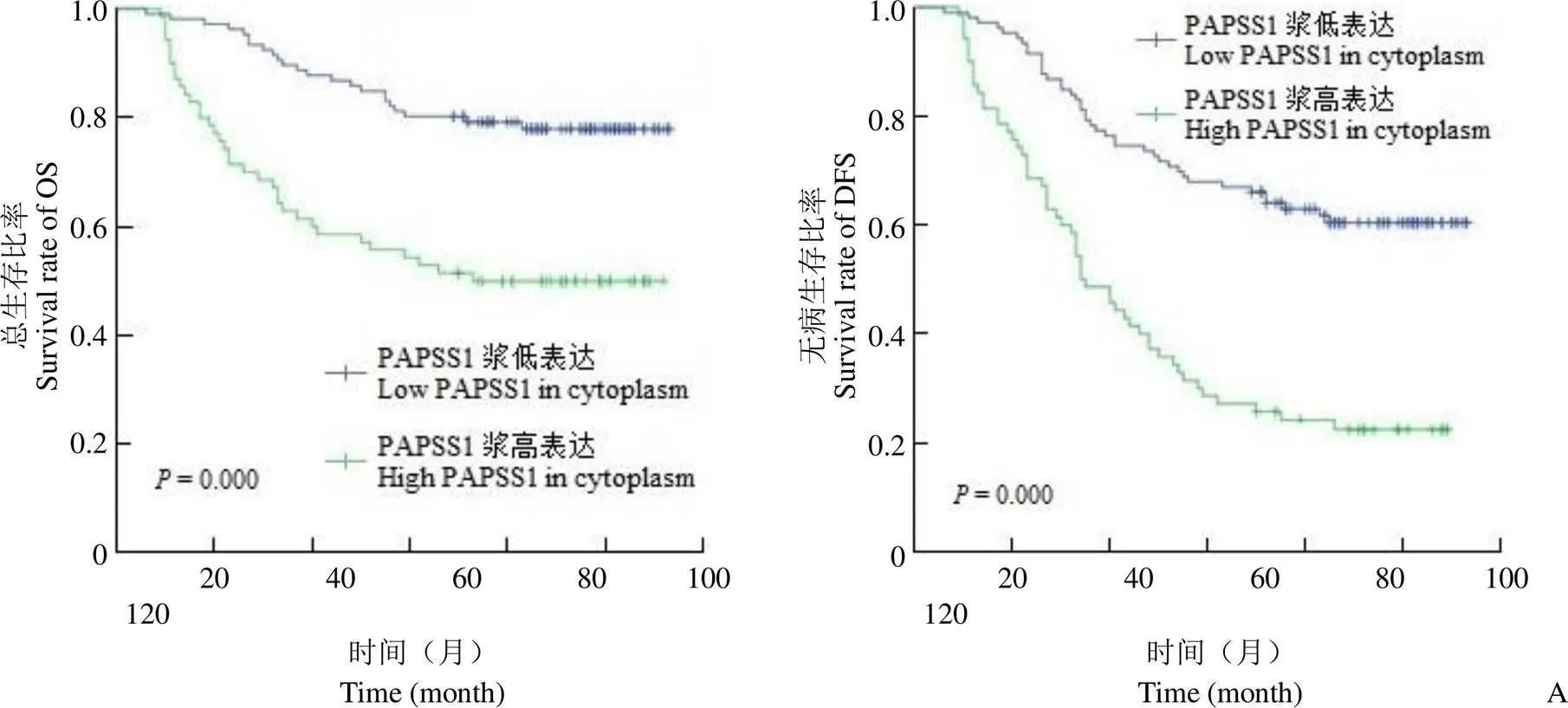
Figure 2 Kaplan-Meier and log-rank methods were used to analyze the correlation between protein expression and the prognosis of glioma patients (A: Glioma patients with high PAPSS1 expression in cytoplasm had significantly shorter overall survival and disease-free survival; B: There was no correlation ship between the nucleus expression of PAPSS1 and the overall survival, as well as disease-free survival of glioma; C: Expression of PDL1 was also uncorrelated with the overall survival and disease-free survival of glioma patients)
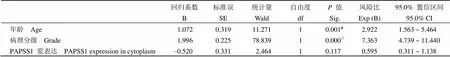
表 4 总生存期的 COX 多元回归分析
注:#< 0.01,△< 0.001。
Note:#< 0.01,△< 0.001.
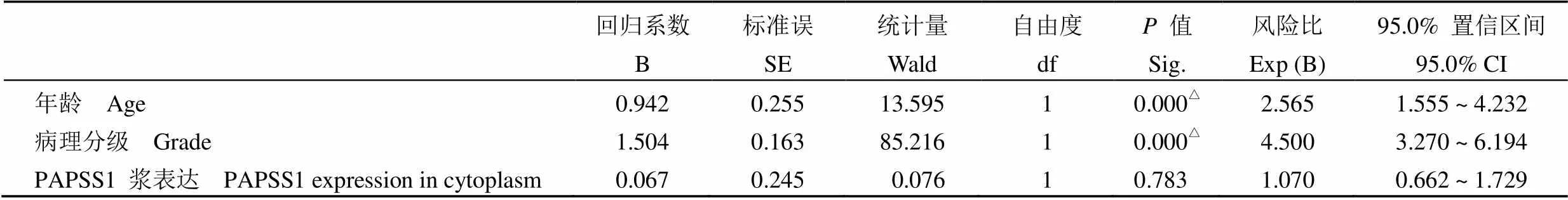
表 5 无病生存期的 COX 多元回归分析
注:△< 0.001。
Note:△< 0.001.
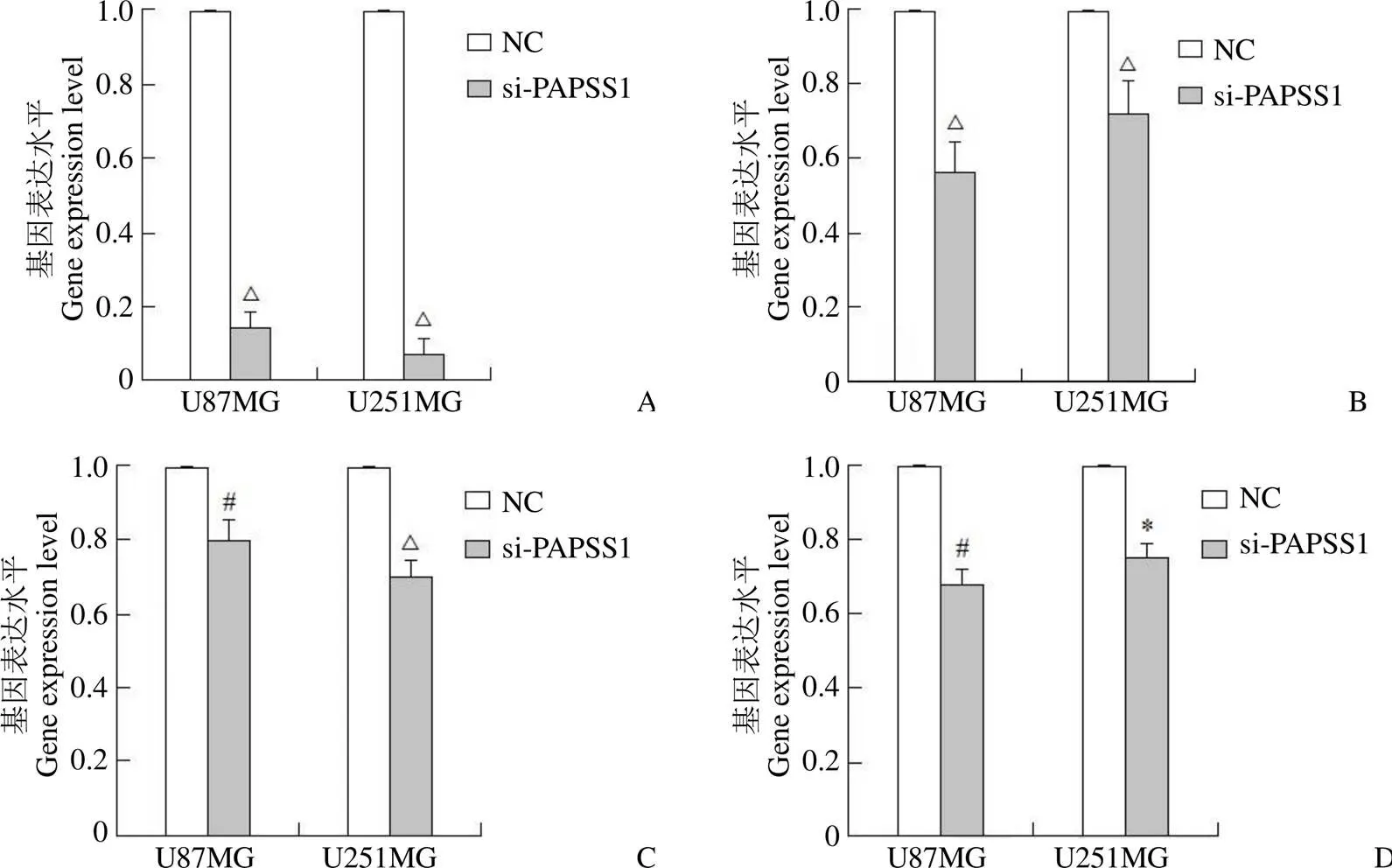
图 3 qPCR 实验结果显示,采用 si-PAPSS1 转染技术在减少 PAPSS1(A)在脑胶质瘤细胞表达的同时,也能显著降低 PDL1(B)、ki67(C)、Bcl2(D)的表达水平(*P < 0.05,#P < 0.01,△P < 0.001)
Figure 3 The qPCR results showed that PAPSS1 (A) expression was reduced by si-PAPSS1 transfection in glioma cells meanwhile the expression of PDL1 (B), ki67 (C) and Bcl2 (D) were also decreased significantly (*< 0.05,#< 0.01,△< 0.001)
3 讨论
脑胶质瘤组织芯片的 IHC 实验显示,PAPSS1 蛋白同时表达在细胞浆和细胞核中,这与Xu 等[11]关于乳腺癌的报道相一致。统计学分析显示,PAPSS1 浆表达和脑胶质瘤病人的年龄、病理分级、复发等显著正相关,且浆高表达的病人拥有显著更短的总生存期和无病生存期;而核表达却与各临床指标及预后都不相关。由此我们推测,PAPSS1 在脑胶质瘤细胞的不同表达定位可能发挥不同的作用,其浆表达能促进肿瘤的进展,而核表达则可能与肿瘤无关。类似的,关于卵巢癌的文献也显示,PAPSS1 高表达的卵巢癌病人拥有更差的无病生存期[13]。而关于肺癌的预后分析则显示了更加复杂的结论,即:在不区分治疗情况时,PAPSS1 高表达的肺癌病人拥有更长的总生存期;但是,当只分析接受化疗的肺癌病例时,PAPSS1 高表达的病人却显示了更差的预后。进一步的实验发现,PAPSS1 高表达能导致肺癌对于顺铂耐药,并可能因此降低了化疗病人的预后[12-13]。

图 4 细胞增殖实验和细胞凋亡实验(A:减少 PAPSS1 表达能显著抑制胶质瘤细胞的增殖;B:降低 PAPSS1 表达能显著促进胶质瘤细胞的凋亡;#P < 0.01,△P < 0.001)
Figure 4 Cell proliferation experiment and apoptosis experiment (A: Reducing the expression of PAPSS1 could significantly inhibit the proliferation of glioma cells; B: Down regulation of PAPSS1 could also significantly promote the apoptosis of glioma cell;#< 0.01,△< 0.001)
关于 PDL1 的 IHC 染色结果显示,PDL1 同时表达在脑胶质瘤组织的胞浆和胞膜,但仅有约 21% 的病例显示阳性,约 79% 的病例为阴性。事实上,前期的文献显示不同实验室检测到的 PDL1 在脑胶质瘤的表达水平差异巨大[15-17],这可能与使用的抗体及样本的不同、实验评分标准差异等有关。同样的,研究 PDL1 表达和胶质瘤预后的文献也非常多,但结论各不相同。其中的部分文献证实 PDL1 的表达与胶质瘤患者的预后负相关。例如,根据 TCGA(The Cancer Genome Atlas)和 CGGA(Chinese Glioma Genome Atlas)这两个数据库的 mRNA 数据的 Meta 分析发现,在分别涉及 976 名和 1052 名胶质瘤患者的两项研究中,PDL1 mRNA 高表达病人的总生存率均显著更短[18-19]。同时,多篇基于IHC 实验数据的研究也得到了与上述文献类似的结论[20-23]。然而,另有研究报道认为PDL1 表达与脑胶质瘤的预后无关。例如,基于 TCGA 数据库的 IHC 数据分析认为 PDL1 表达与脑胶质瘤患者的总生存期之间没有显著相关性[24-25]。而我们关于 PDL1 的 IHC 实验数据分析显示:PDL1 表达只和患者的年龄显著正相关,而和总生存期及无病生存期均没有相关性。有趣的是,Spearman 分析显示,PDL1 表达和 PAPSS1 浆表达显著正相关,而与 PAPSS1 核表达无关。我们猜测,PDL1 可能参与了 PAPSS1 的促癌过程。
采用 siRNA 技术沉默了 PAPSS1 基因的部分表达,使其在脑胶质瘤细胞 U87MG 和 U251MG 的抑制效率分别达到了84.8% 和 92.5%。随后的细胞学实验显示,与对照组相比,PAPSS1 基因的下调显著抑制了 2 个肿瘤细胞的增殖而促进了细胞凋亡。同时,qPCR 实验也发现,si-PAPSS1 转染在下调 PAPSS1 表达的同时,也显著减少了 PDL1、促增殖基因 ki67 和抗凋亡基因Bcl2 等的表达,这也提示了 PAPSS1 的促癌作用。前期关于乳腺癌的文献[11]也报道了 PAPSS1 表达和增殖凋亡信号通路基因的表达存在一定相关性——在添加雌激素时,SULT1E1 和(或)PAPSS1 的过度表达能阻断雌激素对于乳腺癌细胞的促增殖作用,并促进 H2O2诱导的细胞凋亡;上述抑癌功能可能通过下调 C-myc、Cyclin D1、Bcl2 等基因来完成。
总之,我们的实验研究发现 PAPSS1 浆表达与脑胶质瘤病人的年龄、病理分级、复发和预后等指标都显著相关,降低 PAPSS1 的表达能抑制肿瘤细胞的增殖并促进凋亡,还能显著降低ki67、Bcl2等基因的表达水平。这些实验结果均证实了 PAPSS1 对于脑胶质瘤的促癌功能。另外,我们还发现 PAPSS1 表达与 PDL1 表达显著相关,降低癌细胞的PAPSS1 表达水平也会抑制 PDL1 的表达,这其中的机制可能关系到病人的个性化治疗,值得我们进一步研究和探讨。
志谢 感谢实验室工作人员对本研究实验过程的支持和协助;感谢综合管理部对本研究所用试剂耗材的采购和管理;最后,感谢国家重点研发计划和国家科技重大专项对本文的经费支持。
[1] Goodenberger ML, Jenkins RB. Genetics of adult glioma. Cancer Genet, 2012, 205(12):613-621.
[2] Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol, 2007, 114(2):97-109.
[3] Ohgaki H, Kleihues P. Population-based studies on incidence, survival rates, and genetic alterations in astrocytic and oligodendroglial gliomas. J Neuropathol Exp Neurol, 2005, 64(6):479-489.
[4] Bleeker FE, Molenaar RJ, Leenstra S. Recent advances in the molecular understanding of glioblastoma. J Neurooncol, 2012, 108(1): 11-27.
[5] Smoll NR, Gautschi OP, Schatlo B, et al. Relative survival of patients with supratentorial low-grade gliomas. Neuro Oncol, 2012, 14(8): 1062-1069.
[6] Wen PY, Kesari S. Malignant gliomas in adults. N Engl J Med, 2008, 359(5):492-507.
[7] Schröder E, Gebel L, Eremeev AA, et al. Human PAPS synthase isoforms are dynamically regulated enzymes with access to nucleus and cytoplasm. PLoS One, 2012, 7(1):e29559.
[8] Xu ZH, Otterness DM, Freimuth RR, et al. Human 3'-phosphoadenosine 5'-phosphosulfate synthetase 1 (PAPSS1) and PAPSS2: gene cloning, characterization and chromosomal localization. Biochem Biophys Res Commun, 2000, 268(2):437-444.
[9] Shih WL, Yu MW, Chen PJ, et al. Evidence for association with hepatocellular carcinoma at the PAPSS1 locus on chromosome 4q25 in a family-based study. Eur J Hum Genet, 2009, 17(10):1250-1259.
[10] Bruce JW, Ahlquist P, Young JA. The host cell sulfonation pathway contributes to retroviral infection at a step coincident with provirus establishment. PLoS Pathog, 2008, 4(11):e1000207.
[11] Xu Y, Liu X, Guo F, et al. Effect of estrogen sulfation by SULT1E1 and PAPSS on the development of estrogen-dependent cancers. Cancer Sci, 2012, 103(6):1000-1009.
[12] Leung AWY, Dragowska WH, Ricaurte D, et al. 3'-Phosphoadenosine 5'-phosphosulfate synthase 1 (PAPSS1) knockdown sensitizes non-small cell lung cancer cells to DNA damaging agents. Oncotarget, 2015, 6(19):17161-17177.
[13] Leung AWY, Veinotte CJ, Melong N, et al. In vivo validation of PAPSS1 (3'-phosphoadenosine 5'-phosphosulfate synthase 1) as a cisplatin-sensitizing therapeutic target. Clin Cancer Res, 2017, 23(21): 6555-6566.
[14] Li W, Jia H, Li Q, et al. Glycerophosphatidylcholine PC (36:1) absence and 3′-phosphoadenylate (pAp) accumulation are hallmarks of the human glioma metabolome. Sci Rep, 2018, 8(1):14783.
[15] Garber ST, Hashimoto Y, Weathers SP, et al. Immune checkpoint blockade as a potential therapeutic target: surveying CNS malignancies. Neuro-Oncol, 2016, 18(10):1357-1366.
[16] Hodges TR, Ott M, Xiu J, et al. Mutational burden, immune checkpoint expression, and mismatch repair in glioma: implications for immune checkpoint immunotherapy. Neuro Oncol, 2017, 19(8): 1047-1057.
[17] Berghoff AS, Kiesel B, Widhalm G, et al. Correlation of immune phenotype with IDH mutation in diffuse glioma. Neuro Oncol, 2017, 19(11):1460-1468.
[18] Wang Z, Zhang C, Liu X, et al. Molecular and clinical characterization of PD-L1 expression at transcriptional level via 976 samples of brain glioma. Oncoimmunology, 2016, 5(11):e1196310.
[19] Xue S, Song G, Yu J. The prognostic significance of PD-L1 expression in patients with glioma: a meta-analysis. Sci Rep, 2017, 7(1):4231.
[20] Nduom EK, Wei J, Yaghi NK, et al. PD-L1 expression and prognostic impact in glioblastoma. Neuro Oncol, 2016, 18(2):195-205.
[21] Han J, Hong Y, Lee YS. PD-L1 expression and combined status of PD-L1/PD-1-positive tumor infiltrating mononuclear cell density predict prognosis in glioblastoma patients. J Pathol Transl Med, 2017, 51(1):40-48.
[22] Lee KS, Lee K, Yun S, et al. Prognostic relevance of programmed cell death ligand 1 expression in glioblastoma. J Neurooncol, 2018, 136(3): 453-461.
[23] Pratt D, Dominah G, Lobel G, et al. Programmed death ligand 1 is a negative prognostic marker in recurrent isocitrate dehydrogenase- wildtype glioblastoma. Neurosurgery, 2019, 85(2):280-289.
[24] Berghoff AS, Kiesel B, Widhalm G, et al. Programmed death ligand 1 expression and tumorinfiltrating lymphocytes in glioblastoma. Neuro Oncol, 2015, 17(8):1064-1075.
[25] Miyazaki T, Ishikawa E, Matsuda M, et al. Assessment of PD-1 positive cells on initial and secondary resected tumor specimens of newly diagnosed glioblastoma and its implications on patient outcome. J Neurooncol, 2017, 133(2):277-285.
The correlation between PAPSS1 expression and the clinical indicators as well as the prognosis of glioma patients and its effect on cell proliferation and apoptosis
SHEN Xiao-ying, HU Ze-bin, ZHANG Xiao-yan, ZHU Zhi-dong, QI Yao, CHEN Ming-min, YANG Guo-cui, LIU Jing-jing,REN Yan, XU Cheng-xiang, GAO Heng-jun
Shanghai Outdo Biotech CO., LTD., Shanghai 201203, China (SHEN Xiao-ying, ZHANG Xiao-yan, ZHU Zhi-dong, QI Yao, CHEN Ming-min, YANG Guo-cui, LIU Jing-jing, REN Yan, XU Cheng-xiang, GAO Heng-jun); Institute of In-vitro Diagnostic Reagents in National Institutes for Food and Drug Control, Beijing 100850, China (HU Ze-bin)
To investigate the correlation between PAPSS1 expression and the clinical indicators as well as the prognosis of glioma patients, and its effect on cell proliferation and apoptosis.IHC was used to detect the protein expression of PAPSS1 and PDL1 in glioma samples, then the staining scores were analyzed by SPSS software. Spearman method was used to analyze the correlation between PAPSS1 and PDL1, so did the relationship between the protein expression and clinical indicators. Kaplan-Meier and log-rank test were used to analyze the univariate survival, then the statistically significant variables were all included in COX multiple regression survival analysis. After that, siRNA technology was used to reduce the expression of PAPSS1 in glioma cells. After transfection for 48 hours, the cell proliferation was detected by MTT assay, the apoptosis rate was examined by Hochest/PI assay, and the expression of PAPSS1,PDL1, ki67 and Bcl2 were all detected by qPCR technology. These experimental data were analyzed by GraphPad software.< 0.05 was statistically significant.The data from IHC analysis showed that the cytoplasmic expression of PAPSS1 in cancer tissues was positively correlated with age, pathological grade and recurrence, while the nuclear expression was not related to any clinical index and PDL1 expression was only related to age. The results from survival analysis showed that glioma patients with high cytoplasmic PAPSS1 had worse overall survival and disease-free survival; while the nuclear expression of PAPSS1 was not associated with the prognosis and so was PDL1. Subsequently, siRNA reduced the expression of PAPSS1 in glioma cells, then decreased cell proliferation rate but increased the apoptosis rate. At the same time, the mRNA expression level of PDL1, ki67 and Bcl2 were all significantly down regulated.PAPSS1 expression in cytoplasm is significantly correlated with age, pathological grade, recurrence and shorter prognosis of glioma patients. Reducing PAPSS1 expression could inhibit tumor cell proliferation and promote cell apoptosis, meanwhile significantly down regulate PDL1, ki67 and Bcl2. These results demonstrated that PAPSS1 could promote glioma. It was worth noting that the cytoplasmic expression of PAPSS1 was also positively correlated with the expression of PDL1 in glioma sample and reducing PAPSS1 in tumor cell could also inhibit PDL1, all of which might be related to the personalized treatment of glioma and was worthy of further study.
PAPSS1; brain glioma; cell proliferation; cell apoptosis
GAO Heng-jun, Email: hengjun_gao@shbiochip.com
10.3969/j.issn.1673-713X.2021.06.005
国家重点研发计划(2017YFC0908403、2018YFC1200503、2017YFC0908303);国家科技重大专项(2018ZX10302207-003-005)
郜恒骏,Email:hengjun_gao@shbiochip.com
2021-04-16
*同为第一作者

