miR-148a-3p通过抑制lL-12/lL-12R β1/lL-12R β2/lFN- γ通路抑制Th1细胞极化
张 晗,李 雪,刘元林,刘伟江,王 洋,白海涛,张金霞,苏菲娅,袁福临,李 露,孟广雨,郑荣秀,张 毅
(1.天津医科大学总医院儿科,天津 300052;2.军事科学院军事医学研究院辐射医学研究所,北京 100850)
免疫系统是机体重要的生理防线,免疫系统活化产生免疫细胞及相关细胞因子,识别并清除外来病原体、自身产生的损伤细胞或肿瘤细胞,发挥免疫监视、防御和调控等作用,维持机体内环境稳定和机体健康。CD4+T细胞在获得性免疫反应和免疫调节中处于重要地位,具有高度可塑性,能通过识别不同的T细胞(抗原)受体(T cell receptor,TCR)抗原信号和共刺激信号,活化为1型辅助性T细胞(type 1 helper T cells,Th1细胞)、Th2细胞、Th17细胞、调节性T细胞或滤泡辅助性T细胞等多种Th细胞亚群[1-2],发挥免疫调控作用,共同维持机体免疫平衡。
Th1细胞是参与适应性免疫应答的重要免疫细胞,可经白细胞介素12(interleukin-12,IL-12)/信号转导与转录激活因子4(signal transducer and activator of transcription 4,STAT4)/T细胞介导的转录调节因21(T-box transcription factor 21,Tbx21)通 路 和 TCR/干 扰 素 γ(interferon-γ,IFN-γ)/STAT1/Tbx21通路诱导活化[3],特异性表达并分泌促炎因子IFN-γ,启动炎症反应,激活机体对病原体的防御作用。Th1细胞的异常活化与多种免疫平衡失调所致疾病如过敏反应、系统性红斑狼疮、急性移植物抗宿主病、多发性硬化和1型糖尿病(type I diabetes,T1DM)等相关[4-5]。流行病学调查研究表明,目前在全球范围内,自身免疫性疾病总的发病率约为0.09%,患病率为7.6%~9.4%[6]。目前临床上用于治疗免疫紊乱所致自身免疫性疾病常依赖于激素类药物或免疫抑制剂,但常伴发耐药性和长期免疫抑制所致感染等问题。据此,探究Th1细胞极化的可控性有助于阐明免疫平衡的维持机制和自身免疫性疾病的发病机制。
微 RNA(microRNA,miR)是一类长度21~25 nt(nucleotide)的非编码小RNA分子,通过与靶基因mRNA碱基互补配对的方式形成RNA诱导沉默复合体(RNA-induced silencing complex),抑制蛋白翻译并特异性地引导靶mRNA分子降解,从而调控靶基因的转录后表达[7]。在生物体发育、细胞凋亡、细胞增殖、免疫和神经系统模式形成等生命过程中,miRNA的表达和调控发挥至关重要的作用,其表达异常可能与多种疾病发生相关。
T1DM是由异常活化的免疫反应损伤胰岛β细胞所致[8],在青少年群体中较为多发。经典的T1DM小鼠模型是链脲佐菌素(streptozotocin,STZ)特异性损伤小鼠胰岛β细胞进而引发异常的免疫反应所致。在STZ诱导的T1DM模型小鼠体内,Th1细胞亚群显著增加,异常的Th1细胞活化是诱发细胞因子风暴、导致持续免疫反应并最终导致胰岛β细胞功能缺失的关键因素。本实验室前期针对T1DM的发病机制研究发现,miR-148a-3p可能抑制小鼠Fas配体和IFN-γ表达[9],具有抑制炎症反应进程并缓解T1DM病程发展的作用。本研究通过体外诱导初始CD4+(naïve CD4+)Th细胞向Th1细胞极化,诱导过程中转染miR-148a-3p模拟物,探讨miR-148a-3p对细胞极化调控分子机制,为阐明T1DM的发病机制提供新的理论和实验依据。
1 材料与方法
1.1 动物、细胞、试剂和主要仪器
6周龄SPF级雄性C57BL/6J小鼠,斯贝福(北京)生物技术有限公司,动物合格证SCXK(京)019-0010,所有动物实验过程经军事医学研究院实验动物伦理委员会批准,编号IACUC-DWZX-2020-735。人宫颈癌HeLa细胞,本所实验血液学与生物化学研究室细胞库。RPMI 1640培养基、DMEM培养基、胰酶、PBS和非必需氨基酸,美国Gibco公司;胎牛血清(fetal bovine serum,FBS),德国PAN公司;小鼠naïve CD4+Th细胞分选试剂盒(货号130-104-453),德国Miltenyi Biotec公司;小鼠脾淋巴细胞分离液,中国灏洋华科生物科技有限公司;抗小鼠IL-4,CD28和CD3ε单克隆抗体及重组IL-2和IL-12抗体,美国Tonbo Biosciences公司;Trizol,Triton和Tween-20,美国Sigma公司;40%中性甲醛,国药集团化学试剂有限公司;兔抗小鼠STAT4单克隆抗体(2653S),美国 Cell Signaling Technology(CST)公司;小鼠抗小鼠磷酸化STAT4(phosphorylated STAT4,p-STAT4)单克隆抗体(SC-28296),美国Santa Cruz Biotechnology公司;DAB显色剂、流式用抗体 PE-抗小鼠 CD4(12-0043-82)和APC-抗IFN-γ(47-7311-82)单克隆抗体,美国Thermo Fisher Scientific公司;MMLV逆转录酶、5×RTase MMLV缓冲液、Oligo dT、dNTP和RNA酶抑制剂,日本TaKaRa公司;辣根过氧化物酶标记的山羊抗兔和山羊抗小鼠IgG抗体及二硫苏糖醇(DTT)、无RNA酶水、5×上样缓冲液和实时荧光定量PCR预混体系,康为世纪有限公司;阳离子聚合物转染试剂,法国Polyplus公司;双荧光素酶报告基因检测试剂盒(E1910),美国Promega公司;miR-148a-3p模拟物(表1)和PCR引物(表2)由上海生工生物有限公司合成。CKX53倒置相差显微镜和CK33显微镜,日本Olympus公司;QuantStudio1荧光定量PCR仪和Heraeus Fresco 21高速冷冻离心机,美国Thermo Fisher公司;Veriti96 PCR扩增仪,中国Blue-Ray公司;流式细胞仪,美国Becton Dickinson公司。
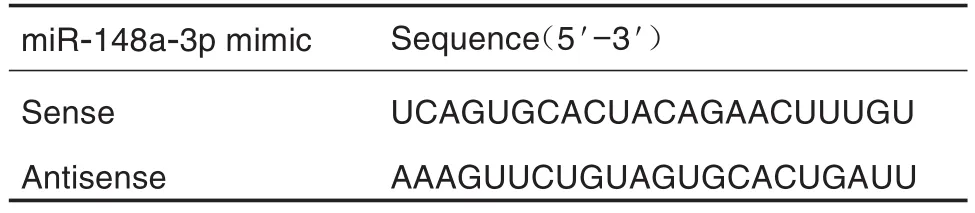
Tab.1 Sequence of miR-148a-3p mimic

Tab.2 Primer sequence for PCR
1.2 免疫磁珠阴性分选法分选naïve CD4+Th细胞
颈椎脱臼法处死小鼠,无菌条件下解剖分离脾,置200目筛网,边研磨边加入PBS冲洗,使分离的单个脾细胞通过筛网,移入离心管中,450×g离心10 min,弃上清,稀释液重悬后用小鼠脾细胞分离液分离获得脾单个核细胞。
在分离的小鼠脾单个核细胞中加入小鼠naïve CD4+Th细胞分选试剂盒中生物素标记的Miltenyi鸡尾酒抗体,4℃孵育5 min后加入抗生物素单克隆抗体耦联磁珠和抗CD44单克隆抗体耦联磁珠,继续置4℃孵育10 min;300×g离心10 min,弃上清重悬。经磁性分离柱吸附,流出为naïve CD4+Th细胞。分选方法按Miltenyi naïve CD4+Th细胞分选试剂盒说明书进行。
1.3 诱导naïve CD4+T细胞向Th1细胞极化
实验前1d将抗小鼠CD3ε单克隆抗体(1mg·L-1)包被6孔板,次日接种新鲜分离的naïve CD4+Th细胞(1×109L-1)于含10% FBS的RPMI 1640完全培养基,加Th1细胞极化诱导剂(抗小鼠CD28单克隆抗体0.5 mg·L-1、抗小鼠IL-4单克隆抗体1 mg·L-1、IL-2 5 μg·L-1、IL-12 10 μg·L-1、1% 非必需氨基酸和 β-巯基乙醇 55 μmol·L-1),置 37°C,5% CO2条件下培养96 h,每隔36 h半量换液补充Th1细胞极化诱导剂[10](正常诱导组)。
取miR-148a-3p模拟物溶解于DEPC水125 μL,使 其 终浓 度为 20 μmol·L-1。 取 稀释 好的 miR-148a-3p模拟物溶解于Jet Prime转染缓冲液50 μL中,按1∶3(V/V)加Jet,组装成脂质体复合物,miR-148a-3p模拟物转染后终浓度30 nmol·L-1,将含miR-148a-3p模拟物的脂质体复合物转染至向Th1细胞诱导极化的naïve CD4+Th细胞中,转染12 h后更换完全培养基(miR-148a-3p诱导组)。
1.4 流式细胞术检测Th1细胞极化百分比
在naïve CD4+Th细胞向Th1细胞极化诱导培养的终点收取细胞,加PE-抗小鼠CD4单克隆抗体,置4℃避光孵育30 min;PBS洗涤,离心后加4%中性甲醛固定10 min;用含0.1%Triton的PBS破膜10 min,用含0.1%Tween-20的PBS洗涤;加APC-抗小鼠IFN-γ单克隆抗体于4℃孵育30 min;离心、洗涤后加入PBS,上机检测CD4和IFN-γ双阳性(CD4+IFN-γ+)细胞百分比,即Th1细胞极化百分比。
1.5 实时定量PCR检测Th1细胞极化相关基因mRNA的表达
在naïve CD4+Th细胞向Th1极化诱导培养的终点收取细胞,TRIzol法提取总mRNA,用1 μg总RNA定量逆转录生成cDNA,实时荧光定量PCR检测INF-γ,STAT1,STAT4,Tbx21,IL-12Rβ1和IL-12Rβ2mRNA表达水平。反应体系:cDNA 1 μL,上、下引物(10 μmol·L-1)1 μL,实时荧光定量 PCR预混体系 10 μL 和无 RNA 酶水 8 μL;反应条件:95℃ 10 min,95℃ 15 s,60℃ 1 min,共40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。GAPDH作为内参,采用2-△Ct法计算待测基因mRNA表达水平。
1.6 Western印迹法检测Th1细胞STAT4和p-STAT4蛋白表达
在naïve CD4+Th细胞向Th1极化诱导培养的终点收取细胞,经PBS洗涤后加细胞裂解液于冰上吹打裂解细胞,16 200×g离心15 min收集上清,经BCA测定蛋白质浓度后,加5×上样缓冲液煮沸后离心,取蛋白质样品20 μg电泳,经10%SDS-PAGE凝胶电泳后转移至PVDF膜,5%脱脂奶粉室温封闭1 h。兔抗小鼠STAT4,p-STAT4及GAPDH抗体(稀释比1∶1000)4℃孵育过夜,TBST洗膜3次,加对应山羊抗兔或山羊抗小鼠lgG抗体,室温孵育1 h,TBST洗膜3次后进行ECL化学发光显影,使用Image J软件进行半定量分析,以目标蛋白条带与内参蛋白条带积分吸光度比值表示STAT4和p-STAT4蛋白相对表达水平。
1.7 双荧光素酶报告载体构建和检测
经生物信息学分析预测miR-148a-3p对IL-12/IL-12Rβ1/IL-12Rβ2/IFN-γ通路分子IL-12Rβ1,IL-12Rβ2,Tbx21和STAT4的靶标序列,用psiCHECK2双荧光素酶报告载体,分别构建IL-12Rβ1,IL-12Rβ2,Tbx21和STAT4的3′UTR序列(psi-wt)及靶标点突变序列(psi-mutant)的克隆载体。
将psi-wt和psi-mutant载体分别与miR-148a-3p模拟物共转染至Hela细胞中,转染前1 d将HeLa细胞接种于96孔板,加入含10%FBS的DMEM完全培养基100 μL,待细胞密度汇合至约50%进行转染。分别取psi-wt和psi-mutant载体25 ng及miR-148a-3p模拟物1 μL混合稀释于20 μL阳离子聚合物转染试剂缓冲液中,加入2 μL阳离子聚合物转染试剂混合均匀,室温下静置10 min,形成脂质体复合物,加DMEM完全培养基80 μL,滴加待转染细胞培养体系内,控制miR-148a-3p模拟物终浓度为10 nmol·L-1。置37℃,5% CO2孵箱培养,于转染后12 h更换完全培养基,36 h后收取细胞,制备细胞裂解液,用TECAN酶标仪进行荧光素酶报告基因检测。荧光素酶报告基因荧光强度表示靶基因表达水平。
1.8 统计学分析
实验结果数据以±s表示,经SPSS 22.0统计软件进行数据分析,各组间比较采用t检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 miR-148a-3p抑制Th1细胞极化
利用CD4免疫磁珠阴性筛选法分选C57BL/6J小鼠脾单个核细胞,获得小鼠naïve CD4+Th细胞,naïveCD4+Th细胞属于CD4+CD25-CD44lowCD62Lhigh亚群。流式细胞术检测结果显示,分离获得的细胞高表达CD62L,提示成功分离获得小鼠naïve CD4+Th细胞(图1A)。用IL-12和IL-2及抗小鼠IL-4,CD28和CD3ε单克隆抗体混合因子培养体系诱导小鼠naïve CD4+Th细胞向Th1细胞极化(正常诱导组),在诱导体系内加miR-148a-3p模拟物,用流式细胞术检测CD4+IFN-γ+细胞百分比。结果表明,正常诱导组Th1细胞极化可达(71±5)%,而miR-148a-3p模拟物转染后Th1细胞百分比显著下降至(61±3)%(P<0.05)(图1B)。
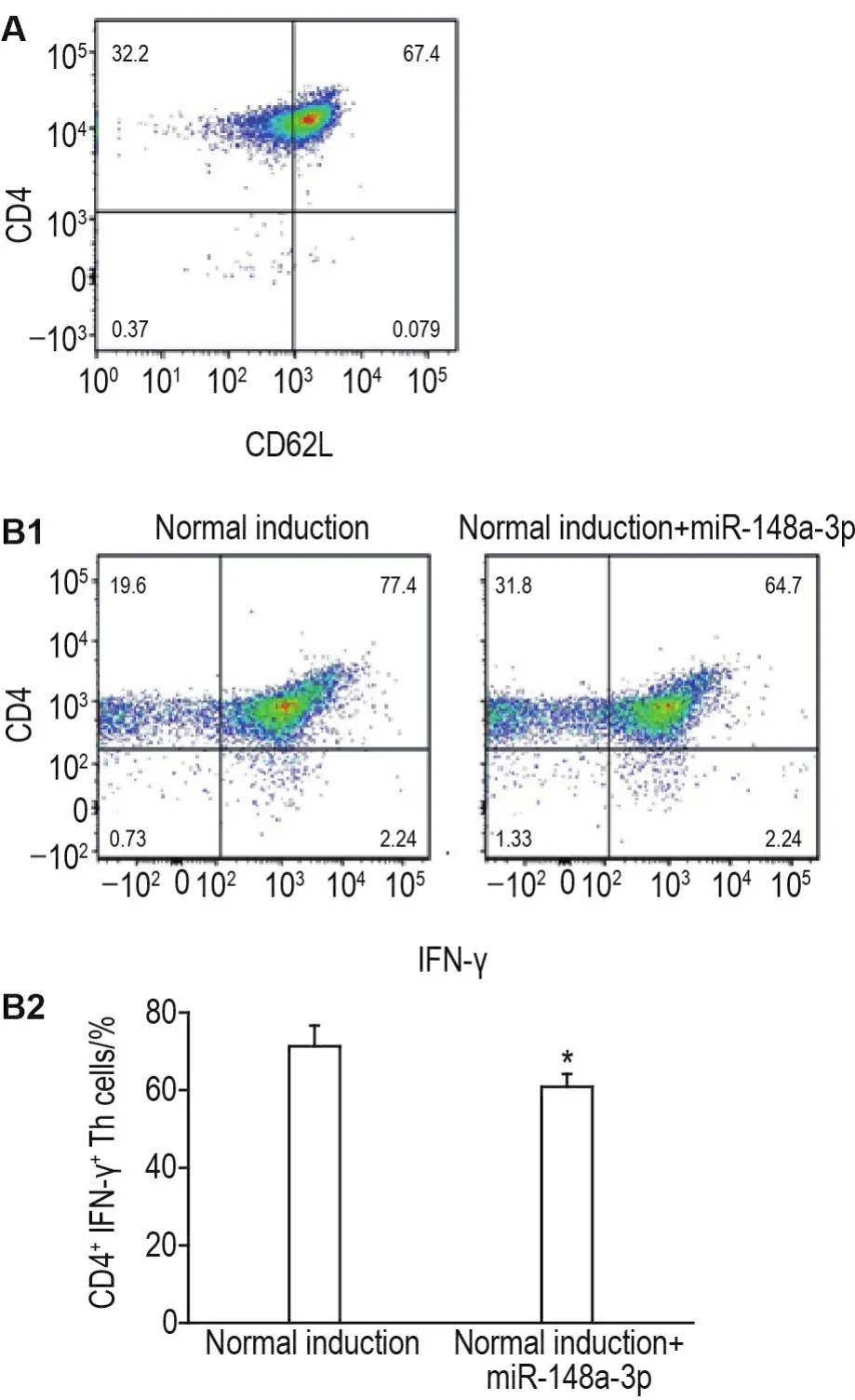
Fig.1 Naïve CD4+Th cells isolated from mouse spleen(A)and inhibition of miR-148a-3p on Th1 cell polarization(B)detected by flow cytometry.B1:CD4+IFN-γ+cells analyzed by flow cytometry;B2:the quantitative result of B1.±s,n=3.*P<0.05,compared with normal induction group.
2.2 miR-148a-3p抑制Th1细胞lL-12/lL-12R β1/lL-12R β2/lFN- γ通路分子的表达
用实时荧光定量PCR对Th1细胞极化所必需的IL-12/IL-12Rβ1/IL-12Rβ2/IFN-γ通路细胞因子mRNA进行检测。结果表明,naïve CD4+Th细胞经miR-148a-3p转染后,Th1极化关键细胞因子IFN-γ(P<0.01)及关键转录因子STAT1(P<0.01)表达显著下调,IL-12通路激活的正反馈关键受体IL-12Rβ1(P<0.05)和IL-12Rβ2(P<0.01)的表达水平也显著低于正常诱导组;同时,IL-12/IL-12Rβ1/IL-12Rβ2/IFN-γ通路活化的关键转录因子STAT4(P<0.01)和Tbx21(P<0.05)表达水平亦显著下调(图2)。

Fig.2 lnhition of miR-148a-3p transfection on mRNA levels of IFN- γ,STAT1,STAT4,Tbx21,IL-12R β1and IL-12R β2in Th1 cells measured by q-PCR.±s,n=3.*P<0.05,**P<0.01,compared with normal induction group.
Western印迹结果显示,miR-148a-3p转染后,Th1细胞极化关键转录因子STAT4蛋白表达水平显著下调(P<0.05),p-STAT4蛋白水平也显著低于正常诱导组(P<0.01)(图3)。

Fig.3 lnhition of miR-148a-3p transfection on protein levels of STAT4 and phosphorylated STAT4(p-STAT4)in Th1 cells detected by Western blotting.B was the semiquantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with normal induction group.
2.3 miR-148a-3p抑制Th1细胞lL-12/lL-12R β1/lL-12R β2/lFN- γ通路的作用靶标
经生物信息学分析发现,miR-148a-3p对Th1极化所必需的 IL-12/IL-12Rβ1/IL-12Rβ2/IFN-γ通路分子 STAT4,Tbx21,IL12Rβ1和 IL12Rβ2的3′UTR序列存在特异性结合靶点,分别将STAT4,Tbx21,IL-12Rβ1和IL-12Rβ2的3′UTR序列克隆插入到psiCHECK2载体的密码子人源化海肾荧光素酶报告基因(human codon optimized-Renillaluciferase,hRluc)的3′UTR区域(图4A),同时将miR-148a-3p作用的靶序列进行点突变(图4B)后,插入到psiCHECK2载体的报告基因hRluc的3′UTR区域,psiCHECK2内含密码子人源化萤火虫荧光素酶基因(hluc+)作为内参对照。将psi-wt和psi-mutant载体分别与miR-148a-3p模拟物共同转染至人宫颈癌Hela细胞中,转染36 h后裂解细胞用TECAN酶标仪进行双荧光素酶报告基因检测。hRluc与hluc+荧光强度比值反映miR-148a-3p对靶标序列表达的调控(图4C)。结果表明,miR-148a-3p模拟物转染可降低含STAT4序列的hRluc的表达水平(P<0.01);而STAT4序列突变后,miR-148a-3p模拟物转染并未降低hRluc的表达水平。同样,miR-148a-3p模拟物转染后,含Tbx21(P<0.01)序列的hRluc的表达水平降低,含IL-12Rβ1(P<0.01)和IL-12Rβ2(P<0.05)序列的hRluc表达水平亦受转染miR-148a-3p模拟物的影响而下调。

Fig.4 Targets of miR-148a-3p inhibiting activation of lL-12/lL-12R β1/lL-12R β2/lFN- γ pathway.The target sequence(A)and the mutant sequence(B)of STAT4,Tbx21,IL-12Rβ1 and IL-12Rβ2were inserted into the 3′UTR of hRluc in psiCHECK2 vector,respectively;C:the hRluc expression was regulated by the target sequence.The hluc+expression was control.The fluorecent intensity(FI)ratio of hRluc to hluc+reported the expression levels of STAT4,Tbx21,IL-12Rβ1and IL-12Rβ2.±s,n=3.*P<0.05,**P<0.01,compared with psi-wt group.
3 讨论
T1DM是典型的自身免疫系统紊乱所导致的器官特异性损伤,胰岛β细胞不可逆损伤、胰岛素绝对缺乏导致出现高血糖等症状。促炎因子的产生和分泌及炎症细胞活化是诱发T1DM的关键因素。Th1细胞极化与关键促炎因子IFN-γ的产生在炎症发生早期发挥重要功能,是启动炎症反应、驱动适应性免疫应答的关键免疫细胞和免疫因子。Th1的异常活化可启动异常免疫反应,导致免疫功能失衡和多种自身免疫性疾病,甚至引发细胞因子风暴综合征,造成多器官功能损伤甚至衰竭[11-12]。据此,维持免疫系统平衡、抑制异常活化的Th1细胞所诱发的免疫反应,对于防治免疫紊乱所致的T1DM等自身免疫性系统疾病具有重要意义。
Th1细胞极化受IL-12和IFN-γ诱导调控,其特异性表达的IFN-γ是炎症反应的关键细胞因子,在启动炎症反应、激活机体对病原体的防御作用等过程中发挥重要功能。IL-12/IL-12Rβ1/IL-12Rβ2/IFN-γ介导的经典 Janus激酶(Janus Kinase,JAK)/STAT信号通路,在Th1细胞极化过程中发挥重要作用。IL-12/IL-12Rβ1/IL-12Rβ2激活后,p-STAT1和p-STAT4分别二聚入核而启动下游基因IFN-γ表达,并促进Th1细胞极化相关基因表达[13-14]。Th1分泌的IFN-γ是炎症反应早期的重要促炎因子,决定炎症反应进程,可激活巨噬细胞和细胞毒性T杀伤细胞等多种免疫反应[15]。活化的Th1细胞表达 IL-12Rβ1和 IL-12Rβ2,并分泌 IL-12,促进naïve CD4+Th向Th1极化,这一过程依赖STAT1,Tbx21和STAT4多种转录因子的共同作用[16-18]。
多项关于miRNA的研究揭示,miRNA分子在调控Th1极化过程中发挥重要作用[19-20]。本研究发现,miR-148a-3p可显著抑制Th1细胞极化,下调Th1细胞极化关键转录因子STAT1,Tbx21和STAT4表达;miR-148a-3p亦可使Th1细胞极化过程中STAT4蛋白水平及其磷酸化水平下降,IL-12/IL-12Rβ1/IL-12Rβ2/IFN-γ通路介导的Th1细胞极化关键细胞因子IFN-γ,IL-12Rβ1和IL-12Rβ2表达也受到miR-148a-3p影响而下调。结合生物信息学预测结果和双荧光素酶报告系统检测结果进一步表明,miR-148a-3p可靶向调控IL-12/IL-12Rβ1/IL-12Rβ2/IFN-γ通路的多个关键分子STAT4,Tbx21,IL-12Rβ1和IL-12Rβ2的表达。
本研究基于前期miR-148a-3p可有效抑制炎症反应进程的基础上,进一步表明miR-148a-3p可通过靶向调控IL-12/IL-12Rβ1/IL-12Rβ2/IFN-γ通路分子STAT4,Tbx21,IL-12Rβ1和IL-12Rβ2的表达抑制该通路激活,降低STAT4蛋白磷酸化,从而减少Th1细胞极化关键细胞因子IFN-γ的表达,抑制Th1细胞极化,进而缓解炎症反应进程。据此推测,miR-148a-3p作为潜在的可抑制Th1细胞极化的小分子化合物,可能用于抑制Th1细胞介导的过度免疫反应,对阐明维持免疫平衡、防治Th1细胞异常活化所致的自身免疫性疾病,尤其是T1DM的发病机制具有参考价值。

