药物性肝损伤有害结局路径研究进展
彭 辉,张 丽,何 俊,梁 佳,郭家彬
(解放军疾病预防控制中心,北京 100071)
药物性肝损伤(drug-induced liver injury,DILI)是由各类化学药物、生物制剂、传统中药或其代谢产物等所引起的不同程度的肝损伤,可表现为胆汁淤积、肝脂肪变性和纤维化等多种临床症状,严重的可导致肝衰竭甚至死亡[1-2]。DILI是临床最为常见的一类肝损伤,如对乙酰氨基酚是一种广泛使用的非处方解热镇痛药,但其过量使用已成为临床急性肝功能衰竭的主要原因之一。美国LiverTox网站(http://www.livertox.nih.gov)最新收录的可引起肝损伤的药物达1000多种[3],最近更新的药物还包括用于治疗新型冠状病毒肺炎(corona virus disease 2019,COVID-19)的药物、单克隆抗体和疫苗,如洛匹那韦、利托那韦、干扰素α和糖皮质激素等。潜在的肝损伤已成为药物研发失败或已上市药物撤市的主要原因[4-6],受到药物研发和相关监管机构的高度重视。
2010年,美国环境保护署Ankley等[7]首次提出了有害结局路径(adverse outcome pathway,AOP)的概念。AOP是把已知的1个分子起始事件(molecular initiating event,MIE)通过一系列的关键事件(key event,KE)与在生物不同组织层次所出现的有害结局(adverse outcome,AO)联系起来[8-9]。AOP整合了体内外实验、计算机模拟和临床等各种相关信息,为化学物毒性评价和风险评估提供有用信息和实用工具。
AOP的核心内容是从分子、细胞、组织、器官、最终个体与群体水平将化学物与MIE和一系列与之相关的KE以及最终AO串联起来,强调用逻辑推理确定这些KE之间的因果关联。2013年,经济合作与发展组织(Organization for Economic Co-operation and Development,OECD)发布了AOP指南,2014年又发布了“AOP知识库”(AOP Knowledge Base,AOP-KB),用于促进国际研究者对AOP研究的统一协作,不断建立和完善更多的AOP及大力推广应用。目前AOP-KB(https://aopkb.oecd.org)包含5个模块:2个知识库(AOP Wiki和Effectopedia)及3个研发工具(AOPXplorer,AOP-DB 和 Intermediate Effects Database),所有模块可通过入口协议(e.AOP.Protal)实现数据分享、交流和同步。本文介绍AOP的内涵和基本框架,重点综述肝损伤相关AOP的构建和研究进展。
1 AOP的内涵及基本框架
AOP是模块化的框架,它从MIE开始,即初始化学物质与生物分子发生作用(如受体/配体相互作用),然后经过细胞或器官等层面的一系列机体反应(如蛋白合成和稳态失衡等),最后到达毒性评价研究者所关注的AO(如发育受阻和癌症等)[7]。
1个AOP由4个基本信息模块组成,包括MIE、KE、关键事件关系(key event relationship,KER)和AO。MIE是外界刺激与生物分子的初始相互作用,是启动KE的起始点。KE被认为是引起特定AO不可缺少的重要部分,本质上是一类可检测可度量的生物学反应,如分子或细胞层面的受体-配体结合和基因激活等。KER通过描述上游KE与下游KE两者的逻辑因果关系,将众多的KE串联成线;同时,KER代表2个KE之间的机械、结构或功能的关系,从提供剂量-反应的经验数据中进一步得到验证支持。AO可理解为导致细胞或有机体、系统或亚种群的功能损害,可以表现为形态学、生理学的变化,也可理解为毒性测试终点[7]。AOP的构建是个动态变化过程,随新知识的出现而不断更新完善。截止2021年8月,AOP-KB中已登记了300多个AOP项目和近1500个KE,但绝大部分AOP项目都尚在进一步研发完善中。
2 肝损伤AOP的构建
近年来,全球研究者们构建了一系列与肝损伤相关的AOP。通过AOP-KB网站查询可知,截至2021年8月,知识库收录的与肝损伤相关的AOP已有25个。从MIE来看,它们包含了抑制胆汁盐输出泵、蛋白质烷基化、线粒体呼吸链完整性受损和激活多种炎症信号通路等;从AO来看,包含了胆汁淤积、脂肪变性、肝纤维化和肝癌等;从OECD认可状态来看,大部分AOP项目仍在开发中,少部分正在接受分子筛选和毒物基因组学专家咨询组(Expert Advisory Group on Molecular Screening and Toxicogenomics)审查,或已被危害评估工作组(Task Force on Hazard Assessment)和测试指南计划国家协调员工作组(Working Group of the National Coordinators for the Test Guidelines Programme)认可(表1)。Khadka等[10]研究表明,大部分DILI都可以利用AOP-KB中肝损伤相关AOP进行认识和评估。以下分别从肝损伤相关AOP的MIE、KE和AO等方面介绍DILI相关AOP的构建。
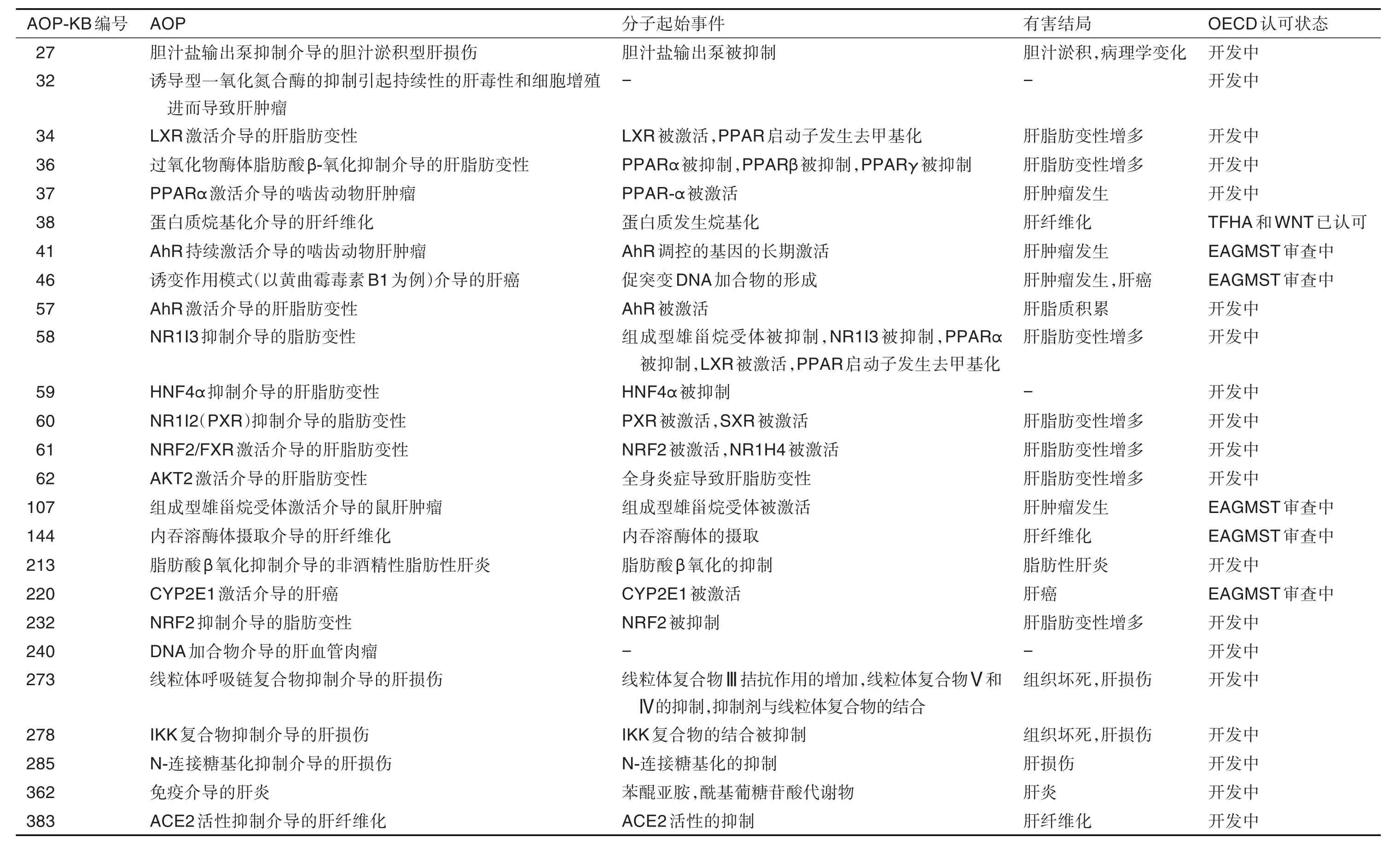
表1 有害结局路径知识库(AOP-KB)中与肝损伤相关的AOP
2.1 分子起始事件
AOP框架的1个关键特征是其无化学特异性,即1个AOP不特定于1个化学物质,可用于描述一组具有相同化学特性物质的潜在毒性作用[11]。对化合物结构的分析有助于描述化合物与特定的生物靶点之间产生的相互作用,即化合物所引起的MIE。结构上相似的化合物会表现出类似的有害效应,Hewitt等[12]对900多种药物的化学结构数据进行分析,发现了16种具有潜在肝毒性风险的化学结构,并据此提出了这些结构可能成为DILI的MIE。通过定量构效关系(quantitative structure-activity relationship,QSAR)方法证明,某种化学物质如具有与杂环碳原子结合而形成酯键或在碳环体系上连有至少1个芳环,那么就会对胆汁盐输出泵产生抑制[13],这也就是胆汁盐输出泵抑制介导的胆汁淤积型肝损伤(AOP-KB ID:27)中的MIE。肝X受体(liver X receptor,LXR)激活介导的肝脂肪变性(AOPKB ID:34)AOP的MIE是LXR的激活,对LXR的配体进行二维和三维QSAR研究显示,化学物质中的苯环、氯基团和甲基决定了能否与LXR结合和活性的大小[13]。近期,由二维和三维QSAR技术构建的MIE计算机模型[14-15],已被纳入基于机械的评估暴露-反应关系的毒物代谢动力学/毒物效应动力学模型中[16]。
2.2 关键事件
肝损伤机制十分复杂,有研究表明,DILI涉及代谢酶系或转运蛋白功能异常、胆汁淤积和胆小管损伤、炎症反应、氧化应激、线粒体损伤和自身免疫反应等多种机制[17-18]。肝损伤的发病机制与化学物自身的化学性质(如亲脂性、生物转化)密切相关,如活性代谢产物与宿主蛋白共价结合并引起氧化应激,激活多种炎症信号通路,诱发线粒体和内质网等细胞器应激,干扰胆汁酸转运;结局是诱导抗氧化反应、内质网非折叠蛋白反应以及线粒体生物合成等适应性应答,避免发生严重肝损伤;严重结局是导致肝细胞坏死和凋亡等致死性后果[19-20]。
2.2.1 代谢酶功能异常
细胞色素P450酶作为机体内主要的代谢酶,它可通过Ⅰ相代谢反应将化合物代谢为水溶性极低的物质,并作为Ⅱ相代谢反应的底物,进一步通过葡萄糖醛酸化或硫酸化进行代谢[21],部分化学物经代谢激活形成反应性代谢物引起肝损伤。越来越多的研究认为,化合物通过细胞毒性和持续的增殖作用模式导致机体产生癌症[22]。在细胞色素P450家族2第E组成员1(cytochrome P450 proteins 2E1,CYP2E1)激活介导的肝癌(AOP-KB ID:220)AOP中,CYP2E1长期激活是这个AOP的MIE。CYP2E1可活化对乙酰氨基酚等多种底物,产生亲电子代谢物。CYP2E1催化循环中易发生解偶联,生成活性氧(reactive oxygen species,ROS)引起氧化应激,底物单氧化产生反应性代谢物。ROS和代谢物都会引起肝细胞毒性,受损肝细胞通过增加细胞增殖进行自我修复。在CYP2E1长期慢性激活条件下,ROS和细胞死亡的持续增加和受损肝细胞的持续细胞增殖,导致肝癌发生。另外,药物代谢酶系、跨膜转运蛋白和溶质转运蛋白等的基因多态性可导致肝代谢或转运蛋白功能异常[19],这些基因多态性及其表观遗传特点可增加宿主对DILI的易感性[23]。
2.2.2 线粒体损伤
线粒体是许多DILI的首要作用靶位。某些药物本身和(或)其代谢物可以抑制线粒体呼吸链,造成ATP的消耗并且产生大量ROS,抑制β-氧化,造成脂肪变性[21]。在线粒体呼吸链复合物抑制介导的肝损伤(AOP-KB ID:273)AOP中,线粒体呼吸链复合物(Ⅰ,Ⅱ,Ⅲ,Ⅳ和Ⅴ)部分或完全受到抑制,可引起线粒体氧化磷酸化减少、ROS生成增多,压力达到阈值后,触发细胞凋亡或坏死,最终导致肝损伤。破坏线粒体结构稳定的KE也会进一步导致肝损伤,在内吞溶酶体摄取介导的肝纤维化(AOP-KB ID:144)AOP中,化学物质被细胞吸收后被转运到溶酶体中,导致溶酶体肿胀,溶酶体的破坏引起了线粒体功能障碍、促凋亡蛋白的释放,溶酶体将组织蛋白酶释放到细胞质中触发线粒体介导的细胞死亡,促炎介质产生增加并进一步激活白细胞,引起胶原蛋白积聚,最终导致肝纤维化。另外,一些药物(如环丙沙星和他克林)可通过抑制肝线粒体DNA(mtDNA)复制、诱导mtDNA耗竭、触发线粒体核酸酶的降解以及改变mtDNA甲基化状态,引起mtDNA稳态的严重损害,诱导线粒体功能障碍,导致肝功能衰竭和死亡[24]。
2.2.3 炎症反应的激活
炎症反应的激活导致肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等多种细胞因子的释放,进而刺激TNF受体,导致相关炎症通路激活,引起级联反应。在IκB激酶(IκB kinase,IKK)复合物抑制介导的肝损伤(AOP-KB ID:278)AOP中,当IKK复合物被化合物抑制时,在炎症反应中发挥关键作用的NF-κB通路的激活受到抑制,导致抗凋亡基因的转录减少;在细胞凋亡保护机制减弱的情况下,促凋亡的胱天蛋白酶8通路被激活,胱天蛋白酶8继续激活胱天蛋白酶3,导致细胞凋亡或细胞死亡。细胞死亡增多进一步激活肝Kuppfer细胞,进而导致促炎介质(如TNF-α)增加,进一步加强了NF-κB通路的抑制,形成正反馈通路。通过级联放大反应,最终引起组织坏死,导致肝损伤。另外,在丝氨酸/苏氨酸激酶2(serine/threonine kinase 2,AKT2)激活介导的肝脂肪变性(AOP-KB ID:62)AOP中,化合物引起的炎症反应导致Akt2的激活,进而增加甾醇反应元件结合蛋白的表达,最终导致肝脂肪变性。
2.2.4 免疫细胞活化
目前许多研究表明,机体免疫是化学物引起肝损伤的主要诱因,药物或其代谢产物与蛋白质共价结合形成复合物,进一步形成能被T淋巴细胞识别的药物或其代谢产物-肽复合物,激发淋巴细胞诱发免疫反应[25]。有人类白细胞抗原(human leukocyte antigen,HLA)遗传背景的患者,体内固有免疫激活提供的共刺激信号和药物半抗原与宿主蛋白形成的加合物,可激活HLA限制性适应性免疫应答,从而引发特异质型DILI[20]。在免疫介导的肝炎(AOP-KB ID:362)AOP中,化合物引起机体产生苯醌亚胺和酰基葡糖苷酸代谢物等反应性代谢产物,反应性代谢物与蛋白质结合并充当抗原,与抗原呈递细胞相互作用引起B和T细胞等免疫细胞活化,导致干扰素γ表达增加这一先天性和适应性免疫反应的表征,进一步导致炎症和凋亡增加,最终引起免疫介导的肝炎。
2.3 有害结局
2.3.1 肝纤维化
肝纤维化是肝细胞损伤过程中的可逆性愈合反应,是肝修复和瘢痕形成之间的平衡过渡反应[26],许多药物(如甲氨蝶呤)可引起这一机体反应。肝星状细胞的活化是引起肝纤维化的关键因素,过程分为初始阶段和持续阶段。在初始阶段,ROS或濒死细胞所产生的凋亡小体使处于休眠状态下的星状细胞开始对生长因子变得敏感。在持续阶段,活化的星状细胞经过增殖、皱缩、纤维化、趋化、胞外基质降解和类视黄醇缺失等变化过程,呈现出纤维细胞样表型[26]。
蛋白烷基化介导的肝纤维化(AOP-KB ID:38)[27]这一AOP是肝纤维化产生的典型AOP,它描述了蛋白质烷基化引起的肝损伤与肝纤维化形成之间的联系(图1)。MIE是蛋白质烷基化,它引起肝细胞结构和功能的损伤,并进一步导致细胞死亡,随后肝细胞出现DNA片段化并形成凋亡小体,凋亡小体被吞噬后,Kupffer细胞被激活。转化生长因子 β(1transforming growth factor-β1,TGF-β1)是最有效的促纤维化细胞因子,它是活化的Kupffer细胞的主要产物。TGF-β1表达增多进一步引起肝星状细胞的活化,这也意味着细胞向具有增殖性和收缩性肌成纤维细胞(肝纤维化中的中枢效应子)分化。活化的肝星状细胞引起进行性胶原蛋白积聚,改变了细胞外基质的组成。细胞外基质蛋白的过度积累逐渐影响整个肝器官,改变了肝的正常功能,最终引起肝纤维化。

图1 蛋白烷基化介导的肝纤维化的AOP流程图[27].TGF-β1:转化生长因子β1.
2.3.2 脂肪变性
肝脂肪变性是化合物诱导肝损伤的典型表现,它是肝细胞内脂质(主要是甘油三酯)的异常蓄积过程,表现为甘油三酯的合成及分解异常,引起肝脂质体内平衡扰动[28],许多药物(如丙戊酸)可引起这一机体反应。脂肪变性可进一步发展成非酒精性脂肪性肝炎,其特征是肝细胞损伤和炎症反应。脂肪变性分为微囊型脂肪变和大泡型脂肪变。在微囊型脂肪变中,肝细胞的胞质中会形成许多小脂滴,但不会影响细胞核位置;而在大泡型脂肪变中,细胞核则被较大的脂滴挤于一侧。
导致肝脂肪变性的分子机制有很多,涉及到多个不同通路,化合物与核受体之间的相互作用是导致脂肪变性的常见机制。图2为LXR激活介导的肝脂肪变性(AOP-KB ID:34)的AOP流程图[29]。LXR是核受体家族中的一员,属于配体依赖型转录因子,在脂代谢中具有重要的调节作用。MIE是LXR的激活,它可引起大量相关基因的转录改变,包括碳水化合物反应元件结合蛋白、甾醇反应元件结合蛋白1c、脂肪酸合成酶以及硬脂酰辅酶A去饱和酶1等相关表达的激活,进一步引起肝细胞内脂肪酸合成增强[30]。同时LXR的激活引起游离脂肪酸摄取转运蛋白CD36表达升高,促使脂肪酸从周围组织向肝流入。这两方面都导致了甘油三酯聚集这一KE,细胞器水平表现为细胞质的位移、细胞核变性扭曲、线粒体破坏和内质网应激,并最终导致细胞层面的脂肪肝细胞出现,以及组织效应层面临床上的脂肪肝(脂肪变性和肝增重5%~10%)。
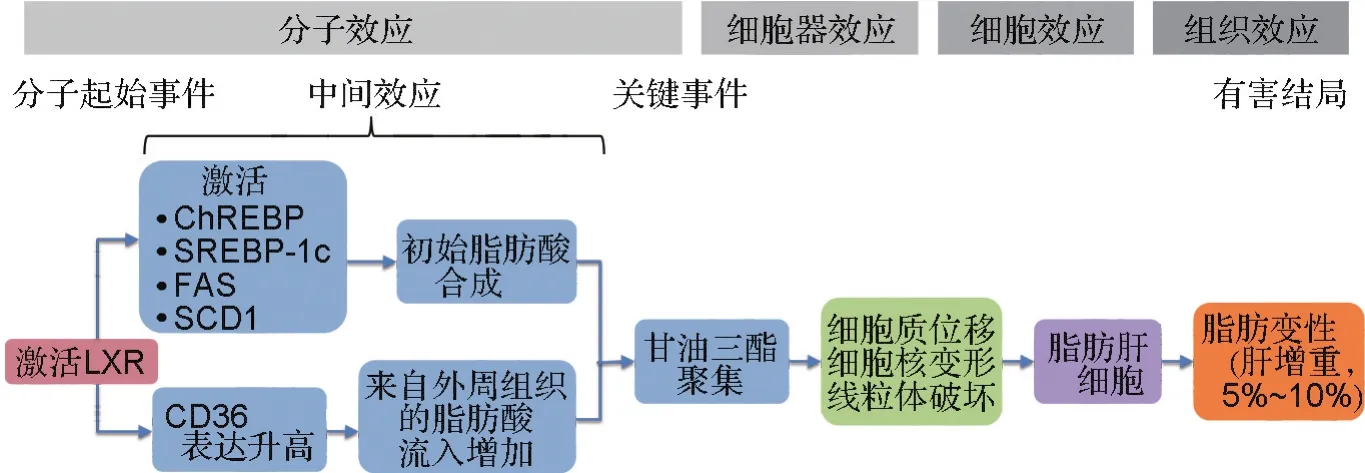
图2 肝X受体(LXR)激活介导的肝脂肪变性的AOP流程图[29].ChREBP:碳水化合物反应元件结合蛋白;SREBP-1c:甾醇反应元件结合蛋白1c;FAS:脂肪酸合成酶;SCD1:硬脂酰辅酶A去饱和酶1;CD36:脂肪酸受体36.
2.3.3 胆汁淤积
胆汁淤积是指机体胆汁分泌受损的各种情况,伴随着潜在的有害嗜胆汁菌在肝或体循环中的积聚,胆汁淤积发生率在DILI病例报告中高达47%[31],许多药物(如波生坦)可引起这一机体反应。在胆汁盐输出泵抑制介导的胆汁淤积型肝损伤(AOPKB ID:27)AOP[32]中,MIE是胆盐输出泵的抑制,进而导致胆汁酸在肝细胞和胆小管中的蓄积,机体随之产生适应性反应和病变[5]。病变的发生在细胞层面表现为线粒体通透孔的形成,造成线粒体损伤、ROS生成以及炎症反应这些KE,最终通过调亡和坏死致细胞死亡[32-33]。
胆汁淤积也会使细胞产生适应性反应,这是细胞为抵消胆汁蓄积的不良影响从而防止肝损伤而产生的自发保护反应。胆汁酸活化核受体后,通过一系列复杂的转录协调机制,使肝细胞中胆汁酸和胆红素摄取减少、排出增多,并增加胆汁酸代谢、减少胆汁酸合成。肝细胞为缓解胆红素蓄积而产生的一系列效应,可引起胆红素尿和高胆红素血症,皮肤以及巩膜产生黄色素沉积进而形成黄疸。
2.3.4 肝癌
慢性肝病可能会发展为肝癌,尤其是肝细胞癌。目前AOP-KB中与肝癌相关的AOP已有4个,它们分别起始于不同的MIE,即抑制诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)(AOP-KB ID:32)、激活过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor-α,PPAR-α)(AOP-KB ID:37)、调节芳香烃受体(AOPKB ID:41)和激活CYP2E1(AOP-KB ID:220)。其中抑制iNOS或激活CYP2E1这2种MIE如果持续发生,通常会引起肝毒性并促进肝癌发生[34]。这4个AOP共享许多与破坏肝稳态平衡以促进癌细胞生长相关的KE,包括细胞增殖增加、多种肝细胞类型的增生以及肿瘤前病灶细胞的克隆扩增等。这些KE可通过许多机体中间效应事件来促进,如氧化应激、NF-κB激活和间隙连接细胞间通讯抑制等[34]。最近,从DNA加合物形成到肝血管肉瘤发生的AOP也被添加到AOP-KB(ID:240)中。
3 肝损伤AOP的发展
随着AOP理念在毒理学研究者中的广泛接受和积极实践,为药物毒性评价、化学品毒性筛查、环境污染物暴露评估提供新思路和方案的AOP策略同时面临新的问题和挑战。伴随各种组学技术、计算毒理学和大数据分析等技术的飞速发展,AOP在理念创新、模型验证、新技术引进等方面取得了一定发展,以下分别从AOP网络和定量AOP介绍DILI相关AOP的发展趋势。
3.1 AOP网络的构建
当前对AOP这一毒性测试策略的质疑主要集中在它的简易性和对复杂毒理学过程(包含适应性反应和自我修饰)描述的不充分性。确实,AOP描述的是独立线性事件,然而机体内真实的机制并非如此简单,而且不同的通路可能平行存在或互相串联交流[13]。AOP网络这一新理念应运而生,它将一组共享相同KE的多个单线性AOP串联结合,可更好地描述机体内复杂的生物过程[35-36]。近几年,已有研究者通过构建AOP网络开展毒性机制研究,如研究肝脂肪变性的AOP网络[37]和对导致线粒体功能障碍机制研究的AOP网络[38]等。从LXR激活介导的肝脂肪变性(AOP-KB ID:34)的原始AOP的流程图[29]上还可见AOP网络中相关联的其他5个AOP的大体构成,充分体现了AOP的模块化单元式结构以及KE和KER的通用性和共享性。此外,将拓扑学特征应用在AOP网络的开发研究也取得了相应进展,如自动识别AOP网络中最常见路径的紧密连接程度等[39-40]。
3.2 定量AOP的发展
随着AOP优化完善相关研究的开展,AOP的量化工作渐渐引起大家的关注。定量AOP(quantitative AOP,qAOP)已被认为是定量化学品毒性风险评估的重要工具[41-42],它能解决评价上游KE达到何种扰动程度才能引起下游KE的变化,以及在何种条件下可能发生AO这一棘手问题[43]。qAOP在普通AOP构建的基础上,进一步考虑了KER的量化、数据可用性、定义诱导效应的阈值、KER数学规则的建立、非线性模型的参数化以及模型验证等问题[44-45]。
qAOP从定性AOP发展而来,它通过数学或统计函数f(x)量化了KER。f(x)可以是简单的数学方程,也可以是复杂的基于生物学的计算模型,这些模型考虑了其他生物学调节因素,如补偿性反应或与其他生物或环境变量的相互作用[11]。基于从暴露模型得到的环境暴露量的预测值、毒代动力学得到的受试物的内在暴露值,通过对KER的量化,对激活MIE的外部或内部的化学物质浓度进行范围限定,进而推断AO的发生幅度或概率,可建立用于风险评估的剂量反应模型(图3)[11]。

图3 定量AOP模型在风险评估中的应用[11].f(x):数学或统计函数.
qAOP模型可以将KER中复杂的反馈回路、阈值或级联信号进行合并,与具有简化假设的模型相比,包含复杂生物关系的模型可以创建具有更高生物保真度的预测体系,以支持或开展更为准确的风险评估[43]。近两年,通过建立基于概率的贝叶斯模型和基于机制的回归模型进行qAOP研究,已经取得了较高的模型预测率和准确率[46-47]。虽然目前已有少量的AOP开展了定量研究,但绝大多数AOP(包括与肝损伤有关的AOP)仍是定性的[48]。
4 结语
在药物早期发现和临床前评价阶段,准确评估受试药物引起肝损伤仍然面临很大的挑战。在传统的毒性测试中,采用动物实验进行肝毒性筛选存在一定的滞后性和假阴/阳性,然而以人源细胞构建的体外测试模型则可检测出高达60%具有肝毒性的化合物[13]。AOP能以一种更精确规范的方式整合各类数据,对化学物诱导DILI的潜在风险进行预测。AOP作为底层理论基础可构成研究肝毒性的体外组合试验(in vitrotest batteries),这一研究思路已在最近的肝脂肪变性研究中得到证实[49]。此外,基于数据挖掘、深度学习或AI机器学习等的智能算法技术,已被应用于推导MIE和KER以及构建AOP框架的研究中[50-52],为加速AOP的构建提供了新的技术方法。这些研究和技术发展表明,AOP为DILI评估提供了强有力的工具。未来将建立更多与DILI密切的AOP,同时进一步完善现有的肝损伤相关AOP,并大力推动AOP在DILI评估中的应用。

