2种盐酸二甲双胍缓释片在中国健康受试者空腹单次口服给药条件下的生物等效性和安全性
孙明利,漆 璐,罗向东,刘慧娟,王 瑜,张 薇,王兴河
(1.首都医科大学附属北京世纪坛医院,药物Ⅰ期临床试验研究室,北京 100038;2.广东赛康药业有限公司研发部,广东 广州 510070)
二甲双胍是一种双胍类降糖药,主要用于>10岁的2型糖尿病患者的血糖控制[1-2],是糖尿病治疗指南推荐的一线治疗药物[3-4]。二甲双胍普通片有血药浓度波动大、服药次数多和用药依从性差等缺点,缓释片则可克服以上缺点[5]。2型糖尿病发病率高[6-8],二甲双胍缓释片市场需求大,目前我国上市的盐酸二甲双胍缓释片仿制药有22种,由不同厂商研制。元唐(每片500 mg)是广东赛康制药公司为满足市场需求研发的仿制新药。本研究旨在比较元唐与英国Merck Serono Limited生产的原研药格华止缓释片在健康受试者中空腹单次口服给药条件下的生物等效性和安全性。
1 受试者、材料与方法
1.1 受试者
本研究由首都医科大学附属北京世纪坛医院药物Ⅰ期临床试验研究室完成,获得北京世纪坛医院伦理委员会批准(批件号2017Y123)。受试者均自愿签署知情同意书。
入选标准:年龄>18岁的中国健康受试者,男性体重>50 kg,女性体重>45 kg,身体质量指数在19.0~28.0 kg·m-2。排除标准:有严重疾病史、有烟酒嗜好和药物滥用史、有二甲双胍及其辅料成分过敏史,生命体征、心电图、体格检查、实验室检查结果异常有临床意义,传染性疾病血清学检查结果阳性。
按照入选和排除标准,入组36例健康受试者,男性23例(63.9%,23/36),年龄(29.0±9.2)岁,汉族31例(86.1%,31/36),体重(65.3±9.3)kg,身高(166.3±7.9)cm,身体质量指数(23.6±2.4)kg·m-2。
试验中有1例受试者因个人原因在服用试验药物前退出试验,不纳入安全分析集和药动学分析集;1例受试者在第一周期服用参比制剂后因发生不良事件退出试验,纳入安全分析集,而不纳入药动学分析集。故安全性分析集共35例受试者,药动学分析集34例。
1.2 药物和仪器
受试制剂为广东赛康制药厂有限公司生产的元唐,为仿制盐酸二甲双胍缓释片,规格每片500 mg,批号1171115010,二甲双胍纯度96.5%;参比制剂为英国Merck Serono Limited生产的盐酸二甲双胍缓释片(格华止缓释片Glucophage XR),规格每片500 mg,批号Y02494,二甲双胍纯度98.9%。
高效液相色谱仪,包括液相泵(LC-20ADXR)、柱温箱(CTO-20AC)、控制器(CBM-20Alite)、脱气机(DGU-20A5R)和自动进样器(SIL-30AC),日本岛津公司;质谱检测器(API 4000)和电喷雾离子化离子源,美国Applied Biosystems/Sciex公司;色谱柱Poroshell 120 EC-CN(2.1 mm×50 mm,2.7 μm),美国Agilent公司;预柱Security Guard Cartridges C18(4.0 mm×2.0 mm),美国Phenomenex公司;离心机(Heraeus Muitifuge X1R),美国ThermoFisher公司;天平(CPA225D和MSA6.6S-OCE-DM),德国Sartorius公司;振荡器(QB-9001),美国QILINBEIER公司;振荡器(LPD 2500),莱普特科学仪器(北京)有限公司;振荡器(MIX-1500),杭州米欧仪器有限公司(MIULAB公司);纯水仪(Milli-Q),美国Merck公司;数据采集软件(Analyst 1.6.2和Analyst 1.6.3),美国Applied Biosystems/Sciex公司;数据处理软件(Microsoft Office 2007和2013),美国微软公司。
1.3 给药和血浆样品采集
试验为单中心、开放、随机、单剂量、两周期、两序列、双交叉设计,在空腹状态下进行生物等效性试验。36例入选受试者随机分成2组,每组分别给药前隔夜空腹至少10 h,给药日早晨空腹状态下,用240 mL温水分别送服500 mg受试制剂或参比制剂,7 d清洗期后,进行第2周期交叉给药。每周期给药0 h(给药前30 min内)和给药后第1,2,3,4,4.5,5,5.5,6,6.5,7,7.5,8,9,10,12,15,24 和36 h静脉采血4 mL至含K2-EDTA抗凝剂的真空采血管中,离心后血浆样品分为待测样品和备份样品。分装结束后1.0 h内将血浆样品置于-20℃冰箱中暂存,72 h内移至-70℃冰箱中长期储存。
1.4 血药浓度测定和血浆样品处理
二甲双胍血药浓度由南京科利泰医药科技有限公司采用已建立的液相色谱-串联质谱法检测[9-10]。色谱条件:色谱柱Poroshell 120 EC-CN(2.1 mm×50 mm,2.7 μm);流动相:A 为含 0.1% 甲酸的5.0 mmol·L-1醋酸铵的水溶液,B为乙腈;流速:0.4 mL·min-1;梯度洗脱程序(0.0~1.9 min,10%A;1.9~2.0 min,10%A→50%A;2.0~3.0 min,50%A;3.0~3.1 min,50%A→10%A;3.1~5.0 min,10%A);进样体积6.0 μL;柱温40℃;自动进样器温度8℃;运行时间:5.00 min。
质谱条件:离子喷雾电压1700 V;气帘气310 kPa;雾化气 379 kPa;辅助气 379 kPa;源温650℃;碰撞气10 Unit,碰撞激发裂解;电喷雾离子化,正离子模式,多反应监测模式;二甲双胍和内标二甲双胍-d6碰撞电压分别为29和20 V,定量离子对(m/z)分别为 130.1/71.1和136.1/60.1。
血浆样品处理:向96孔板中加入待测样品50.0 μL和内标工作溶液30.0 μL(终浓度80.0 μg·L-1),充分振摇3 min后加入乙腈450 μL,再剧烈振摇10 min后,25℃,4000×g离心10 min,取上清液30.0 μL至干净96孔板中,用90%乙腈水溶液570 μL稀释,将96孔板密封,充分振摇10 min后进行液相色谱-串联质谱分析。
1.5 药物安全性评价
药物安全性评价指标包括不良事件、严重不良事件、伴随用药、临床症状、实验室检查、生命体征测定、心电图和体格检查等结果异常且有临床意义。通过比较2种药物的安全性指标是否有差异,判断受试制剂的安全性。
1.6 药动学和统计学分析
由北京大学临床研究所进行统计学分析。设定最大血药浓度(Cmax)、药时曲线下面积(AUC0→t和AUC0→∞)为主要检测参数,采用Phoenix WinNonlin 7.0(Certara,US)软件中非房室模型计算各受试者的药动学参数,绘制平均血药浓度-时间曲线,将主要指标经对数转换后进行方差分析;其他统计学分析采用SAS 9.4软件(SAS INSTITUTE INC,US)进行。计量资料:非正态分布的数值用中位数(最小值,最大值)表示,采用Wilcoxon秩和检验;正态分布的数值用±s表示,差异分析采用t检验。计数资料:以例数和百分数(n,%)表示,两组间比较采用χ2检验,如期望值<5,则采用Fisher精确检验。药动学主要参数指标的几何均值受试制剂/参比制剂90%置信区间在等效区间(80.0%~125.0%)之内,则判定2种制剂生物等效。
2 结果
2.1 药物分析方法验证
专属性:二甲双胍和内标保留时间的变异系数(CV)均≤2.1%,二者峰面积比的CV≤7.8%。6个不同个体来源的血浆基质对二甲双胍或内标的测定不存在干扰,且二甲双胍和内标之间也不存在相互干扰(图1)。
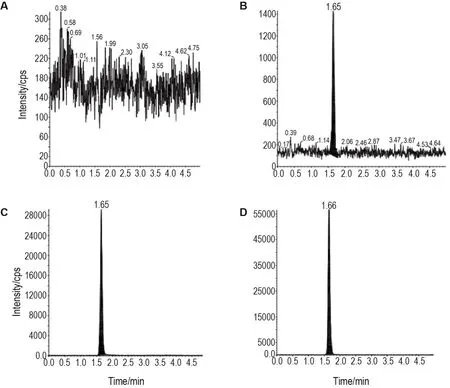
Fig.1 Representative chromatograms of metformin in human plasma.A:blank plasma;B:blank plasma spiked with a lower limit of quantitation of metformin(3.00 μg·L-1);C:blank plasma spiked with the intern standard metformin-d6(80.00 μg·L-1);D:a real sample at 7.5 h after oral administration of the test preparation Yuantang.Ion-pairs(m/z)used to test metformin and metformin-d6 were 130.1/71.1 and 136.1/60.1,respectively.
标准曲线和定量下限:以待测物(二甲双胍)与内标(二甲双胍-d6)的色谱峰面积的比值为纵坐标(y),以血浆中待测物的质量浓度为横坐标(x),用加权(1/x2)最小二乘法进行线性回归运算,二甲双胍回归方程为y=0.0171x-0.0016(r=0.9991)。结果表明,二甲双胍血药浓度在3.00~1200.00 μg·L-1线性关系好,定量下限为3.00 μg·L-1。
准确度、精密度和回收率:制备4个浓度的二甲双胍质控样品(3.00,8.00,300.00和900.00 μg·L-1),每浓度6个平行样品,评估批内准确度和精密度;通过3批质控样品(每批包括以上4个浓度,每浓度6个平行样品)评估批间准确度和精密度。结果表明,质控样品批内和批间准确度(RE)和精密度(RSD)均<15%。通过比较单个质控样品中待测物或内标响应值与空白血浆提取后加入待测物、内标的响应值,评价回收率。各浓度样品回收率的(CV)均<15.0%(表1)。
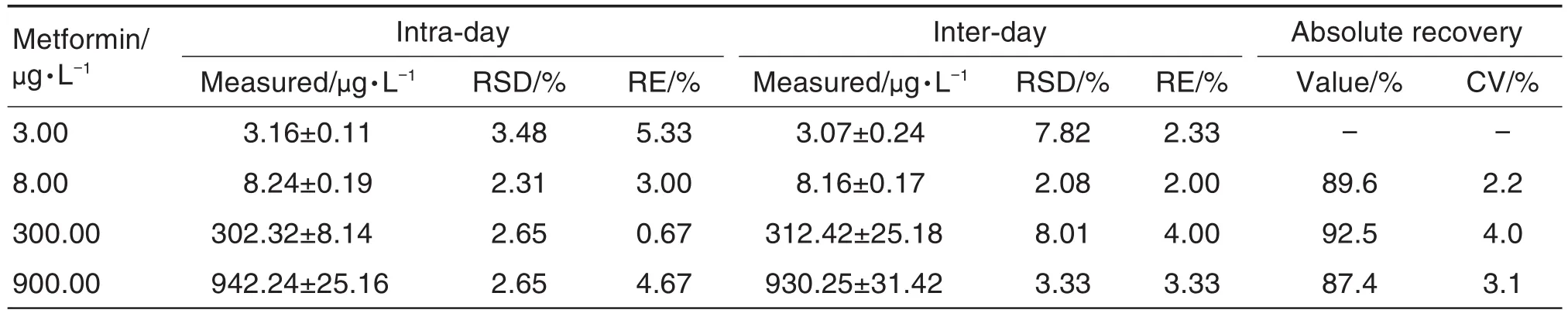
Tab.1 Precision and recovery of metformin in plasma
基质效应:6个不同来源的空白基质加入待测物和内标,二甲双胍8.00,300.00和900.00 μg·L-1浓度组内标归一化的基质因子分别为74.7±3.2,74.5±2.0和78.8±1.4,CV分别为4.3%,2.7%和1.8%,均<15%,表明基质效应不影响血浆中二甲双胍的准确定量,符合生物样品分析要求。
稳定性:通过比较储备液和质控样品经过放置或低温多次冻融后与新鲜配制的对照样品峰面积和内标峰面积比值来考察样品的稳定性(n=6)。与对照样品与内标峰面积的比值相比,待测样品与内标峰面积比值的标准偏差应<±10.0%,且每份待测样品与内标峰面积比值的CV≤10.0%,视为稳定性良好。结果表明,二甲双胍储备液和待测溶液的短期(室温,17.0 h)和长期(-20℃,34.96 d)稳定性、质控样品-20℃和-70℃经过5个冻融循环的冻融稳定性良好,标准偏差和CV均<10.0%。
2.2 中国健康受试者空腹单次口服2种盐酸二甲双胍缓释片药动学特征
由图2和表2可见,受试制剂和参比制剂的血药浓度-时间曲线重合度好,提示二者的药动学特征相似度高。受试者空腹单次口服受试制剂和参比制剂后,血浆中二甲双胍浓度逐渐升高,两者的血药浓度达峰时间(Tmax)、Cmax、AUC0→t、AUC0→∞、消除半衰期t1/2和末段消除速率常数λz均无显著差异。
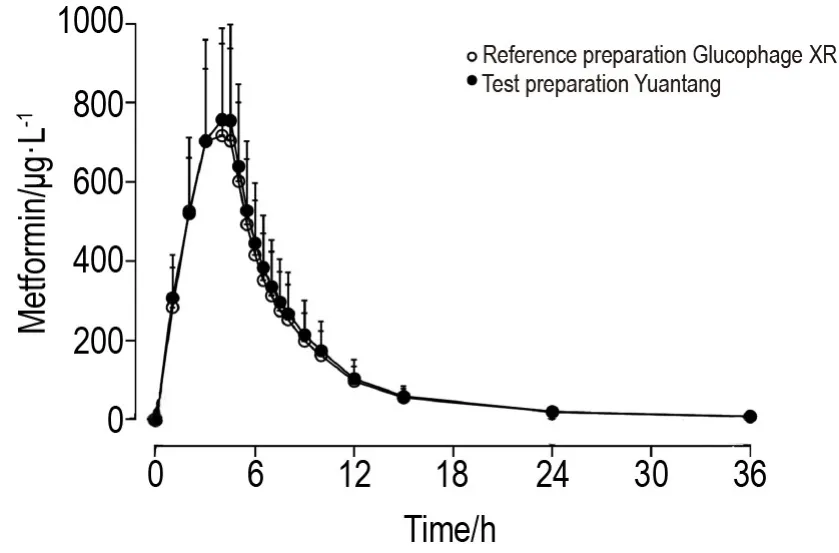
Fig.2 Mean plasma concentration-time curves of test preparation Yuantang and reference preparation Glucophage XR after single oral dose of 500 mg in 34 Chinese healthy subjects under the fasting state.A randomized,open,two-period,two cross-over trial was conducted in healthy subjects under the conditions of fasting and single oral administration(500 mg).After the first oral administration and the 7 d washout period,the second period of cross administration was conducted.±s,n=34.
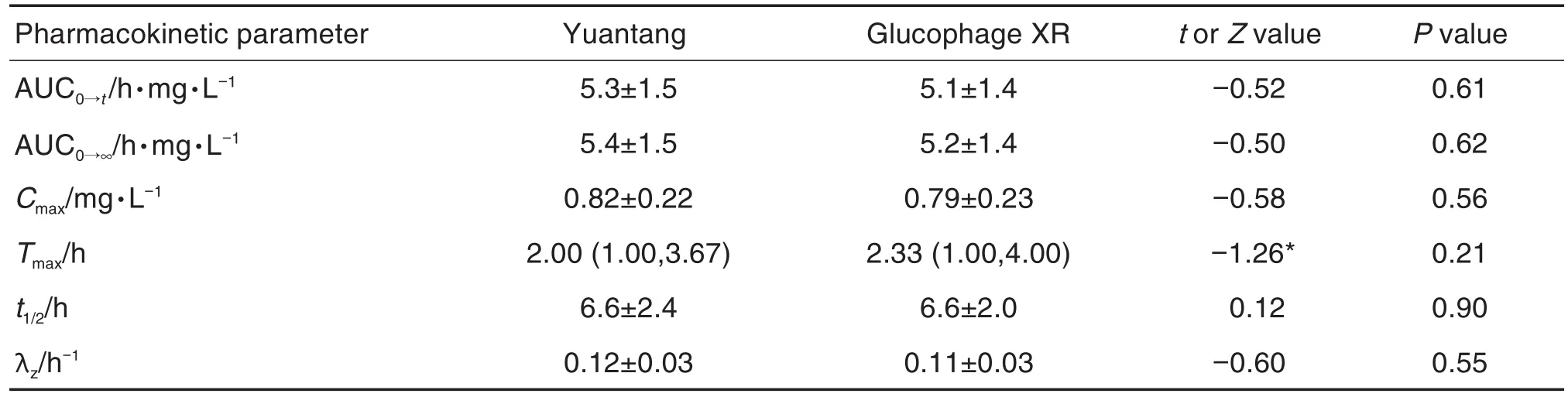
Tab.2 Comparison of arithmetic mean values of two kinds of metformin hydrochloride sustained-release tablets after single oral administration under fasting conditions in Chinese healthy volunteers
由表3可见,在中国健康受试者空腹条件下单次口服受试制剂(500 mg)或参比制剂(500 mg)后,Cmax,AUC0→t和 AUC0→∞几何均值分别为 0.79和0.76 mg·L-1,5.1和5.0 h·mg·L-1,5.2和5.0 h·mg·L-1;二者比值的90%置信区间分别为96.3%~113.7%,96.2%~110.8%和96.3%~110.4%,均在80.0%~125.0%的生物等效性区间内,表明本研究的受试制剂和参比制剂在空腹给药条件下具有生物等效性。

Tab.3 Geometric mean values of pharmacokinetic parameters and bioequivalence evaluation of two types of metformin hydrochloride sustained release tablets after single oral administration under fasting conditions in Chinese healthy volunteers
用Phoenix WinNonlin 7.0分别对受试制剂和参比制剂的给药序列、给药周期和不同制剂对Cmax,AUC0→t和AUC0→∞(取自然对数)的影响进行方差分析。结果表明,上述 3 因素对 lnCmax,lnAUC0→t和lnAUC0→∞无显著影响(表4)。
Tab.4 Results of ANOVA test on bioequivalence of two types of metformin hydrochloride sustained release tablets after single oral administration under fasting conditions in Chinese healthy volunteers
2.3 安全性分析
试验过程中无非预期不良事件和严重不良事件发生。在各自服用周期内,受试制剂有8例受试者(22.9%,8/35)发生10例次不良反应,参比制剂有10例(28.6%,10/35)发生15例次不良反应,两者无统计学差异(χ2=0.30,P=0.58);服用受试制剂的受试者中发生6例次消化道反应、4例次实验室检查异常有临床意义,服用参比制剂的受试者中发生5例次消化道反应、9例次实验室检查结果异常有临床意义、1例次上呼吸道感染,不良反应无统计学差异(Fisher检验,P=0.51)(表5)。1例受试者在服用参比制剂后发生1次Ⅱ级中度不良反应(上呼吸道感染),其余不良反应均为Ⅰ级轻度(表5),2种制剂不良反应严重程度无统计学差异(Fisher检验,P>0.99)。1例次不良反应转归为“未知”(受试者失访),其余均为“痊愈”,2种制剂发生不良反应转归无统计学差异(Fisher检验,P>0.99)。

Tab.5 Comparison of adverse reactions of two kinds of metformin hydrochloride sustained release tablets in Chinese healthy volunteers after single oral administration under fasting conditions
3 讨论
Zhou等[12]研究2种盐酸二甲双胍缓释片在健康受试者餐后单次给药条件下生物等效。本研究采用液相色谱-串联质谱法[11]测定健康受试者空腹单次口服给药条件下二甲双胍血浆药物浓度,采用Cmax,AUC0→t和 AUC0→∞作为药动学评价的主要指标,评价2种制剂的生物等效性。结果表明,2种制剂在健康受试者空腹单次口服给药条件下生物等效,进一步丰富了国产仿制药的生物等效资料,为国内2型糖尿病治疗提供更多的选择和参考。
二甲双胍在临床上已有60多年的用药史,良好的安全性已成共识[13-14]。本研究结果亦表明,受试制剂和参比制剂不良反应轻,主要为消化道反应和实验室检查异常,且均可自愈。2种制剂在试验期间均无非预期不良事件和严重不良事件发生,不良反应发生率、类型、严重程度和转归无统计学差异,且安全性均好,与本课题组前期报道结果一致[15]。
综上,本研究中受试制剂元唐和参比制剂格华止在健康受试者空腹单次口服给药条件下生物等效,安全性良好。

