糖代谢重编程与“炎-癌转化”及抗炎中药靶向肿瘤糖代谢抗肿瘤作用机制研究进展
梁晓晖,石海莲,吴晓俊
(上海市复方中药重点实验室,上海中药标准化研究中心,教育部中药标准化重点实验室,国家中医药管理局中药新资源与品质评价重点研究室,上海中医药大学中药研究所,上海 201203)
细胞糖代谢的主要途径是糖酵解和线粒体有氧磷酸化。即使在有氧的情况下,肿瘤细胞也主要通过有氧糖酵解获能(Warburg效应),从而满足增殖的肿瘤细胞对能量ATP的获取。但线粒体氧化磷酸化仍能为细胞代谢活动提供部分ATP,甚至在某些肿瘤的生长过程中可能发挥重要作用。“炎-癌转化”即慢性非可控性炎症恶性转化。炎性微环境是肿瘤病变的重要诱因之一,慢性炎症可影响肿瘤细胞糖代谢重编程,促进肿瘤发生。炎症细胞分泌炎症因子如肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、白细胞介素16(interleukin-16,IL-16)和IL-17参与肿瘤细胞糖代谢重编程,促进有氧糖酵解,从而介导肿瘤细胞的生长和侵袭。因此,抑制炎症的药物可通过影响肿瘤细胞糖代谢重编程抑制肿瘤细胞增殖、生长和转移。中药中多种生物活性物质,如皂苷、黄酮、生物碱、多酚和醌类等可显著抑制炎症反应,并能调控肿瘤糖代谢,抑制肿瘤细胞增殖和生长。本文主要综述“炎-癌转化”与肿瘤细胞糖代谢重编程的关系以及靶向肿瘤糖代谢抗炎中药抑制肿瘤发生发展的研究进展,总结可靶向肿瘤糖代谢的中药及单体成分,为挖掘“炎-癌转化”与糖代谢重编程之间的关系及从抗炎中药中筛选具有重编程肿瘤细胞糖代谢作用的活性成分提供参考。
1 “炎-癌转化”
炎症细胞主要是通过在肿瘤微环境中提供活性分子以发挥促进肿瘤发生发展的作用,慢性炎症可影响肿瘤细胞糖代谢重编程促进肿瘤发生[1]。炎症与肿瘤相互关系的研究始于19世纪。1800年,Galenus率先提出肿瘤可在炎症和损伤组织中发生的假说[2]。1863年,Virchow观察到肿瘤组织中存在炎症细胞,从而证实了这一假说,进而又提出慢性炎症可诱导肿瘤发生的假说[3]。近期研究发现,高达20%的人类癌症是由慢性炎症和持续感染引起的,即使在尚无炎症的癌症中,炎性细胞也会渗入肿瘤基质并促进癌症发展,这种“肿瘤引起的炎症”进一步揭示了炎症在癌症发生中的重要作用[4]。长期的炎症状态可能会使免疫系统功能紊乱,影响其识别和清除肿瘤细胞的能力;还可能为肿瘤细胞的生长提供炎性微环境,加速肿瘤进程。越来越多的证据表明,溃疡性结肠炎和克罗恩病患者大肠或回肠末端癌变发病率明显升高[5]。幽门螺杆菌已被确认是促进胃癌发生发展的重要致癌因素[6],慢性肝炎病毒感染亦可导致肝癌[7]。另外,慢性胆囊炎和胆囊癌、慢性食管炎和食管癌、人乳头瘤病毒感染引起的宫颈感染和宫颈癌、前列腺炎和前列腺癌及胰腺炎和胰腺癌的发生,亦提示炎症参与调控肿瘤的发生发展。
2 炎症促进糖代谢重编程介导“炎-癌转化”
代谢重编程是肿瘤细胞的的重要特征之一[8]。糖酵解和氧化磷酸化是一紧密偶联的过程[9]。糖酵解是由一系列糖酵解酶介导,最后将葡萄糖转化成乳酸、生成ATP的过程,是肿瘤获得能量以及中间代谢产物的主要方式[10]。糖酵解的中间产物丙酮酸在有氧条件下,进入线粒体被氧化成乙酰辅酶A,参与三羧酸循环和氧化磷酸化。也有人提出有些肿瘤细胞兼具糖酵解和线粒体氧化磷酸化表型,即肿瘤周围的肿瘤相关成纤维细胞在癌细胞的作用下,能量获取方式转向有氧糖酵解,这些肿瘤相关成纤维细胞释放的乳酸、丙酮酸等转移到上皮癌细胞后被其用作能量来源,然后进入三羧酸循环,利用氧化磷酸化产生大量ATP[11]。大量研究表明,肿瘤细胞中的三羧酸循环存在某些缺陷,特别是三羧酸循环中的3种酶——异柠檬酸脱氢酶、琥珀酸脱氢酶和延胡索酸酶经常发生突变,从而在一定程度上促进肿瘤形成[12]。糖酵解受外源信号通路〔如Ras和磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)通路〕和糖酵解酶调控[13],Ras通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和PI3K,促进c-Myc转录,后者直接诱导大量糖酵解相关基因表达,如葡萄糖转运体(glucose transporters,GLUT)1、己糖激酶 2(hexokinase 2,HK2)、磷酸果糖激酶(phosphofructokinase,PFK)、烯醇酶1和乳酸脱氢酶A(lactate dehydrogenase A,LDHA);PI3K通路被配体结合受体酪氨酸激酶激活后,激活蛋白激酶B(protein kinase B,Akt),进而直接激活c-Myc和低氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α),从而促进GLUT1和多种糖酵解酶如HK2、PFK、醛缩酶A和LDHA的表达[14-15]。研究表明,慢性炎症促进癌症发生发展,即“炎-癌转化”的分子机制涉及可溶性炎症介质、癌基因/抑癌基因表达异常及促炎转录因子如NF-κB、信号转导及转录激活因子3(signal transducers and activators of transcription 3,STAT3)和HIF-1α介导的信号通路等之间的互作调控(crosstalk)的肿瘤细胞糖代谢重编程。
2.1 炎症介质介导“炎-癌转化”过程相关细胞糖代谢重编程
2.1.1 白细胞介素1亚家族
IL-1亚家族如IL-1α,IL-1β和IL-33,是在免疫和炎症反应中起核心作用的细胞因子,同时也通过激活包括HK、葡萄糖激酶、PFK和LDHA在内的糖酵解酶的活性调控糖酵解[13]。IL-1β主要由单核细胞、巨噬细胞和树突状细胞表达,当免疫细胞受刺激激活后,NF-κB被激活,继而诱导IL-1β合成[13]。IL-1β通过IL-1受体相关激酶通路激活NF-κB和激活蛋白1(activator protein-1,AP-1),也可通过激活PI3K通路激活NF-κB。在调控糖酵解方面,IL-1β可通过激活腺苷酸活化蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)增加GLUT4的转位,从而增加葡萄糖摄取[16]。IL-1β可促进胶质母细胞瘤HK2mRNA表达上调[17]。口腔鳞状细胞癌肿瘤微环境中分泌增加的IL-1β可促进肿瘤相关成纤维细胞HK2的表达,增加乳酸的生成,为口腔鳞癌细胞增殖提供所需的“燃料”。IL-33可通过IL-33/致癌抑制因子2(suppression of tumorigenesis 2,ST2)通路上调非小细胞肺癌细胞膜GLUT1的表达,从而促进非小细胞肺癌细胞的生长和转移[13](图1)。综上所述,IL-1亚家族很可能成为肿瘤的潜在治疗靶点。
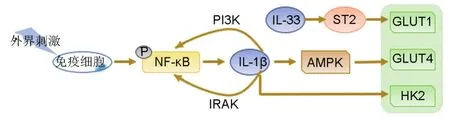
图1 白细胞介素1(lL-1)亚家族对糖酵解的调控作用.PI3K:磷脂酰肌醇3-激酶;IRAK:IL-1受体相关激酶;AMPK:腺苷酸活化蛋白激酶;HK2:己糖激酶2;ST2:致癌抑制因子2;GLUT:葡萄糖转运体;P:磷酸化.
2.1.2 白细胞介素6
IL-6在多种恶性肿瘤中均有显著高表达,并促进肿瘤的发生,同时IL-6是STAT3信号通路的主要触发因子。STAT3含有SH2和SH3结构域,可与特定的含磷酸化酪氨酸的肽段结合后被磷酸化,聚合成为激活的同源或异源二聚体,转位入核与靶基因启动子序列的特定位点结合,促进其转录,参与调控细胞糖酵解。Ando等[18]研究表明,IL-6/STAT3途径通过增强小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)糖酵解酶HK2和6-PFK-2/果糖-2,6-二磷酸酶3(6-PFK-2/fructose-2,6-bisphosphatase-3,PFKFB3)的表达来增强糖酵解。同样在乳腺癌细胞中,STAT3被IL-6激活后可与HK2的启动子结合促进HK2转录激活,调控乳腺癌细胞有氧糖酵解[19]。此外,Demaria等[20]将具有生理活性的STAT3突变体敲入小鼠,从STAT3c/c或STAT3WT/WT小鼠提取原代MEF细胞。分析发现,STAT3c/cMEF细胞糖酵解水平升高依赖于HIF-1α表达上调,且HIF-1α靶基因GLUT1,PFK1和ENO-1表达均显著上调,STAT3c/cMEF细胞表现出Warburg表型,产生更多的乳酸。GO注释分析发现,糖酵解相关基因如丙酮酸脱氢酶激酶1(pyruvate dehydrogenase kinase 1,PDHK1)在STAT3c/cMEF细胞中高表达,PDHK1可使线粒体丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)复合物失活,从而降低丙酮酸生成乙酰辅酶A进入三羧酸循环。STAT3c/cMEF细胞PDH活性降低50%,导致STAT3c/cMEF细胞线粒体呼吸功能减弱,但并不影响线粒体的形态和数量,其原因可能是由STAT3介导下调编码线粒体蛋白质核基因表达引起的。因此,炎症环境下持续激活的STAT3可通过促进糖酵解和抑制线粒体功能2个途径,实现对细胞Warburg效应的调控,促进“炎-癌转化”(图2)。
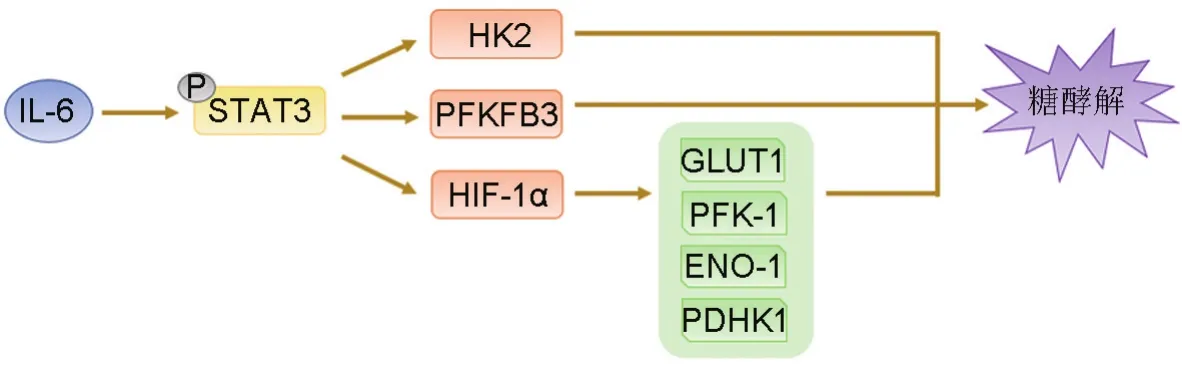
图2 白细胞介素6介导的信号通路对糖酵解的调控作用.PFKFB3:6-磷酸果糖激酶2/果糖-2,6-二磷酸酶;HIF-1α:低氧诱导因子1α;STAT3:信号转导及转录激活因子3;PFK-1:磷酸果糖激酶1;ENO-1:烯醇酶1;PDHK1:丙酮酸脱氢酶激酶1.
2.1.3 肿瘤坏死因子 α和白细胞介素17
TNF-α和IL-17经常存在于急、慢性炎症中,与结肠癌密切相关,是结肠炎相关癌症发病机制中最重要的炎症因子。TNF-α和IL-17可通过激活肿瘤细胞中NF-κB信号通路,促进HIF-1α和c-Myc共同的靶基因GLUT1和HK2表达,协同增加结直肠癌HT-29细胞糖酵解和乳酸生成,进而促进“炎-癌转化”[21]。IL-17和TNF-α共同刺激可增强结直肠癌CaCo-2细胞LDHA活性,促进糖酵解和乳酸生成,而LDH抑制剂通过抑制LDHA活性可阻止炎症诱导的肿瘤细胞Warburg效应,但不影响正常细胞的葡萄糖代谢[21-22](图3)。
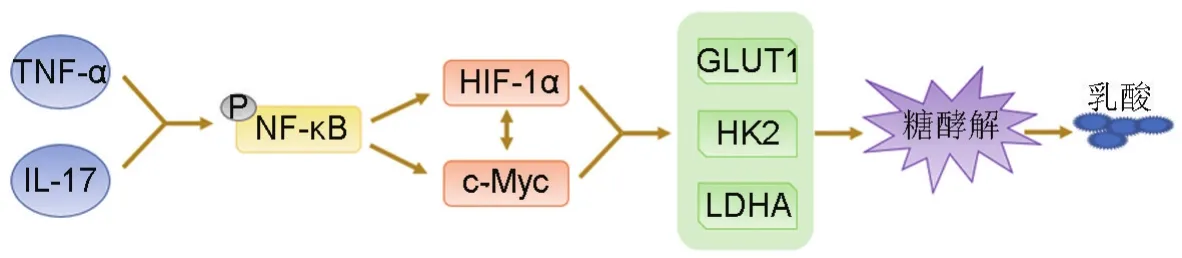
图3 肿瘤坏死因子 α(TNF- α)和白细胞介素17对糖酵解的调控作用.LDHA:乳酸脱氢酶A.
2.1.4 谷氨酰胺转氨酶2
很多研究表明,乳腺癌、胰腺癌、宫颈癌和卵巢癌中谷氨酰胺转氨酶2(transglutaminase 2,TG2)表达上调均与NF-κB激活有关。促炎症蛋白TG2异常表达是乳腺癌细胞中Warburg效应的重要调节因子,TG2通过促进葡萄糖代谢途径的多个基因的转录来重编程乳腺癌细胞的能量代谢。TG2的异常表达启动一个正反馈回路,即TG2通过与NF-κB抑制因子(inhibitor of NF-κB,IκB)聚合导致NF-κB活化,活化的NF-κB又可与HIF-1α启动子结合,即使在常氧条件下也可诱导其表达。HIF-1α可上调糖酵解蛋白如GLUT1,HK2和LDHA的表达,进而影响耗氧速率,通过糖酵解促进葡萄糖的摄取和代谢,增加乳酸的生成,促进葡萄糖代谢的改变。因此,TG2诱导的糖代谢改变有助于乳腺癌细胞在应激条件下生存。抑制TG2或HIF-1α的表达可恢复正常的葡萄糖摄取、乳酸生成、线粒体呼吸速率和糖酵解蛋白的表达[23](图4)。综上所述,TG2/NF-κB/HIF-1α通路在炎症与肿瘤糖代谢重编程之间起着重要作用,促进“炎-癌转化”。
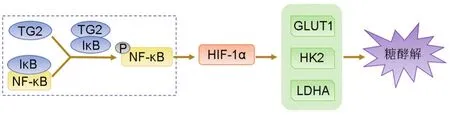
图4 谷氨酰胺转氨酶2(TG2)对糖酵解的调控作用.IκB:NF-κB抑制因子.
2.2 炎症因子介导“炎-癌转化”过程相关细胞糖代谢重编程的作用机制
2.2.1 微RNA上调HK2
微RNA(microRNA,miRNA,miR)是一类长18~25个核苷酸的RNA分子,它通过结合靶基因mRNA的3′非编码区(3′UTR)而抑制基因转录后的表达,在细胞发育、免疫应答、炎症反应和肿瘤发生发展过程中均起到重要调控作用[24]。多种肿瘤相关的非可控性炎症状态或疾病中均发现miRNA的异常表达,如miR-105通过激活Myc依赖通路,调节肿瘤基质细胞能量代谢重编程,促进肿瘤生长,介导非可控性炎症诱导的癌变[25]。miRNA在NF-κB信号通路的调控中也起着重要作用,可抑制或激活该通路[26]。有研究报道,炎症诱导的miR-155通过2种不同的机制上调HK2,进而促进乳腺癌细胞的有氧糖酵解。一方面miR-155可激活STAT3/HK2轴,另一方面其可通过抑制HK2的负调控因子(miR-143的转录激活因子),进而抑制miR-143的表达,从而导致HK2表达上调,最终共同促进乳腺癌细胞的有氧糖酵解[19]。此外,miR-155也可使肝癌和肺癌细胞中HK2表达上调,且miR-155是一种炎症普遍诱导的miRNA,提示miR-155/miR-143/HK2轴可能代表一种将炎症与癌细胞中能量代谢改变相联系的共同机制。
2.2.2 p53抑制NF- κB
最初被鉴定出来时,p53便被当做一个促癌基因,后来才慢慢发现p53具有强大的抑癌作用[27]。NF-κB有促进GLUT表达、增加葡萄糖摄取的作用。Ando等[18]研究发现,敲除小鼠胚胎成纤维细胞的p53基因,可激活NF-κB进而使GLUT3基因表达上调,糖酵解速率增加。Gudkov等[28]也发现,p53基因缺失小鼠NF-κB活性明显增加,并伴有炎症因子升高。上述结果提示,p53抑制NF-κB的表达后有可能通过抑制肿瘤细胞糖代谢重编程,进而阻止肿瘤的发展。
2.2.3 低氧诱导因子1 α表达上调
实体瘤的快速生长易导致低氧和细胞坏死。低氧和肿瘤的坏死区域反过来产生促炎症介质,进而招募更多的免疫细胞,从而抑制肿瘤部位的免疫反应以及促进细胞的增殖、血管生成和转移[29]。HIF-1α既是一种关键的致癌基因又是调控线粒体有氧磷酸化转变成糖酵解代谢途径的转录因子,一氧化氮和炎症细胞因子(TNF-α和IL-1β)可上调HIF-1α的表达[30]。Jung等[30]研究显示,IL-1β通过PI3K/Akt/mTOR途径激活A549细胞中NF-κB,并伴随HIF-1α蛋白水平显著升高;进一步研究发现,IL-1β可激活 NF-κB/环 氧 合酶 2(cyclooxygenase-2,COX-2)信号通路进而导致HIF-1α表达上调(图5)。在胰腺癌和前列腺癌中均发现PI3K/Akt/NF-κB途径激活导致HIF-1α表达上调,促进新生血管的生成和能量的供应,从而促进肿瘤细胞的发生发展[31-32]。此外,HIF-1α和c-Myc共同参与介导TNF-α和IL-17共刺激结肠癌细胞有氧糖酵解,并促进能够刺激成纤维细胞生长和存活的生长因子的生成,从而促进结肠癌的发生发展[21]。综上所述,促炎因子如IL-1β通过PI3K/Akt途径激活NF-κB,进而上调HIF-1α表达,调控肿瘤糖代谢重编程,促进“炎-癌转化”。

图5 转录因子对糖酵解的调控作用.PI3K:磷脂酰肌醇3激
2.2.4 c-Myc表达失调
c-Myc蛋白作为核转录因子,可参与调控糖酵解途径中多种酶的表达,同时也是STAT3信号途径的一部分,其表达受上游基因STAT3的调控[33]。STAT3在肿瘤组织中通常被异常激活,导致其下游靶基因c-myc转录增强,进而促使正常细胞转化为癌细胞。炎症因子可通过激活肿瘤细胞中NF-κB信号通路,促进HIF-1α和c-Myc共同的肿瘤代谢相关靶基因GLUT1和HK2的表达,协同增加结直肠癌细胞的Warburg效应,进而促进“炎-癌转化”[21]。c-myc基因在炎症中也常失调,且在散发性和结肠炎相关的结肠腺癌中过度表达[34]。因此,STAT3可能通过调控c-Myc调节炎症相关肿瘤糖酵解途径相关基因的表达(图5)。
3 靶向肿瘤糖代谢的抗炎中药
肿瘤治疗问题在全世界范围内依然是一个难题,人们试图在探索肿瘤与炎症关系的同时,开始从“炎症”的角度寻找治疗肿瘤的新途径。研究发现,很多抗炎中药或从中提取的单体成分具有显著的抗肿瘤作用。
3.1 具有抗肿瘤活性的抗炎中药
具有抗肿瘤活性的抗炎中药主要包括解表药(如柴胡)、清热药(如黄连和苦参)、泻下药(如大黄)、祛风湿药(如独活和雷公藤)、芳香化湿药(如苍术和草豆蔻)、利水渗湿药(如茯苓、茵陈和薏苡仁)、止血药(如三七)、化痰止咳平喘药(如苦杏仁)、开窍药(如麝香)、补虚药(如甘草)、活血化瘀药(如姜黄)和驱虫药(如苦楝皮)等[35]。已有研究报道,抗炎中药中的单体成分可通过一些潜在靶点或通路调控肿瘤糖代谢(表1),提示这些潜在靶点可能代表一种将炎症与癌细胞中能量代谢改变联系起来的共同机制,尚待深入研究。
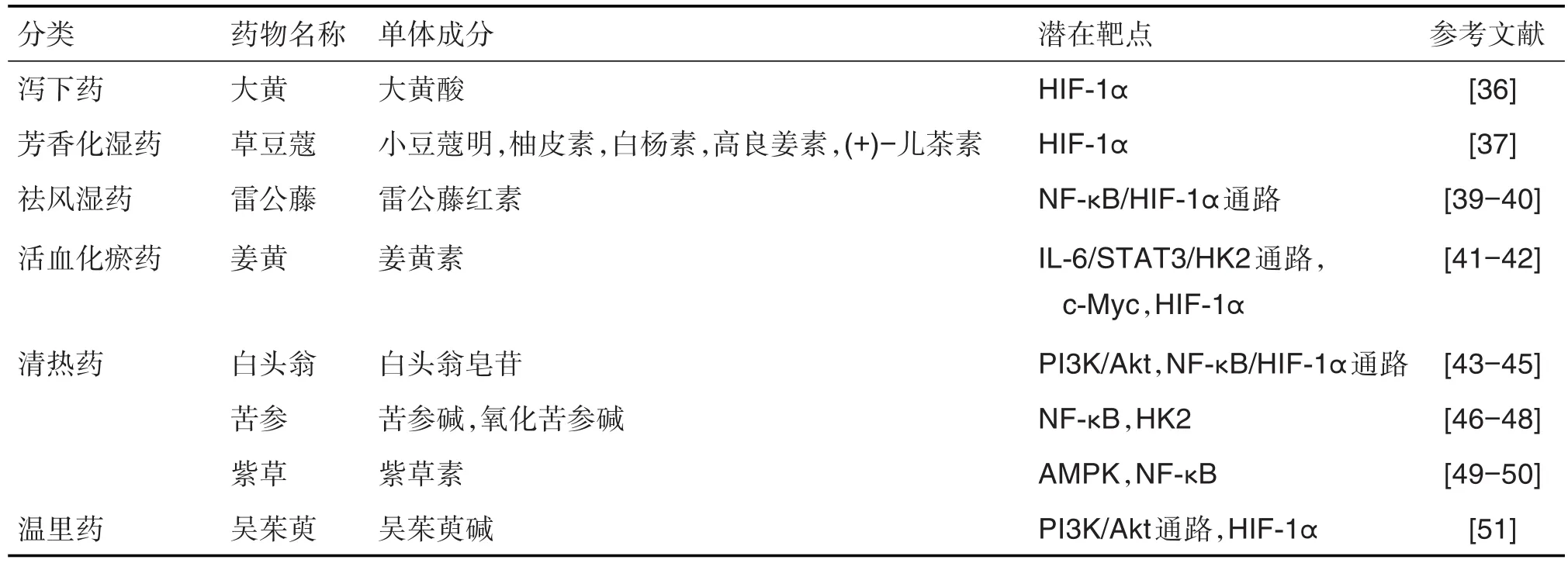
表1 抗炎抗肿瘤中药调控糖代谢重编程的潜在靶点
3.2 抗炎中药的活性单体成分
大黄酸对癌细胞的糖酵解有抑制作用[36]。化湿中药草豆蔻黄酮类活性成分小豆蔻明、柚皮素、白杨素、高良姜素和(+)-儿茶素等均有抗肿瘤活性,且均能改善胰岛素抵抗、调节糖代谢[37]。小豆蔻明通过抑制HIF-1α依赖性代谢重编程抑制乳腺癌的生长[38]。
雷公藤的主要活性成分之一雷公藤红素与另一种中药单体汉黄芩素联用,可明显降低人胃癌细胞SGC-7901内HIF-1α和单羧酸转运蛋白4蛋白表达,降低HK2和LDH活性,抑制糖酵解产生能量和乳酸生成。此外,二者联用可抑制胃癌细胞内氧化磷酸供能,最终抑制胃癌细胞的增殖和转移[39]。同时也有研究表明,雷公藤红素能通过靶向NF-κB显著抑制细胞促炎症反应,提示雷公藤红素在“炎-癌转化”进程中可能通过抑制NF-κB进而抑制与能量代谢相关的癌基因,最终抑制肿瘤生长。雷公藤的另一活性成分雷公藤内酯醇体外可高效杀死多种类型的癌细胞,在炎症相关自发性癌小鼠模型中,雷公藤内酯醇与乙酰水杨酸(阿司匹林)低剂量联用可显著阻断体外癌细胞增殖和体内肿瘤形成,且联用能阻断NF-κB介导的人肺癌细胞H460增殖和存活基因的表达[40],提示雷公藤内酯醇也可能通过NF-κB信号通路影响肿瘤糖代谢重编程。
姜黄的主要活性成分姜黄素可下调食管癌Ec109细胞中糖酵解关键酶如HK2、PFKFB3、丙酮酸激酶 M2型(pyruvate kinase M2,PKM2)和GLUT4蛋白表达水平,从而抑制肿瘤细胞的糖代谢[41]。此外,姜黄素可通过抑制IL-6/STAT3信号通路抑制溃疡性结肠炎[42],推测姜黄素可通过抑制IL-6/STAT3通路介导的糖代谢重编程从而发挥抗肿瘤的作用。Vaughan等[1]研究了低水平的TNF-α与抗炎药姜黄素对乳腺上皮细胞系MCF-10A和MCF-7有氧糖酵解和线粒体代谢的影响。发现微环境因子(低水平的TNF-α)可作为恶性和非恶性乳腺上皮细胞系有氧糖酵解以及抑制其线粒体生物合成的直接诱导因子,与IL-17协同诱导肿瘤细胞中HIF-1α和c-Myc的表达;在无癌基因表达的情况下,非恶性MCF-10a细胞可以通过细胞外信号激活类似肿瘤的代谢,而姜黄素可逆转TNF-α诱导的有氧糖酵解和线粒体含量下降。表明肿瘤的形成可能发生在基因突变之前,而炎症介导的肿瘤细胞糖代谢重编程可能是“始作俑者”。
白头翁的活性成分之一白头翁皂苷可通过抑制HIF-1α调控肿瘤能量代谢。已有研究表明,白头翁皂苷可通过降低肝癌细胞Bel-7402乳酸和ATP含量,并可降低糖酵解关键酶HK2、PFK、丙酮酸激酶的含量,升高琥珀酸脱氢酶含量来抑制肿瘤生长[43]。另有研究表明,白头翁皂苷通过降低HT29细胞Akt基因和蛋白水平进而抑制HIF-1α的表达,最终抑制GLUT1对葡萄糖的转运,降低糖酵解相关酶的含量和活性,影响肿瘤细胞能量代谢抑制肿瘤生长[44]。此外,白头翁皂苷可通过IL-1,IL-6和TNF-α等炎症介质发挥抗炎作用[45]。因此,白头翁皂苷有望成为通过抑制炎性介质介导“炎-癌转化”细胞糖代谢重编程进而发挥抗肿瘤活性的抗炎中药单体成分。
苦参碱和氧化苦参碱联合使用可显著降低肝癌细胞HepG2中糖酵解关键酶HK2和丙酮酸激酶活性及有氧氧化关键酶琥珀酸脱氢酶,使得糖酵解产物乳酸和细胞总ATP含量降低,通过影响肿瘤细胞能量代谢进而抑制肿瘤细胞的增殖[46]。此外,苦参碱和氧化苦参碱均通过NF-κB发挥抗炎作用[47-48]。基于P53可通过抑制糖酵解来限制IkB激酶β/NF-κB通路的激活、进而诱导细胞凋亡的研究,提示苦参碱和氧化苦参碱可能通过该机制抑制炎症促进肿瘤细胞糖代谢重编程进而发挥抗肿瘤作用。
紫草素是紫草的主要的活性成份,属于萘醌类化合物,可作为PKM2的抑制剂。在肝癌细胞HCCLM3中,紫草素可抑制线粒体中PKM2的表达进而激活AMPK信号通路,使p-AMPK和过氧化物酶体增殖物激活受体γ辅激活因子1α的表达增加,这些发生变化的蛋白参与细胞能量代谢,紫草素最终通过引起肝癌细胞线粒体功能紊乱进而抑制肝癌[49]。此外,紫草素主要通过影响NF-κB,IL-1β,IL-6,TNF-α和IL-17等发挥抗炎作用[50]。提示紫草素可能通过抑制炎症介质介导的“炎-癌转化”细胞能量代谢重编程发挥肿瘤抑制作用。
吴茱萸的主要有效成分吴茱萸碱主要通过降低Akt和P70核糖体蛋白S6激酶的磷酸化进而抑制低氧诱导的COX-2表达。同时,吴茱萸碱可通过下调肝癌细胞HepG2内HIF-1α,PI3K/Akt和PFK基因的表达,抑制糖代谢通路进而发挥抗肿瘤活性[51]。
白杨素是从紫葳科植物木蝴蝶中提取的一种具有广泛药理活性的黄酮类化合物,参与Ras/Raf/MAPK,PI3K/Akt,STAT和NF-κB等信号通路发挥抗癌活性。白杨素可通过降低肝癌细胞HK2的表达进而抑制糖酵解,激活线粒体相关凋亡[52]。白杨素抗炎作用与调控Janus激酶/STAT通路有关[53]。上述研究提示,白杨素可能在“炎-癌转化”进程中重编程肿瘤细胞能量代谢。
4 结语
炎症参与介导肿瘤细胞糖代谢重编程,从而促进肿瘤的发生、发展与转移,是“炎-癌转化”中的关键步骤,炎性介质都参与到炎性微环境“炎-癌转化”细胞糖代谢重编程的过程中。因此,可借助目前高通量筛选技术如单细胞测序、转录组学、蛋白组学、代谢组学和表观遗传学等捕获发挥重要作用的细胞及其亚型,并探知未知的具有重要功能的基因和蛋白、转录翻译后修饰。再结合常规的实时荧光定量PCR、Western印迹法、免疫共沉淀、染色质免疫沉淀、蛋白相互作用和质谱技术等,进一步验证和研究新基因或(和)蛋白的生物功能,从而阐明炎症介导的肿瘤细胞糖代谢重编程在“炎-癌转化”中的重要作用及分子机制。基于肿瘤细胞糖代谢重编程,从抗炎中药及其活性成分中筛选靶向肿瘤细胞糖代谢的抗肿瘤活性成分,或从肿瘤细胞糖代谢途径着手揭示已知抗肿瘤活性的抗炎小分子化合物的分子机制,可能是一种高效的研发抗肿瘤药物的途径。

