肌萎缩侧索硬化症和额颞叶痴呆疾病相关9号染色体开放阅读框72基因(C9orf72)突变产物二肽重复蛋白对HeLa细胞线粒体生物学功能的影响
张亚昆,高 俊,韩秋影,潘 欣,李爱玲,李 腾
(国家生物医学分析中心,北京 100850)
9号染色体开放阅读框72基因(open reading frame 72 gene on chromosome 9,C9orf72)内六核苷酸GGGGCC的异常重复是肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)和额颞叶痴呆(frontotemporal dementia,FTD)最常见的遗传病因[1-2],该突变在家族性ALS和FTD病例中分别占16%和20%,在ALS散发病例中亦有6%~8%[3]。在突变体中,六核苷酸序列GGGGCC异常重复25~1000次,而在正常个体中该序列仅重复2~23次[3],这种突变在ALS和FTD病因中的作用目前尚不清楚。有学者提出了一些机制解释该突变的致病性,其一是六核苷酸重复序列非常规翻译产物二肽重复蛋白(dipeptide repeat protein,DRP)自正义转录本的聚-甘氨酸-丙氨酸(poly-GA)、聚-甘氨酸-脯氨酸(poly-GP)和聚-甘氨酸-精氨酸(poly-GR),以及来自反义转录本的聚-脯氨酸-丙氨酸(poly-PA)、聚-脯氨酸-精氨酸(poly-PR)和poly-GP,共5种DRP,这些DRP具有毒性并在ALS和FTD患者的大脑中形成聚集体,被认为是神经元损伤的重要因素[4-7]。虽然形成5种DRP形成,但富含精氨酸的poly-GR和-PR在果蝇的神经发育模型及体外培养的神经元中剧毒[8-9],而类似表达水平的poly-PA,poly-GA和poly-PG则无明显毒性[10]。
线粒体作为细胞能量供给和物质代谢的重要场所,参与细胞内多种信号通路调节,如ATP合成、细胞凋亡和自由基生成等。人的大脑是高耗能器官,其重量约占人体重的2%,却消耗线粒体产生能量的20%[11]。神经元具有多种复杂的胞体延伸结构,如树突和轴突,需要线粒体输运到合适的部位。此外,线粒体参与的钙离子稳态是突触传导等神经元活动顺利进行的基础[12-13]。随着研究的深入,越来越多的研究表明,线粒体功能障碍在ALS和FTD等神经退行性疾病的发生发展过程中起重要作用。但这是由于ALS和FTD相关蛋白在线粒体功能、转运或动力学中的直接作用,还是由于神经元变性、炎症或压力反应所致尚不清楚[14]。
为此,本研究以HeLa细胞为研究对象,初步探索富含精氨酸的剧毒poly-PR和poly-GR以及相对可耐受的与ALS和FTD发病无关的poly-GA对线粒体形态、数量、膜电位、氧化应激和ATP水平的影响,以期为阐明ALS和FTD的发病机制提供依据。
1 材料与方法
1.1 细胞、试剂和仪器
293T细胞和HeLa细胞由本实验室传代培养。哺乳动物细胞表达载体p-EGFP-C1和慢病毒载体pCDH-MCS-T2A-puromycin-MSCV及pEGFP-C1-PR50,-GR50和-GA50由本实验室保存;重复4次的人细胞色素c氧化酶亚基Ⅷ线粒体定位序列(4mt)由擎科公司合成;Taq Mix、T4 DNA连接酶、NheⅠ、AgeⅠ、EcoRⅠ和NotⅠ限制性内切酶及转染试剂Lipofectamine 2000(美国Thermo Fisher Scientific公司);DL2000 DNA和DL15000 DNA分子质量标准(北京GenStar公司);BM无缝克隆试剂盒、硫酸卡那霉素、氨苄青霉素和E.coliDH5α感受态大肠杆菌(北京博迈德生物公司);质粒提取和胶回收试剂盒(美国Promega公司);钙转染试剂(中科迈晨公司);增强型ATP检测试剂盒(碧云天公司);DMEM培养基、青霉素、链霉素和胎牛血清(美国Gibco公司);山羊抗兔绿色荧光蛋白(green fluorescent protein,GFP)多克隆抗体(美国Abcam公司);四甲基罗丹明甲酯(tetramethylrhodamine,TMRM)和线粒体超氧化物指示剂MitoSOX(美国Thermo Fisher Scientific公司);上、下游引物合成及测序由擎科公司完成。5424R和5810R离心机(美国Eppendorf公司);细菌超净台和细胞超净台(苏州Airtech公司);核酸凝胶成像系统、细菌培养箱、PCR仪器和二氧化碳细胞培养箱(美国Thermo Fisher Scientific公司);琼脂糖凝胶电泳仪和SDS-聚丙烯酰胺凝胶电泳仪(美国Bio-Rad公司);DeltaVision Ultra高分辨率活细胞显微成像系统(美国Cytiva公司)。
1.2 线粒体定位序列4mt的鉴定和回收
线粒体定位序列4mt由擎科公司合成在载体pEGFP-N1上,上游酶切位点是NheⅠ,下游酶切位点是PstⅠ,PstⅠ之后是AgeⅠ酶切位点。克隆构建用酶切位点是NheⅠ和AgeⅠ。该线粒体定位序列属于前导肽,在引导蛋白穿膜后会被剪切掉。将合成的4mt-EGFP-N1质粒进行NheⅠ和AgeⅠ双酶切,将双酶切产物进行1.5%琼脂糖凝胶电泳,鉴定4mt相对分子质量是否正确,随后切下目的条带,进行胶回收。
1.3 重组质粒4mt-EGFP-C1及4mt-EGFP-C1-PR50,-GR50和-GA50的构建
对空载体pEGFP-C1及pEGFP-C1-PR50,-GR50和-GA50进行双酶切,酶切位点为NheⅠ和AgeⅠ,双酶切产物经1%琼脂糖凝胶电泳后切下目的条带进行胶回收。用T4 DNA连接酶将胶回收的线性化载体与1.2回收的线粒体定位序列4mt在16℃条件下连接过夜。第2天将连接产物转化感受态大肠杆菌E.coliDH5α,涂布于卡那霉素抗性的LB固体培养基,37℃细菌恒温培养箱倒置培养16 h,形成肉眼可见的单个菌落,而后进行菌落PCR鉴定,引物序列见表1。挑选阳性菌落送测序公司测序。测序正确的菌落接种于卡那霉素抗性的液体LB培养基,37℃摇床培养14 h,收集菌体,提取质粒并将质粒进行双酶切,鉴定重组质粒4mt-EGFP-C1及4mt-EGFP-C1-PR50,-GR50和-GA50构建成功。

Tab.1 Primers of 4mt-pEGFP-C1 used for colony PCR
1.4 Western印迹法检测4mt-EGFP-PR50,-GR50和-GA50重组质粒在293T细胞中的表达
将构建成功的重组质粒4mt-EGFP-C1及4mt-EGFP-C1-PR50,-GR50和-GA50及空载体pEGFPC1用Lipofectamine 2000转染293T细胞,24 h后裂解细胞收集蛋白质,经Bradford法蛋白质定量后进行SDS-PAGE凝胶电泳。电泳后将蛋白转印至PVDF膜,用含5%牛血清白蛋白的TBST溶液25℃孵育封闭1 h。用山羊抗兔GFP抗体(1∶1000)将PVDF膜4℃孵育过夜,而后用辣根过氧化物酶标记的山羊抗兔IgG抗体(1∶5000)25℃孵育1 h后,加入Western发光检测液进行检测。据其相对分子质量判断4mt-EGFP-PR50,-GR50和-GA50是否正确表达。
1.5 用Lipofectamine 2000转染试剂将重组质粒转染HeLa细胞
HeLa细胞培养在含链霉素和青霉素及10%胎牛血清的DMEM培养基中。后续传代时,胰酶消化后计数,以每孔4×104~6×104将HeLa细胞接种在8孔腔室盖玻片中(Nunc),置37℃,5% CO2细胞培养箱培养。待细胞密度达50%~60%时进行转染。转染前1 h换为含10%胎牛血清的DMEM培养基(无抗生素)。50 μL Opti-MEM培养基与0.3 μL Lipofectamine 2000混匀(A液),室温静置5 min。将重组质粒4mt-EGFP-C1及4mt-EGFP-C1-PR50,-GR50和-GA50 0.15 μg分别与50 μL Opti-MEM培养基混匀(B液),室温静置5 min。将B液缓慢加到A液中轻柔混匀,室温静置15 min,逐滴加入HeLa细胞(8孔腔室盖玻片中)并混匀。重组质粒4mt-EGFP-C1为对照组,4mt-EGFP-C1-PR50,-GR50和-GA50为实验组。37℃,5% CO2细胞培养箱常规培养,6 h后换含双抗的DMEM培养基,继续培养48 h。
1.6 线粒体染色
HeLa细胞转染48 h后,将含有染料TMRM 100 nmol·L-1和 MitoSOX 2 μmol·L-1的完全培养基分别加入对应的8孔腔室盖玻片中。37℃,5% CO2细胞培养箱孵育30 min,用PBS洗3次后加入低背景缓冲溶液,即改良的Krebs-Ringer缓冲液(KRB)(mmol·L-1:NaCl 125,KCl 5,Na3PO41,MgSO41,葡萄糖5.5,HEPES 20,pH 7.4),随后用DeltaVision Ultra宽场荧光显微成像。
1.7 DeltaVision Ultra宽场荧光显微成像
利用488,561和405 nm激发光对TMRM和MitoSOX染色的HeLa细胞进行成像采集。每视野以0.5 μm间隔共采集8 μm厚度覆盖整个细胞,将不同层的图片进行Z轴叠加(max intensity)获得最终图像,观察线粒体形态,计数线粒体数目,并定量分析线粒体功能。
1.8 HeLa细胞中线粒体形态和数目检测
将成功转染重组质粒的HeLa细胞,应用Volocity 3D图像分析软件(Perkin Elmer),圈选不同视野的表达绿色荧光的细胞作为感兴趣区域(region of interest,ROI区域),所选择的细胞空间上与其他细胞分开,且细胞内线粒体空间不叠加。通过软件自动计算每个细胞ROI区域内的线粒体数目,每组计算3次重复实验共>150个细胞内线粒体数目,取均值。
1.9 线粒体功能定量分析
首先利用Image J(NIH)软件自由选择(freehand selections)功能圈选每组中表达绿色荧光的HeLa细胞作为ROI区域,所选择的细胞需要空间上与其他细胞分开,且形态正常。而后在每个视野中选择与单细胞大小相似的区域作为背景区域。通过软件自动计算每个细胞ROI区域内的绿色荧光平均荧光强度并减去背景区域平均荧光强度后,获得实际每个细胞的荧光强度,最后计算3次重复实验细胞中TMRM(共60个细胞)和MitoSOX染色(共150个细胞)的平均荧光强度,分别反映线粒体膜电位和氧化应激水平。
1.10 慢病毒包装转染稳定表达4mt-EGFP及4mt-EGFP-PR50,-GA50和-GR50 HeLa细胞系构建及细胞内ATP水平检测
设计含有pCDH-MCS-T2A-puromycin-MSCV载体同源臂的引物,引物序列forward:GAGCTAGAGCTAGCGAATTCAGTGAACCGTCAGATCCGCTAGC(5′-3′),reverse:TCCTCTGCCCTCAGCGGCCGCTCTAGATCCGGTGGATCC(5′-3′),用于扩增 4mt-EGFP 及 4mt-EGFP-PR50,-GA50和-GR50片段及后续菌落PCR鉴定,载体克隆构建的酶切位点为EcoRⅠ和NotⅠ。将上述扩增的4mt-EGFP及4mt-EGFP-PR50,-GA50和-GR50片段与线性化pCDH-MCS-T2A-puromycin-MSCV载体通过BM无缝克隆试剂盒进行重组连接,连接产物转化E.coliDH5α,经菌落PCR和DNA测序最终获得表达4mt-EGFP及4mt-EGFP-PR50,-GA50和-GR50的重组质粒。
将上述重组质粒通过磷酸钙法转染293T细胞进行慢病毒包装,用病毒转染HeLa细胞,通过嘌呤霉素筛选最终获得稳定表达4mt-EGFP及4mt-EGFP-PR50,-GR50和-GA50的HeLa细胞系。
将稳定表达4mt-EGFP及4mt-EGFP-PR50,-GR50和-GA50的HeLa细胞每组3复孔,通过增强型ATP检测试剂盒检测细胞内ATP水平。实验重复3次。
1.11 统计学分析
实验结果数据以±s表示,使用GraphPad Prism 8.0.2软件,多组间比较采用单因素方差分析,各组与对照组比较采用Dunnettt检验。P<0.05为差异具有统计学意义。
2 结果
2.1 线粒体定位序列4mt鉴定
将合成的4mt-EGFP-N1质粒进行NheⅠ和AgeⅠ双酶切,经1%琼脂糖凝胶电泳,可见约500 bp处有一条带(图1),与预期的线粒体定位序列4mt(430 bp)大小符合。

Fig.1 4mt-EGFP-N1 plasmid identified by NheⅠand AgeⅠ enzyme digestion.M:DNA marker;lane 1:4mt-EGFPN1 plasmid enzyme digestion product;lane 2:pEGFP-N1 vector enzyme digestion product;lane 3:4mt-EGFP-N1 plasmid;lane 4:pEGFP-N1 vector.
2.2 重组质粒4mt-EGFP-C1及4mt-EGFP-C1-PR50,-GR50和-GA50鉴定
经菌落PCR鉴定(图2)初步筛选出阳性克隆,随后将测序正确的重组质粒4mt-EGFP-C1及4mt-EGFP-C1-PR50,-GR50和-GA50进行双酶切鉴定(图3),可见在约500 bp处有特异性条带,表明重组质粒4mt-EGFP-C1及4mt-EGFP-C1-PR50,-GR50和-GA50构建成功。

Fig.2 Colony PCR identification of recombinant plasmids 4mt-EGFP-C1 and 4mt-EGFP-C1-PR50,-GR50 and-GA50.PR50:50 repeats of proline-arginine;GR50:50 repeats of glycine-alanine;GA50:50 repeats of glycine-arginine.Lanes 1-6 in A:PCR results of the 1-6 clones of 4mt-EGFP-C1-PR50;lanes 9-14 in A:PCR results of the 1-6 clones of 4mt-EGFP-C1-GA50;lanes 1-6 in B:PCR results of the 1-6 clones of 4mt-EGFP-C1-GR50 in B;lanes 9-14 in B:PCR results of the 1-6 clones of 4mt-EGFP-C1;lanes 7 and 15:negative control(using DH5α as template);lanes 8 and 16:positive control(using 4mt-EGFP-N1 as template);M:DL2000 DNA marker.
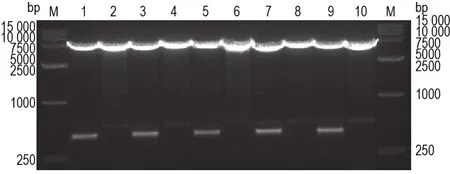
Fig.3 4mt-EGFP-C1,and 4mt-EGFP-C1-PR50,-GR50 and-GA50 recombinant plasmids identified by NheⅠand AgeⅠ enzyme digestion.Lane 1:4mt-EGFP-C1-PR50;lane 2:pEGFP-C1-PR50;lane 3:4mt-EGFP-C1-GA50;lane 4:pEGFP-C1-GA50;lane 5:4mt-EGFP-C1-GR50;lane 6:pEGFP-C1-GR50;lane 7:4mt-EGFP-C1;lane 8:pEGFP-C1;lane 9:4mt-EGFP-N1(positive control);lane 10:pEGFP-N1;M:DL15000 DNA marker.
2.3 重组质粒转染293T细胞4mt-EGFP-PR50,-GR50和-GA50蛋白表达鉴定
用Western印迹法检测重组质粒4mt-EGFP-C1及4mt-EGFP-C1-PR50,-GR50和-GA50及空载体pEGFP-C1转染293T细胞4mt-EGFP-C1-PR50,-GR50和-GA50蛋白表达。结果(图4)显示,所有重组质粒在293T细胞中表达正确。
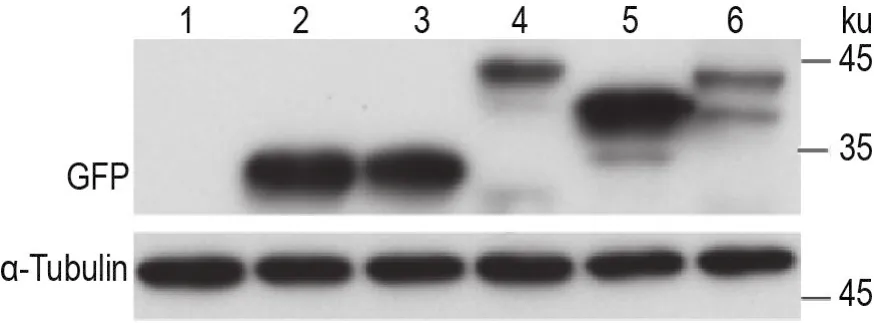
Fig.4 ldentification of 4mt-EGFP-PR50,-GR50 and-GA50 protein expressions in 293T cells by Western blotting.Lane 1:293T cells;lane 2:pEGFP-C1 expressed 293T cells;lane 3:4mt-EGFP-C1 expressed 293T cells;lane 4:4mt-EGFPC1-PR50 expressed 293T cells;lane 5:4mt-EGFP-C1-GA50 expressed 293T cells;lane 6:4mt-EGFP-C1-GR50 expressed 293T cells.
2.4 PR50,GA50和GR50对HeLa细胞线粒体数目和形态的影响
4mt-EGFP-C1及4mt-EGFP-C1-PR50,-GR50和-GA50重组质粒转染HeLa细胞48 h后,宽场荧光显微镜成像结果(图5)显示,上述DRP定位于线粒体,表明构建的线粒体定位序列4mt在HeLa细胞中功能表达正常。与4mt-EGFP-C1组相比,4mt-EGFP-PR50和4mt-EGFP-GR50组线粒体形态结构变成点状分布,线粒体数目显著增加(P<0.05);4mt-EGFP-GA50组线粒体形态无改变。推测PR50和GR50可破坏线粒体内某些蛋白质功能,从而导致线粒体分裂(fission)增加。

Fig.5 Effect of PR50,GR50 and GA50 on mitochondrial morphology and number in HeLa cells.48 h after transfection of plasmids 4mt-EGFP-C1,and 4mt-EGFP-C1-PR50,-GR50 and-GA50,the cells were observed under DeltaVision Ultra wide-field fluorescence microscopy.The cells were transfected with 4mt-EGFP-C1 as the control group.A:images of transfected cells;B:the average number of mitochondria per cell from a total of 150 cells each group.±s,n=150.*P<0.05,compared with control group.
2.5 PR50,GR50和GA50对HeLa细胞线粒体膜电位的影响
结果(图6)显示,与4mt-EGFP-C1对照组相比,4mt-EGFP-PR50和4mt-EGFP-GR50组细胞线粒体膜电位显著降低(P<0.05,P<0.01);而4mt-EGFP-GA50组线粒体膜电位变化无统计学差异。

Fig.6 Effect of PR50,GR50 and GA50 on mitochondrial membrane potential in HeLa cells.48 h after transfection of plasmids 4mt-EGFP-C1,and 4mt-EGFP-C1-PR50,-GR50 and-GA50,the HeLa cells were treated with tetramethylrhodamine methyl ester(TMRM)100 nmol·L-1for 30 min at 37℃.The cells were transfected with 4mt-EGFP-C1 as the control group.A:images of transfected cells performed by deltavision ultra wide-field fluorescence microscopy;B:the average fluorescent relative intensity(FRI)of TMRM staining in a total of 60 cells each group.±s,n=60.*P<0.05,**P<0.01,compared with control group.
2.6 PR50,GA50和GR50对HeLa细胞内线粒体氧化应激的影响
结果(图7)显示,与4mt-EGFP-C1组相比,4mt-EGFP-PR50和4mt-EGFP-GR50组细胞线粒体氧化应激增强(P<0.01,P<0.05),而4mt-EGFPGA50组细胞氧化应激变化无统计学差异。
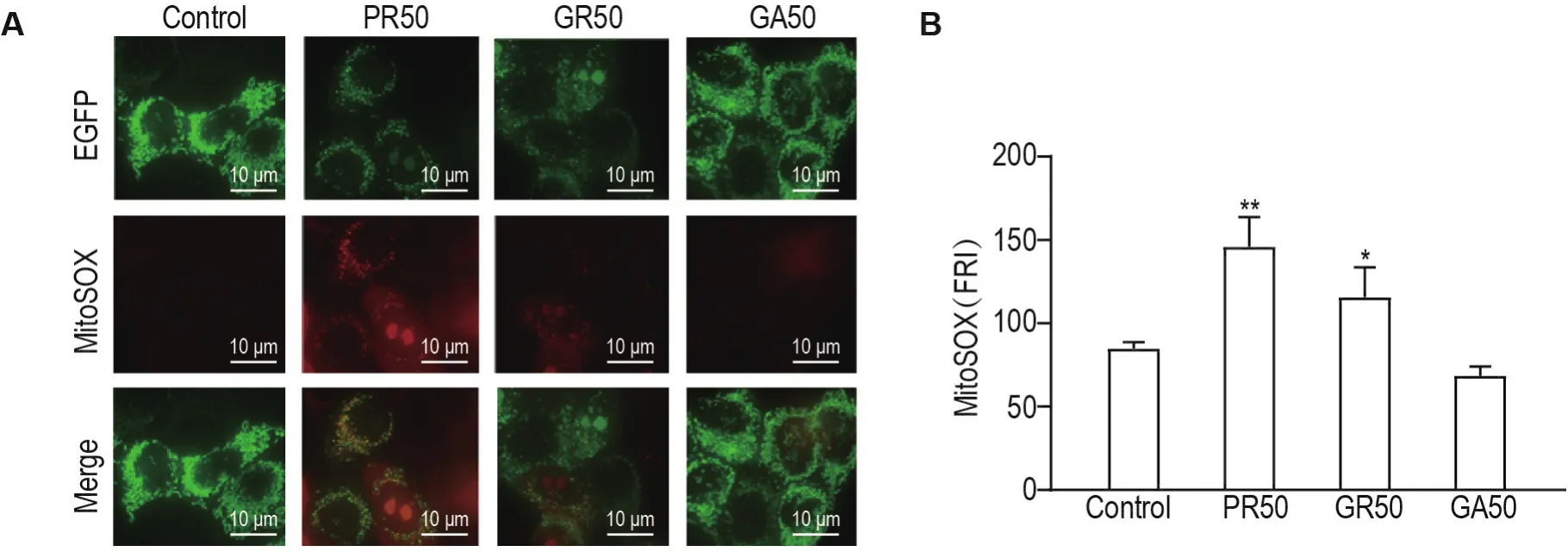
Fig.7 Effect of PR50,GR50 and GA50 on mitochondrial oxidative stress in HeLa cells.48 h after transfection of plasmids 4mt-EGFP-C1,and 4mt-EGFP-C1-PR50,-GR50 and-GA50,the HeLa cells were treated with mitochondrial superoxide red fluorescent probe(MitoSOX)2 μmol·L-1for 30 min at 37℃.The cells were transfected with 4mt-EGFP-C1 as the control group.A:images of transfected cells performed by DeltaVision Ultra wide-field fluorescence microscopy;B:the average FRI of MitoSOX staining in a total of 150 cells each group.±s,n=150.*P<0.05,**P<0.01,compared with control group.
2.7 PR50,GA50和GR50对HeLa细胞内ATP水平的影响
结果(图8)显示,与4mt-EGFP-C1组相比,4mt-EGFP-PR50和4mt-EGFP-GR50组HeLa细胞内 ATP 显著降低水平(P<0.01),4mt-EGFPGA50组细胞内ATP水平变化无统计学差异。

Fig.8 Effect of PR50,GR50 and GA50 on ATP levels in HeLa cells.HeLa cells were infected with lentivirus and screened with puromycin to obtain the HeLa cell lines stably expressing dipeptide repeat proteins PR50,GR50 and GA50,then the ATP level in the cells was detected by ATP assay kit.The cells expressing 4mt-EGFP-C1 was the control group.±s,n=3.**P<0.01,compared with control group.
3 讨论
ALS病理特征为上运动神经元和下运动神经元的大量丢失,患者通常在发作1~5年内死于呼吸衰竭。FTD的特征是额叶颞叶进行性缺陷。C9orf72基因中六核苷酸序列的重复扩增是两者最常见的遗传病因。人们提出一些机制解释了该突变的致病性,一是该突变导致C9rof72蛋白功能不足[15];二是六核苷酸正义和反义RNA的毒性,它将RNA结合蛋白质和其他因子隔离到不溶性RNA区域[16];三是六核苷酸重复序列非ATG起始的翻译,产生有毒的DRP[4-5]。
研究报道,ALS和FTD患者早期即出现大脑内新陈代谢率下降和线粒体功能紊乱等病理特征[17]。另据报道,神经退行性疾病患者的神经元中普遍存在线粒体分裂现象,同时还伴随异常的线粒体分布[18]。但对其原因尚不清楚。鉴于线粒体的分裂融合和线粒体功能的密切相关性,也提示线粒体功能紊乱在神经退行性疾病的发病过程中扮演着重要的角色。线粒体是高度动态的细胞器,线粒体的动态变化包括融合和分裂2个过程。线粒体的形态与数量以及定位与功能是维持神经元功能与生存的基础。作为细胞内的代谢核心,线粒体结构和功能的改变直接影响细胞的结局[19]。异常的线粒体动态变化可能是造成线粒体功能紊乱及退行性神经病变的关键诱因之一。目前并不清楚C9rof72基因产物是否参与调控细胞能量代谢与线粒体功能。研究表明,细胞内的确有一部分C9orf72蛋白可被转运至线粒体膜间隙中[20]。
有研究发现,通过降低线粒体动力相关蛋白含量抑制线粒体分裂的发生,能缓解线粒体功能紊乱以及防止突触的丢失[21],提示线粒体形态异常对疾病进程产生关键性影响,线粒体动态变化可作为潜在的治疗靶点。线粒体是活性氧簇(reactive oxygen species,ROS)的主要来源和作用靶点。当ROS过量时,线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)开放,导致线粒体膜通透性增加及膜电位下降,线粒体功能发生障碍;MPTP的开放进一步释放大量ROS,形成恶性循环,最终导致不可逆的细胞凋亡[22-25]。ROS的变化及其引起的线粒体损伤和细胞凋亡是神经退行性疾病的重要病因之一[26]。为更直接研究C9orf72基因突变的产物DRP与线粒体功能之间的联系,本研究构建了带线粒体定位序列的重组质粒4mt-EGFP-C1-PR50,-GR50和-GA50,转染HeLa细胞后分析线粒体的形态和数量、膜电位及氧化应激反应;还构建了稳定表达4mt-EGFP-C1-PR50,-GR50和-GA50的HeLa细胞系,分析PR50,GR50和GA50对HeLa细胞内ATP水平的影响。研究结果表明,富含精氨酸的GR50和PR50蛋白进入线粒体后可导致线粒体分裂数量增加、膜电位下降以及ATP水平下降,同时诱发氧化应激反应,线粒体的生物学功能严重受损。而与ALS和FTD发病无关的GA50则未造成线粒体损伤。以上结果表明,C9orf72基因突变产物PR50和GR50可能通过影响线粒体功能促进ALS和FTD的发生发展。本研究为阐明ALS和FTD发病机制提供了重要数据。

