瑞芬太尼通过调控miR-212-3p/LIN28B表达影响子宫内膜癌细胞的增殖、迁移和侵袭
唐婧英 李选发 邓小华 陈俏江 吴向雅
(1海南省人民医院麻醉科,海南 海口 570311;2海南医学院第二附属医院麻醉科;3海南省定安县人民医院麻醉科)
子宫内膜癌是女性生殖系统常见的恶性肿瘤,具有较高的发病率和致死率,对女性生命健康造成极大的威胁。子宫内膜癌的治疗以手术为主,辅助放疗、化疗等。但是患者预后较差,5年生存率较低〔1〕,因此寻找早期治疗靶点和有效药物是肿瘤治疗研究的热点。阿片类药物在晚期癌痛的治疗中较为常用,瑞芬太尼是一种阿片类药物,主要用于临床麻醉〔2〕。研究显示,瑞芬太尼可通过抑制Akt通路及调控B细胞淋巴瘤(Bcl)-2/Bcl-2相关X蛋白(Bax)表达抑制胰腺癌细胞增殖,并促进其凋亡〔3〕。然而,瑞芬太尼能否影响子宫内膜癌细胞恶性行为还未知。miR-212-3p是一种微小RNA(miRNA),其在骨肉瘤、胰腺癌、胃癌等细胞中低表达,与肿瘤细胞的增殖、侵袭和迁移等密切相关,是潜在的治疗靶点〔4~6〕。生物信息学软件预测显示,Lin-28同源物B(LIN28B)可能是miR-212-3p的靶基因。LIN28B属于高度保守的锌指家族蛋白成员,其在肝癌、胃癌、宫颈癌等癌组织或细胞中异常表达,可作为患者预后的生物学指标〔7~9〕。
但目前,miR-212-3p/LIN28B对子宫内膜癌细胞恶性行为的影响也还未知。本研究以miR-212-3p/LIN28B轴为切入点,探讨瑞芬太尼对子宫内膜癌细胞Ishikawa增殖、迁移和侵袭的影响及可能机制。
1 材料与方法
1.1实验细胞和试剂 子宫内膜癌Ishikawa细胞株,上海素尔生物科技有限公司;胎牛血清(FBS),浙江天杭生物科技有限公司;RPMI1640培养基、北京索莱宝;四甲基偶氮唑蓝(MTT),美国Sigma公司;引物序列、miR-212-3p 模拟物(mimics)和抑制剂(anti-miR-212-3p)、模拟对照序列(miR-NC)及抑制剂阴性序列(anti-miR-NC)、LIN28B小干扰RNA(si-LIN28B)及小干扰RNA阴性序列(si-NC),广州锐博生物科技有限公司;Trizol试剂、反转录试剂盒和聚合酶链反应(PCR)试剂盒,大连宝生物;兔抗人LIN28B、细胞周期蛋白(Cyclin)D1、p21、基质金属蛋白酶(MMP)-2和MMP-9抗体均购自上海酶联生物科技有限公司;双荧光素酶报告基因试剂盒,美国Promega公司。
1.2方法
1.2.1细胞培养和转染 复苏Ishikawa细胞,用含10%FBS的RPMI1640培养基(完全培养基),置于37℃、5%CO2培养箱中培养。当细胞融合至80%~90%时,胰蛋白酶消化,制成单细胞悬液,进行传代培养。将浓度2.5×104个/ml的对数期Ishikawa细胞接种于6孔板中,每孔1.0 ml。培养24 h后,弃培养基,换为不含10%FBS的RPMI1640培养基。利用LipofectamineTM2000试剂盒,分别将miR-NC、miR-212-3p mimics、anti-miR-NC、anti-miR-212-3p、si-NC、si-LIN28B转染至Ishikawa细胞。转染6 h后,换为含完全培养基,再培养24 h,qRT-PCR检测细胞中miR-212-3p或Western印迹检测LIN28B蛋白表达验证转染效果,并收集细胞用于后续实验。
1.2.2细胞分组处理 将Ishikawa细胞分为瑞芬太尼0 ng/ml组、瑞芬太尼5 ng/ml组、瑞芬太尼50 ng/ml组和瑞芬太尼500 ng/ml组,细胞分别用含0、5、50、500 ng/ml〔10〕瑞芬太尼的培养基干预24 h。将转染miR-NC、miR-212-3p mimics、si-NC、si-LIN28B的细胞均用不含瑞芬太尼的培养基干预24 h,并分别记为miR-NC组、miR-212-3p组、si-NC组、si-LIN28B组。将转染anti-miR-NC、anti-miR-212-3p的细胞均用含500 ng/ml 瑞芬太尼的培养基干预24 h,记为瑞芬太尼500 ng/ml+anti-miR-NC组、瑞芬太尼500 ng/mL+anti-miR-212-3p组。
1.2.3MTT检测细胞增殖 将浓度2.5×104个/ml的Ishikawa细胞及转染miR-NC、miR-212-3p mimics、anti-miR-NC、anti-miR-212-3p、si-NC、si-LIN28B的细胞均接种于96孔板中,每孔200 μl,培养箱12 h后,弃培养基,按照上述1.2.2分组处理。培养结束后,加20 μl MTT(5 mg/ml),培养箱中孵育4 h。弃上清液,加150 μl二甲基亚砜,混合均匀,酶标仪于490 nm处测定吸光度(A)值。以0 ng/ml的瑞芬太尼处理组细胞的吸光值作为对照,计算抑制率。增殖抑制率(%)=(A对照组-A实验组)/A对照组×100%。
1.2.4Transwell法检测细胞的迁移和侵袭 将浓度2.5×104个/ml的Ishikawa细胞及转染miR-NC、miR-212-3p mimics、anti-miR-NC、anti-miR-212-3p、si-NC、si-LIN28B的细胞均接种于6孔板中,每孔2.5 ml,培养箱12 h后,弃培养基,按照上述1.2.2分组处理。培养结束后,弃培养基,收集各组细胞。将各组细胞用不含FBS的培养基调整浓度为1.0×105个/ml。迁移实验:取100 μl各组细胞悬液加至Transwell小室上室,500 μl含10%FBS的RPMI1640培养基加至下室。培养24 h后,吸弃培养基,用4%多聚甲醛固定15 min,0.1%结晶紫染色5 min。用PBS清洗后,显微镜观察,随机取5个视野计数。侵袭实验:预先在Transwell小室上室铺设基质胶,自然晾干后,加100 μl细胞悬液,其余操作与迁移实验相同。
1.2.5qRT-PCR检测miR-212-3p和LIN28B mRNA表达 用Trizol试剂提取各组细胞中总RNA,微量核酸仪检测RNA纯度的浓度后,将其反转录为cDNA,再行PCR反应。反应条件,95预变性5 min,95℃变性5 s,60℃退火30 s,72℃延伸30 s,共进行45个循环。采用 2-△△Ct法计算miR-212-3p相对U6、LIN28B mRNA相对GAPDH的表达量。
1.2.6Western印迹检测蛋白表达 用RIPA试剂提取细胞中总蛋白,投井下二喹啉甲酸(BCA)法测定蛋白浓度后,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。将分离后蛋白转移至聚偏氟乙烯(PVDF)膜,并用5%脱脂牛奶室温封闭1 h。4℃冰箱中分别用LIN28B、CyclinD1、p21、MMP-2、MMP-9和GAPDH一抗孵育过夜。洗膜后,加入辣根过氧化物酶(HPR)标记的二抗,室温孵育1 h。洗膜后,滴加显影液,避光显影。Bio-radChem DOC MP全能型成像分析系统拍照,并分析目的蛋白相对GAPDH的表达量。
1.2.7双荧光素酶报告基因 TargetScan生物信息学系统预测显示,LIN28B的3′UTR中含有与miR-212-3p互补的核苷酸序列,有上海生工生物工程有限公司分别构建含有结合位点的LIN28B野生型重组质粒(WT-LIN28B)和突变型重组质粒(MUT-LIN28B)。将浓度2.5×104个/ml的对数期Ishikawa细胞接种于6孔板中,每孔1.0 ml。培养24 h后,弃培养基,换为不含10% FBS的RPMI1640培养基。利用LipofectamineTM2000试剂盒,分别共转染miR-212-3p mimics与WT-LIN28B、miR-NC与WT-LIN28B、miR-212-3p mimics与MUT-LIN28B、miR-NC与MUT-LIN28B至Ishikawa细胞。转染6 h后,换为含完全培养基,再培养24 h,收集各组细胞,利用双荧光素酶报告基因试剂盒操作说明,检测荧光素酶活性。
1.3统计学分析 采用SPSS22.0软件进行t检验、单因素方差分析。
2 结 果
2.1瑞芬太尼对Ishikawa细胞增殖和迁移侵袭的影响 瑞芬太尼5 ng/ml组、瑞芬太尼50 ng/ml组和瑞芬太尼500 ng/ml组Ishikawa细胞增殖抑制率及细胞中p21蛋白表达显著高于瑞芬太尼0 ng/ml组(P<0.05),细胞迁移数、侵袭数量及细胞中CyclinD1、MMP-2和MMP-9蛋白表达低于瑞芬太尼0 ng/ml组(P<0.05),且呈剂量依赖性(均P<0.05)。见图1、图2、表1。
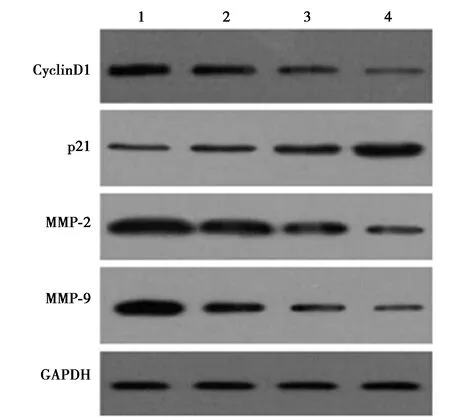
1~4:瑞芬太尼0 ng/ml组、瑞芬太尼5 ng/ml组、瑞芬太尼50 ng/ml组、瑞芬太尼500 ng/ml组,图3同图1 瑞芬太尼对Ishikawa细胞增殖、迁移和侵袭相关蛋白表达的影响
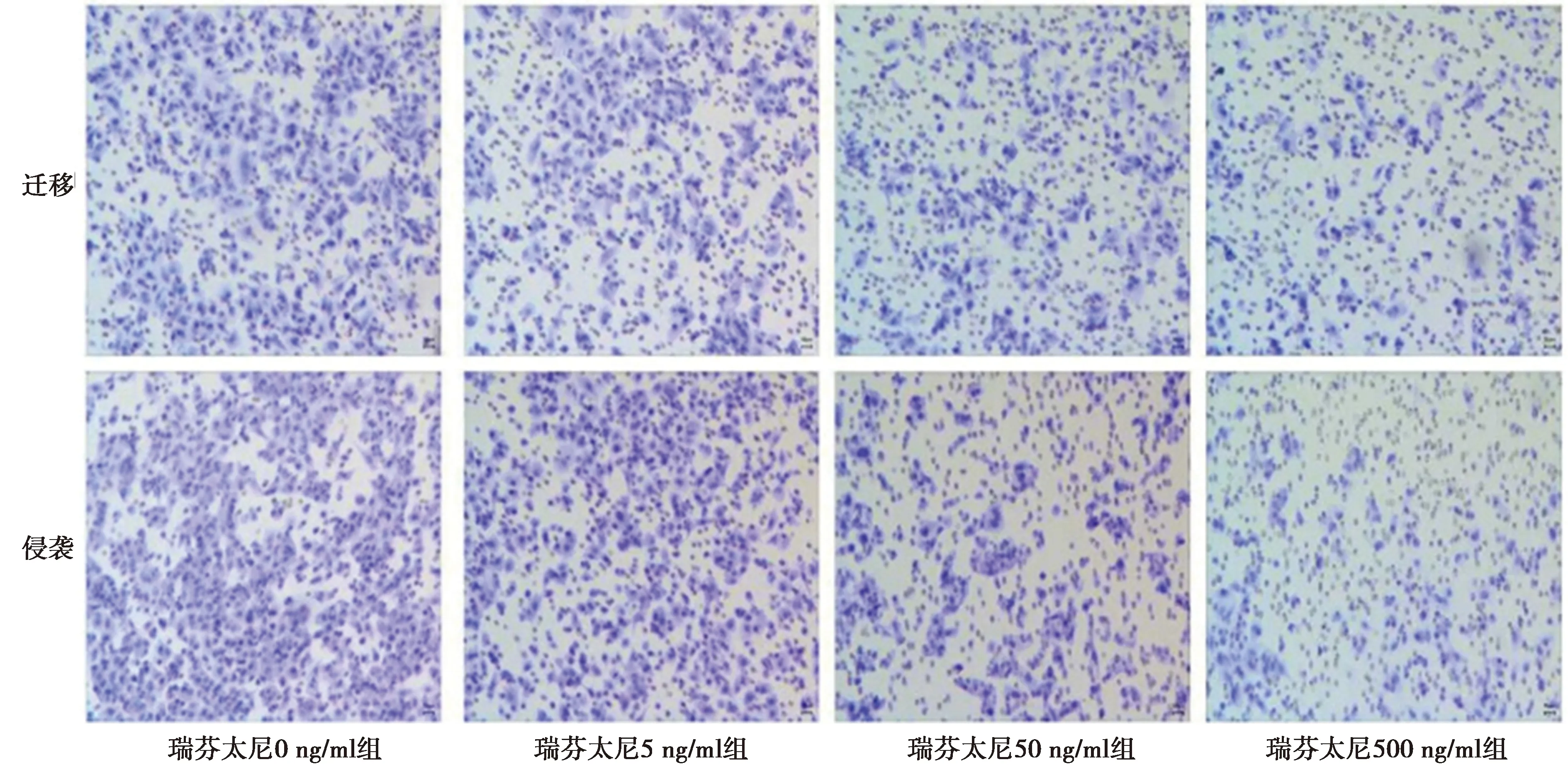
图2 瑞芬太尼对Ishikawa细胞迁移和侵袭的影响(结晶紫染色,×200)

表1 瑞芬太尼对Ishikawa细胞增殖和迁移侵袭的影响
2.2瑞芬太尼对Ishikawa细胞中miR-212-3p和LIN28B表达的影响 瑞芬太尼5 ng/ml组、瑞芬太尼50 ng/ml组和瑞芬太尼500 ng/ml组Ishikawa细胞中miR-212-3p表达高于瑞芬太尼0 ng/ml组(P<0.05),LIN28BmRNA和蛋白的表达低于瑞芬太尼0 ng/ml组(P<0.05),且呈剂量依赖性(均P<0.05)。见图3、表2。

图3 瑞芬太尼对Ishikawa细胞中LIN28B蛋白表达的影响

表2 瑞芬太尼对Ishikawa细胞中miR-212-3p和LIN28B表达的影响
2.3miR-212-3p靶向调控LIN28B的表达 TargetScan数据库预测结果显示,LIN28B的3′UTR中含有与miR-212-3p互补的核苷酸序列,见图4。共转染miR-212-3p mimics与WT-LIN28B的Ishikawa细胞荧光素酶活性显著低于共转染miR-NC与WT-LIN28B的Ishikawa细胞(P<0.05),而共转染miR-212-3p与MUT-LIN28B的Ishikawa细胞荧光素酶活性与共转染miR-NC与WT-LIN28B的Ishikawa细胞比较差异无统计学意义(P>0.05),见表3。miR-212-3p组Ishikawa细胞中miR-212-3p表达量(2.86±0.24)显著高于miR-NC组(1.01±0.08,t=21.938,P<0.05);LIN28B蛋白表达量(0.23±0.03)显著低于miR-NC组(0.65±0.06,t=18.783,P<0.05),见图5。

图4 LIN28B的3′UTR中含有与miR-212-3p互补的核苷酸序列

表3 双荧光素酶报告实验

图5 miR-212-3p调控LIN28B蛋白的表达
2.4过表达miR-212-3p对Ishikawa细胞增殖和迁移侵袭的影响 miR-212-3p组Ishikawa细胞中细胞增殖抑制率及细胞中p21蛋白表达均显著高于miR-NC组(P<0.05),细胞迁移数、侵袭数及细胞中CyclinD1、MMP-2和MMP-9的蛋白表达均显著低于miR-NC(P<0.05)。见表4、图6。

表4 过表达miR-212-3p对Ishikawa细胞增殖、迁移和侵袭的影响

图6 过表达miR-212-3p对Ishikawa细胞增殖、迁移侵袭相关蛋白表达的影响
2.5抑制LIN28B表达对Ishikawa细胞增殖和迁移侵袭的影响 si-LIN28B组Ishikawa细胞中LIN28B蛋白水平、细胞迁移数、侵袭数及细胞中CyclinD1、MMP-2和MMP-9的蛋白表达显著低于si-NC组(P<0.05),增殖抑制率及细胞中p21蛋白表达均显著高于si-NC组(P<0.05)。见图7、表5。

图7 抑制LIN28B对Ishikawa细胞增殖、迁移侵袭相关蛋白表达的影响

表5 抑制LIN28B对Ishikawa细胞增殖和迁移侵袭的影响
2.6抑制miR-212-3p逆转了瑞芬太尼(500 ng/ml)对Ishikawa细胞增殖和迁移侵袭的作用 瑞芬太尼500 ng/ml+anti-miR-212-3p组细胞中miR-212-3p表达水平、增殖抑制率及细胞中p21蛋白表达均低于瑞芬太尼500 ng/ml+anti-miR-NC组(P<0.05),细胞迁移数、侵袭数及细胞中LIN28B、CyclinD1、MMP-2和MMP-9蛋白表达均显著高于瑞芬太尼500 ng/ml+anti-miR-NC组(P<0.05)。见表6、图8。

表6 抑制miR-212-3p表达逆转了瑞芬太尼对Ishikawa细胞增殖和迁移侵袭的作用

1,2:瑞芬太尼500 ng/ml+anti-miR-NC组,瑞芬太尼500 ng/ml+anti-miR-212-3p组图8 抑制miR-212-3p表达逆转了瑞芬太尼对Ishikawa细胞增殖、迁移侵袭相关蛋白表达的作用
3 讨 论
肿瘤是一种细胞增殖紊乱疾病,抑制肿瘤细胞的异常增殖可起抗肿瘤的作用〔11〕。恶性肿瘤的发生、发展过程中,细胞周期调控的紊乱是细胞增殖失控的主要原因〔12〕。CyclinD1可通过激活细胞周期依赖性激酶调节细胞的增殖和分裂,参与肿瘤的发生〔13〕。本研究结果提示瑞芬太尼可能通过调节CyclinD1、p21阻碍子宫内膜癌细胞增殖。侵袭和转移是恶性肿瘤细胞的基本生物学特征〔14〕。MMP可降解基底膜和细胞外基质,可促进肿瘤细胞的侵袭和转移〔15〕。本研究结果提示瑞芬太尼可能通过调控MMP-2和MMP-9抑制子宫内膜癌Ishikawa细胞迁移和侵袭。miRNA在基因表达过程中发挥重要调节作用,参与细胞增殖、分化、凋亡等生命学过程。研究表明,miRNA参与肿瘤的发生发展,与患者预后密切相关〔16,17〕。miR-212-3p在胶质母细胞瘤(GBM)中低表达,miR-212-3p过表达可抑制GBM细胞的活力,其可能通过靶向调控SGK3表达抑制GBM细胞的增殖〔18〕。miR-212-3p通过调控SOX5表达可以抑制类风湿性关节炎成纤维细胞样滑膜细胞的增殖,并促进其凋亡,为类风湿关节炎的治疗提供新的生物学靶点〔19〕。本研究结果提示miR-212-3p可作为子宫内膜癌的潜在治疗靶标。通过采取有效的手段提高子宫内膜癌患者机体内miR-212-3p的表达,有助于该疾病的治疗,延长患者生存期。
研究证实miRNA可通过调控其靶基因的表达影响肿瘤细胞的发生、发展过程。如miR-125b可能通过调控LIN28B的表达,抑制肝癌细胞的增殖和侵袭能力〔20〕。本研究提示LIN28B作为促癌基因参与子宫内膜癌的发生和发展,抑制LIN28B表达有助于延缓病情。

