远端深静脉血栓形成诊疗微循环专家共识
中国微循环学会周围血管疾病专业委员会
深静脉血栓形成(deep venous thrombosis,DVT)根据血栓发生部位,分为远端深静脉血栓形成(distal deep venous thrombosis,DDVT)与近端深静脉血栓形成(proximal deep venous thrombosis,PDVT)。DDVT是指腘下(不含腘静脉)深静脉血栓,可能累及轴向小腿深静脉(胫前静脉、胫后静脉或腓静脉)和(或)小腿肌间静脉(如腓肠肌静脉或比目鱼肌静脉)。其中不伴有肺栓塞(pulmonary embolism,PE)的DDVT被称为孤立性远端深静脉血栓形成(isolated distal deep venous thrombosis,IDDVT)。DDVT是DVT中常见的类型,占DVT人群的1/3~1/2[1],其症状、PE风险和血栓后综合征(post-thrombotic syndrome,PTS)风险及总体预后不同于PDVT。急性DDVT可导致患者小腿,特别是腓肠肌部位的肿胀、疼痛;部分急性DDVT患者可能没有症状或症状轻微,这使得DDVT容易被忽视。由于DDVT症状、诊断、治疗和预后的特殊性,DDVT也通常被排除在大型多中心随机对照研究之外;也正是由于高质量临床研究数据的相对匮乏,使得DDVT的诊治尚存在争议。为指导和规范DDVT的诊断和治疗,推动DDVT多学科诊疗进步,由中国微循环学会周围血管疾病专业委员会发起,组织相关领域专家经多次讨论,并基于现有的文献资料与专家临床经验总结,制定《远端深静脉血栓形成诊疗微循环专家共识》,供临床参考使用。根据文献资料涉及的人群不同,本共识中在引用文献时,可能会分别用到DDVT或IDDVT两种名称。
1 共识形成方法
本共识由中国微循环学会周围血管疾病专业委员会发起,该委员会委员及其推荐的相关领域专家共同组成共识专家组,按照“共识形成方法”[2],达成共识意见。专家组拟定关键问题和共识提纲后,确定文献检索策略(表1)。执笔人在复习国内外相关文献的基础上,根据所收集信息,经会议讨论及反复修订,制定共识第一稿。主要围绕八个方面的内容:(1)共识形成方法;(2)DDVT概述;(3)DDVT辅助检查;(4)DDVT验前概率评分与诊断;(5)DDVT的抗凝治疗;(6)DDVT的其他治疗 ;(7)DDVT患者的随访;(8)专科患者合并DDVT的管理。共识第一稿以邮件方式向共识专家组成员发送,由所有专家对第一稿进行函审并提出书面意见,共收集函审意见324条。由主要执笔人根据第一稿函审意见,在会议上进行逐条讨论确认并修订共识,形成第二稿。以邮件方式向共识专家组成员发送共识第二稿,征求反馈意见,最终经过再次会议讨论定稿,形成共识终稿。
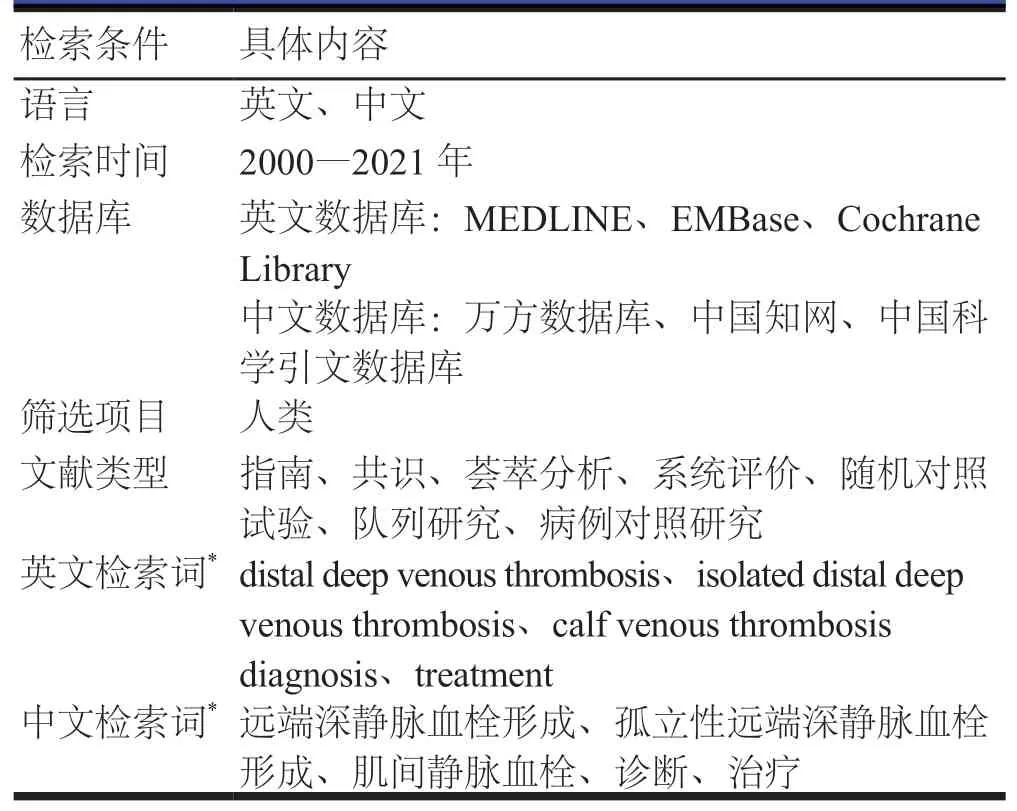
表1 文献检索策略
2 DDVT概述
2.1 DDVT的类型
DDVT按照解剖部位主要分为累及小腿轴向深静脉的DDVT和单纯累及肌间静脉的DDVT;按照是否合并PE,又分为IDDVT和合并PE的非孤立性DDVT;根据有无症状,DDVT又分为症状性DDVT和无症状性DDVT;根据发病时间可以分为急性、亚急性和慢性DDVT。
2.2 DDVT发病率和发病危险因素
DDVT确切的发病率尚无大型的流行病学资料,由于DDVT患者可无症状,因此实际发生率可能高于临床诊断率。门诊人群中,DDVT甚至可能占DVT人群的60%~70%[3]。Qiu等[4]数据显示,院内获得性DVT人群中,IDDVT的发病率是PDVT的5.02倍(1.24/1000vs0.26/1000,P<0.01)。
DDVT的发病危险因素可能与PDVT有所不同。OPTIMEV研究中,IDDVT更常与一过性的危险因素相关,例如近期手术、住院、外伤、旅行等;而PDVT更常与慢性疾病或身体状况相关,如活动性恶性肿瘤、充血性心力衰竭、呼吸衰竭、年龄>75岁等[5]。2019年全球观察性队列研究GARFIELD-VTE注册研究分析显示,与PDVT患者相比,IDDVT更可能与近期手术和腿部创伤相关,而PDVT更可能与活动性恶性肿瘤相关[6]。临床实际情况中,这种发病危险因素的区别,通常也不是绝对的,还存在一定争论,例如反复发生的DDVT或双侧DDVT,就可能与活动性恶性肿瘤、易栓症等慢性疾病或身体状况相关。
专家共识1:DDVT无论是在门诊还是在院内获得性DVT人群中,均占有较大比例。
专家共识2:DDVT发病的危险因素更可能与一过性危险因素相关。
2.3 DDVT血栓蔓延发生率和危险因素
DDVT可能向近心端(如腘静脉、股静脉等)或者向小腿其他静脉蔓延。Fujioka等[7]发现,DDVT患者虽未行抗凝治疗,但在2周后自然转归,21%患者血栓消失,20%患者血栓负荷量减少,6.3%患者血栓延伸至近端静脉;活动期恶性肿瘤、长期卧床和D-二聚体(D-Dimer,D-D)水平>8 μg/ml是保守治疗期间DDVT蔓延至近端静脉的危险因素。门诊未接受抗凝治疗的DDVT患者,采用“序贯近端加压超声”策略,第7天复查近端静脉加压超声结果显示,1.0%~5.7%患者血栓蔓延至腘静脉或腘静脉以上[8],这反映了“低危”DDVT患者的自然病程。在另一项系统性荟萃分析显示,即使经过抗凝治疗,DDVT向近心端蔓延到腘静脉的发生率在不同研究中数值异质性较大,为0%~35%,平均为8.9%[9]。不同研究数据的高异质性可能与研究人群选择、研究设计、抗凝方案、诊疗决策等相关[8]。
美国胸科医师学会(American College of Chest Physicians,ACCP)第10版指南(简称ACCP10)指出DDVT蔓延的危险因素包括[10](1)D-D阳性;(2)广泛血栓形成(长度>5 cm,累及多条静脉;血栓最大直径>7 mm)或靠近近端静脉;(3)DVT诱发因素不可逆;(4)合并活动性恶性肿瘤;(5)既往有静脉血栓栓塞症(venous thromboembolism,VTE)病史;(6)住院状态。
专家共识3:急性DDVT可能蔓延为PDVT;D-D水平明显升高、诱发因素不可逆、血栓范围广、恶性肿瘤、既往VTE病史是DDVT蔓延的危险因素。
2.4 DDVT并发PE发病率
Command VTE注册研究中,对急性PE患者进行下肢静脉超声检查发现,PDVT和DDVT分别占64.7%和24.7%,其余10.6%患者未发现DVT[11]。一篇文献荟萃分析了8项随机临床研究和13项前瞻性队列研究,结果显示,DDVT患者中PE发生率为0%~6.2%,无致命性PE发生[12]。Brateanu等[13]研究显示,门诊DDVT患者发生PE的风险较低,而年龄≥60岁的住院DDVT患者,血栓向近心端蔓延和(或)PE风险则明显升高,提示年龄≥60岁和住院是DDVT患者发生PE的危险因素。院内获得性DVT人群中,PDVT和DDVT的PE发生率无显著差异(7.89%vs6.23%,P=0.275)[4]。6%的肌间静脉血栓患者发生PE,其中直径≥6.05 mm的血栓比直径<6.05 mm的血栓更容易发生PE(10.3%vs4.2%,P<0.0001)[4]。
专家共识4:DDVT可以并发PE。
2.5 DDVT血栓复发率
DDVT患者VTE复发率与危险因素、治疗方案等相关,分为近期复发和远期复发。近期复发主要是指DDVT发病3个月以内的复发。前瞻性RIETE注册研究数据分析显示,1921例IDDVT患者与9165例PDVT患者在抗凝比例分别为89.1%和91.8%的情况下接受抗凝治疗,随访3个月,两组患者VTE复发率相似,但PDVT患者略高,但未达到统计学显著性差异(2.7%vs2.0%,P=0.07)[14]。Command VTE注册研究中,DDVT患者3个月内VTE总体复发率为3.2%,与PDVT的9%无显著差异(P=0.79)[11]。OPTIMEV研究中,DDVT患者与PDVT患者相比,3个月内VTE复发率相似,分别为2.2%和2.5%[5]。一项荟萃分析显示,DDVT患者随访3个月,抗凝组VTE总体复发率显著低于非抗凝组,分别为3.1%和9.1%(P<0.05);抗凝组DVT复发率亦显著低于非抗凝组,为2.0%vs7.9%(P<0.05)[15]。近期复发的危险因素主要包括住院、高龄和活动性恶性肿瘤等[16]。
远期复发主要是指停用抗凝剂后较长时间内VTE复 发。GARFIELD-VTE注 册 研 究 中,2145例IDDVT患者均接受了抗凝治疗,随访12个月时,IDDVT患者VTE复 发 率 显 著 低 于PDVT患 者(HR=0.76,95%CI:0.60~0.97)[6]。OPTIMEV研究数据显示,停用抗凝剂后,随访3年,IDDVT总体VTE年复发率明显低于PDVT患者(2.7%vs5.2%,P=0.02),但PE复发率相似(1.0%vs0.9%,P=0.83)[17]。患者年龄>50岁、特发性IDDVT、双侧肢体IDDVT和单侧肢体多条远端静脉受累等因素将使IDDVT停用抗凝剂后总体VTE远期复发风险升高3~4倍[17]。另外,男性和活动性恶性肿瘤可以使IDDVT 2年内VTE复发率分别升高3.7和4.5倍[18],IDDVT的解剖学位置(轴向静脉或肌间静脉)与远期复发率无关[18]。CACTUS-PTS研究显示,长期随访期间,6周抗凝组和安慰剂组VTE总复发率分别为8%和14%,两组无显著差异(P=0.2)[19]。合并恶性肿瘤是DDVT复发的高危因素。在一项多中心队列研究中,对308例合并恶性肿瘤的症状性DDVT患者平均随访13.9个月,即使在抗凝治疗的基础上,VTE年复发率为13.2%,严重出血的发生率为2.0%[20]。
专家共识5:DDVT具有一定的VTE近期复发和远期复发率;DDVT的近期复发率与PDVT相当,而远期复发率低于PDVT。
专家共识6:DDVT近期复发VTE的危险因素主要包括住院、高龄、未抗凝治疗和活动性恶性肿瘤等。
专家共识7:DDVT远期复发VTE可能与年龄>50岁、特发性DDVT、双侧肢体静脉受累、单侧肢体多条远端静脉受累、男性及活动性恶性肿瘤等因素相关。
2.6 DDVT并发PTS发生率
关于PTS的定义,不同研究有所不同。CACTUS-PTS研究是一项针对症状性IDDVT患者的前瞻性研究,中位随访期6年,178例接受Villalta评分评估的IDDVT患者中,30%发生了PTS,低于PDVT的PTS发生率(40%),其中,中重度PTS占所有PTS患者的24%[19]。6周那屈肝素抗凝治疗与安慰剂比较,PTS患病率差异无统计学意义(29%vs32%,P=0.6);然而在不合并原发性慢性静脉功能不全的患者中,抗凝组PTS发生率显著低于安慰剂组(9%vs24%,P=0.04)。
专家共识8:DDVT的PTS发生率低于PDVT;在不合并原发性慢性静脉功能不全的DDVT患者中,抗凝治疗可降低症状性DDVT患者的PTS发生率。
2.7 DDVT人群抗凝治疗出血的发生率及出血危险因素评估
前瞻性RIETE注册研究数据分析显示,1921例IDDVT患者与9165例PDVT患者相比,在抗凝比例基本一致的情况下(分别为89.1%和91.8%接受了抗凝治疗),随访3个月,IDDVT组较PDVT组严重出血率低(1.0%vs2.2%,P<0.01)[14]。全球多中心观察性队列研究的GARFIELD-VTE注册研究分析了2145例IDDVT患者治疗模式和结果;患者都接受了抗凝治疗,随访12个月时出血事件发生率7.3%,其中大出血发生率为1.2%[6]。Command VTE注册研究中,DDVT患者严重出血发生率与PDVT组无显著差异(4.4%vs4.9%,P=0.46)[11]。
一项荟萃分析显示,DDVT人群中,抗凝治疗与不进行抗凝治疗相比,临床相关的非大出血事件的发生率分别是61/1000人和18/1000人(RR=3.34,95%CI:1.07~10.46);大出血事件的发生率是6/1000人和8/1000人(RR=0.76,95%CI:0.13~4.62),两者之间差异无统计学意义[15]。
通常借用HAS-BLED评分(表2)评估抗凝治疗的出血风险,当HAS-BLED积分≥3分提示出血高风险,但这并不是抗凝治疗的禁忌,应注意纠正可能导致出血风险增加的可逆因素,并且在抗凝治疗的同时密切监测,加强随访。
专家共识9:DDVT抗凝相关严重出血风险较低,但仍需进行出血风险评估。
2.8 DDVT人群死亡风险
RIETE注册研究显示,随访3个月,IDDVT患者病 死 率 较PDVT低(2.7%vs7.5%,P<0.001),这主要是由于非VTE相关病死率较低(2.2%vs6.3%,P<0.001);活动性恶性肿瘤是IDDVT患者死亡的主要预测因素[14]。OPTIMEV注册研究中,787例DDVT患者和598例PDVT患者完成3个月随访,DDVT组病死率低于PDVT组(4.4%vs8.0%,P<0.01),亚组分析显示非住院患者中两组之间病死率无差异(2.9%vs4.0%,P>0.05),住院患者中DDVT组病死率低于PDVT组(8.7%vs20.7%,P<0.05),DDVT组死亡主要原因为非DVT相关原因[5]。Command VTE注册研究中,DDVT患者的累积90天全因死亡率低于PDVT患者(2.5%vs7.9%,P=0.01),DDVT 90天内最常见的死亡原因是恶性肿瘤[11]。Elmi等[21]研究认为,年龄≥80岁、合并恶性肿瘤和颅内出血增加IDDVT患者死亡风险(OR值分别为2.95、8.47和2.33,P<0.05)。
专家共识10:DDVT 3个月内的总体死亡风险低于PDVT,DDVT患者死亡多由非DVT相关原因导致。
3 DDVT辅助检查
3.1 超声检查
全腿静脉超声(whole-leg venous US,WLUS)是诊断DDVT常用的方法,联合加压超声、彩色血流和频谱技术的超声检查,能有效提高DDVT诊断的灵敏度和准确度[22]。但是,与单纯近端静脉超声(proximal venous US,PUS)相比,WLUS耗时更长,消耗更多医疗资源,更具技术挑战性,这也是部分医疗机构无法进行WLUS的原因。WLUS可以用于DDVT诊断、序贯复查和随访。序贯超声检查策略是指在初次超声检查后第7天复查超声。应当注意的是,WLUS诊断DDVT有较高的假阳性率[23],尤其是对于无症状的患者,假阳性率更高,甚至可能达50%[24]。局限于远端静脉的假阳性结果可能包括肌间血肿、陈旧性DDVT、静脉内瘀滞状态或血栓前表现等。对于临床表现不符合DDVT的患者,可以考虑采用7 d后序贯复查WLUS的策略,以提高DDVT的诊断准确度。未进行抗凝治疗或者不适合进行抗凝治疗的DDVT患者,也可以考虑7 d后序贯复查WLUS或PUS,确定下一步治疗计划。
无法进行WLUS检查的机构,可以仅进行PUS检查。PUS不能排除DDVT,但是可以明确有无血栓向近心端的蔓延。临床验前概率(clinical pretest probability,CPTP)低、D-D阴性且PUS阴性的患者,DVT或DDVT可能性较小,即使是DDVT也可能是复发和蔓延风险较低的“低危”DDVT。如果PUS阴性,但D-D阳性或CPTP中高危,可进行WLUS检查或7 d后序贯复查PUS[25]。如果序贯复查PUS出现近端血栓,则参照DVT诊治原则进行抗凝治疗;相反,一周后近端超声仍为阴性的患者可不进行抗凝治疗。
专家共识11:WLUS是常用的辅助检查措施,可用于DDVT的诊断、复查和随访;PUS可用于明确DDVT是否向近心端蔓延。
3.2 计算机断层扫描静脉造影、核磁静脉显像和静脉造影
计算机断层扫描静脉造影、核磁静脉显像和静脉造影,由于其在远端静脉成像的局限性,不常用于DDVT的诊断。
3.3 D-D
D-D是纤维蛋白降解产物,在急性DVT患者中D-D水平通常升高,另外也在恶性肿瘤、手术、败血症、创伤、妊娠、肾功能衰竭和老年等情况下表达水平升高。由于较高的阴性预测值,D-D表达正常通常用于排除急性DVT。而多数D-D表达水平高低与DVT相关性的研究,主要是在PDVT患者群体中进行,也有部分研究方案中并没有检查小腿静脉[26],这使得D-D表达水平对于DDVT诊断的意义存在不确定性。
Jennersjö等[26]研究认为,门诊症状性DVT患者中,D-D水平正常并不能排除DDVT。在这项前瞻性研究中,对393例临床疑诊为症状性DVT的门诊患者进行了WLUS和D-D水平检查,结果显示137例明确诊断为DVT的患者中,59%为症状性DDVT;81例DDVT患者中有28例(34.6%)D-D水平正常,而56例PDVT患者中仅有2例(3.6%)D-D水平正常。D-D水平诊断PDVT的灵敏度为96%,阴性预测值为99%;而D-D水平诊断DDVT的灵敏度仅为65%,阴性预测值为84%。D-D水平诊断DDVT的特异度与CPTP相关,Wells评分加D-D水平检测有助于提高诊断DDVT的特异度。
专家共识12:D-D水平检测可用于辅助DDVT的诊断,但是需要结合CPTP。
4 DDVT验前概率评分与诊断
4.1 DDVT验前概率评分
结合患者的症状、体征和可能的危险因素,评估患者患DVT的可能性。DVT验前概率评分的Wells-DVT评分量表(表3)是最常用的DVT临床可能性评分量表,同样可以应用于PDVT或DDVT人群。验前概率评分≤0分,提示DVT患病临床可能性低;验前概率评分为1~2分,提示DVT患病临床可能性为中等;验前概率评分≥3分,提示可能罹患DVT可能性高。但需注意的是,有研究认为,Wells-DVT评分在PDVT中准确度更高;而在DDVT患者中,Wells-DVT评分容易被低估,即高危风险人群容易被评估为中低风险人群[27]。

表3 Wells-DVT评分—深静脉血栓的验前概率评分
专家共识13:Wells-DVT评分同样适用于疑诊DDVT人群的临床可能性评估,但可能出现低估的可能。
4.2 DDVT的诊断
DDVT的诊断需联合患者的Wells-DVT评分、临床表现、D-D水平检测和辅助检查结果,进行综合评估和诊断。鉴于DDVT较PDVT存在特殊性,诊断DDVT时需要注意:
(1)对于有症状和(或)Wells-DVT评分为中高危的患者,D-D阴性不能排除急性DDVT;
(2)对于有症状和(或)Wells-DVT评分为中高危的患者,如果WLUS阴性,应在第7天复查WLUS;
(3)对于无症状、D-D阴性且Wells-DVT评分为中低危的DDVT患者,急性DDVT的可能性较小;
专家共识14:DDVT的诊断需联合患者的Wells-DVT评分、临床表现、D-D水平检测和WLUS结果进行综合的评估和诊断。
5 DDVT的抗凝治疗
5.1 抗凝指征
DDVT是否需要抗凝治疗及抗凝治疗的时长,还存在一定争议。支持抗凝治疗的理由:(1)DDVT存在血栓向近心端蔓延形成PDVT、发生PE及近期复发等可能,抗凝治疗能降低上述并发症发生率;(2)真实世界中,DDVT抗凝治疗相关的大出血风险并不高。不支持抗凝治疗的理由:在血栓风险较低的患者、门诊患者或偶然发现DDVT的患者中,DDVT出现蔓延、复发和PE的风险微乎其微,在监测措施到位的情况下,可以不进行抗凝治疗。
本共识认为,应对DDVT患者进行分层,根据其血栓的风险和出血风险决定是否需要抗凝治疗。2021年,美国胸科医师学会(American College of Chest Physicians,ACCP)指南[28]更新显示,伴有以下一种或多种危险因素的IDDVT患者应接受抗凝治疗:(1)D-D水平明显升高(尤其是在没有其他原因的情况下明显升高时);(2)血栓广泛(例如长度>5 cm,累及多条静脉,最大直径>7 mm);(3)血栓靠近近端腘静脉;(4)DDVT的诱发因素不可逆;(5)活动性恶性肿瘤;(6)VTE病史;(7)住院患者;(8)急性症状性DDVT患者;(9)不愿意多次进行影像复查的患者。相反,如果血栓仅累及肌间静脉(如比目鱼肌、腓肠肌肌间静脉),或者患者具有中高出血风险或不愿意接受抗凝治疗,则倾向于不进行抗凝治疗,并在接下来的两周中序贯复查彩色多普勒超声再决定是否需要启动抗凝治疗[28]。Brateanu等[13]对于DDVT患者进行分析显示,住院和患者年龄>60岁是导致DDVT血栓蔓延或发生PE的危险因素;因此,这部分人群需要接受抗凝治疗。合并IDDVT的住院患者,标准抗凝治疗能显著减少IDDVT的血栓蔓延(OR=0.07,P=0.007),降低全因死亡率(OR=0.37,P=0.02),而不显著增加大出血风险[21]。创伤患者由于活动受限,发生VTE的风险更高。Olson等[29]研究发现,12.9%的创伤合并DDVT的患者进展为PDVT或PE;与PDVT相比,DDVT与较高的PE发生率相关。本共识认为,创伤合并DDVT应积极考虑抗凝治疗。膝下静脉受累的数量也与患者的预后相关[30]。Asonitis等[30]分析,即使经过抗凝治疗,DDVT持续存在、蔓延和复发均与最初受累静脉的数量之间存在相关性。本共识认为,当一条静脉受到影响时,6周抗凝治疗似乎是有效的;而对于多支静脉受累PDVT,需要6周以上的抗凝治疗。
DDVT的治疗临床实践可能与指南存在一定程度的偏移。尽管2021年ACCP指南[28]更新建议对于低风险的IDDVT患者可以采取非抗凝的治疗措施,但全球队列研究的GARFIELD-VTE注册研究中,97%IDDVT患者都接受了抗凝治疗,而且相当一部分患者接受了6个月甚至12个月的抗凝治疗[31]。真实世界中,DDVT抗凝治疗的比例高于指南规定的范围,表明在实际临床实践中,进行抗凝治疗的策略相较于对患者进行更详细的危险分层的策略应用起来可能更为简便。
对于低风险的DDVT患者,如果不给予抗凝治疗,其安全性、发生近端蔓延和VTE复发的风险尚有待研究确定。CACTUS研究中纳入23个医疗中心259例首次出现急性症状性DDVT的门诊低风险患者(低风险的定义是无活动性恶性肿瘤、无既往VTE病史),发现与安慰剂相比,接受抗凝治疗并未降低DDVT蔓延和VTE复发风险,但出血风险增加[32]。需要注意的是,该研究没有达到目标样本量,导致统计效力受到影响。从公共卫生的角度来看,避免对DDVT进行系统性抗凝治疗可能会对患者个体产生重大影响。
专家共识15:DDVT抗凝治疗决策取决于对症状、血栓危险因素和出血风险的综合评估。
专家共识16:伴有以下一种或多种危险因素的DDVT患者应接受抗凝治疗:(1)D-D水平明显升高;(2)血栓广泛;(3)血栓靠近近端腘静脉;(4)诱发因素不可逆(如制动、合并其他无法去除的高凝因素等);(5)活动性恶性肿瘤;(6)VTE病史;(7)住院;(8)急性症状性DDVT患者;(9)不愿意多次进行影像复查的患者。专家共识17:对于门诊偶然发现的D-D阴性且无症状性DDVT患者,同时患者无VTE危险因素;高出血风险患者,可考虑暂时不抗凝治疗,而采取2周内序贯复查WLUS策略,并再次进行临床风险-收益评估决定是否需要启动抗凝。
5.2 抗凝药物的选择
来自国际多中心静脉血栓RIETE注册研究的数据分析显示,DDVT患者接受直接口服抗凝药(direct oral anticoagulant,DOACs)治疗,其病死率、VTE复发率和严重出血的发生率与低分子肝素(low molecular weight heparin,LMWH)桥接维生素K拮抗剂(vitamin K antagonist,VKA)相当(分别为1.4%vs1.6%、0%vs3.1%和0.7%vs1.8%)[33]。考虑到DOACs应用的方便性,DOACs可以作为DDVT患者长期抗凝治疗的首选。对于特殊人群合并DDVT的抗凝治疗,可以参照相关指南[10,34-35]、共识[36]及本文第8节。
专家共识18:DDVT长期抗凝治疗应用DOACs(利伐沙班、阿哌沙班、艾多沙班、达比加群酯等)疗效与LMWH桥接VKA相当。考虑到用药的方便性,DOACs可以作为DDVT患者长期抗凝治疗的首选。
5.3 DDVT抗凝疗程
DDVT抗凝疗程的选择尚存在争论。早期一项开放标签的随机研究中,IDDVT口服抗凝治疗6周与12周方案相比,短期方案大出血风险更低(1.0%vs3.4%,RR=0.29,95%CI:0.03~2.72),且不增加复发风险(2.0%vs3.4%,RR=0.58,95%CI:0.10~3.36)[37]。两项大型荟萃研究似乎并不支持该结论。Franco等[38]研究认为,对于IDDVT患者,6周以上的抗凝治疗比6周抗凝治疗,VTE复发率降低(OR=0.39,95%CI:0.17~0.90)。另一项荟萃分析比较了抗凝≥3个月和抗凝6周的临床结局,结果显示,随访4~24个月,抗凝≥3个月的VTE复发率显著低于抗凝6周(RR=0.42,95%CI:0.26~0.68);随 访4~15个 月,抗凝≥3个月的DVT复发率显著低于抗凝6周(RR=0.32,95%CI:0.16~0.64);临床相关的非大出血事件发生率、大出血事件发生率和PE发生率比较,差异无统计学意义[15]。GARFIELD-VTE注册研究发现真实世界中,多数IDDVT患者都接受了抗凝治疗,且抗凝时间长于指南规定范围,在6个月和12个月时,分别有61.4%和45.8%的IDDVT患者仍接受抗凝治疗;随访12个月时,IDDVT患者的全因死亡率、恶性肿瘤发生率和VTE复发率显著低于PDVT患者[6,39-40]。
专家共识19:DDVT患者一旦启动抗凝治疗,3个月抗凝疗程优于6周抗凝疗程。抗凝治疗过程中和抗凝3个月后,应重新进行抗凝风险-收益评估,确定是否需要继续抗凝。
6 DDVT的其他治疗
6.1 序贯超声监测策略
标准的“序贯近端加压超声”是指在初次超声后第7天复查近端加压超声[8]。Kuczmik等[41]比较采用抗凝治疗和仅采用序贯超声监测策略的DDVT患者预后情况。抗凝治疗患者的VTE复发率和蔓延率均显著低于仅采用序贯超声监测策略的患者(7.3%vs14.3%,P=0.04;2.8%vs8.3%,P=0.01)。两者出血率或病死率没有差异;抗凝治疗患者临床事件总发生率(VTE复发+严重出血)低于仅采用序贯超声监测策略的患者(9.8%vs20.2%,P<0.01)。但是这项研究的局限性在于,这是一项回顾性研究,存在一定的选择偏倚,因为高出血风险的人群已经在实际临床工作中被排除到了抗凝组外。
专家共识20:对于因高出血风险未进行抗凝治疗的患者,可以采用序贯超声监测策略。
6.2 压力治疗
压力治疗可以减轻DVT急性期的疼痛和水肿,改善慢性期PTS的严重程度。尽管目前尚没有专门针对DDVT患者进行压力治疗的临床研究,但临床实践中,对于DDVT急性期症状较重的患者,或合并静脉功能不全的慢性DDVT患者,仍可以使用医用弹力袜减轻下肢疼痛、肿胀、瘙痒、溃疡等症状。
专家共识21:压力治疗有助于减轻DDVT患者急慢性期症状。
6.3 下腔静脉滤器
尽管急性DDVT可能并发PE,但DDVT血栓负荷较小,致死性PE风险较小。2018年《中国血栓性疾病防治指南》[35]指出急性下肢DVT在充分抗凝治疗前提下,不推荐常规放置下腔静脉滤器。2017年中华医学会外科学分会血管外科学组《深静脉血栓形成的诊断和治疗指南》[34]也指出,对于单纯抗凝治疗的DVT患者,不推荐常规应用下腔静脉滤器;而对于抗凝治疗有禁忌证、发生抗凝治疗并发症,或在充分抗凝治疗的情况下仍发生PE,建议置入下腔静脉滤器;如放置滤器,可回收滤器优于永久滤器。《深静脉血栓形成的诊断和治疗指南》[34]和第2版《下腔静脉滤器置入术和取出术规范的专家共识》[42]也指出,对于具有急性VTE高危因素的患者,在行腹部、盆腔或下肢手术时可以考虑置入下腔静脉滤器;对于合并严重创伤(闭合性颅脑损伤、脊髓损伤、下肢多发性长骨骨折或骨盆骨折等)的患者可以放置下腔静脉滤器。对于有抗凝禁忌证的患者,应密切监测DDVT变化情况,如DDVT向近心端蔓延为PDVT,可考虑放置下腔静脉滤器。
专家共识22:不推荐单纯DDVT患者常规放置下腔静脉滤器,特殊情况应参照滤器相关指南和共识。
6.4 血栓清除治疗
尽管血栓清除措施对急性髂股静脉血栓患者有较重要的意义[43],但是DDVT患者血栓负荷相对较小,目前尚无确切证据证实取栓、导管溶栓、血栓抽吸等血栓清除措施有助于改善DDVT患者症状和预后。
专家共识23:不推荐DDVT患者常规进行取栓、导管溶栓、血栓抽吸等治疗。
6.5 静脉活性药物的应用
静脉活性药物可以促进静脉回流,缓解患者急性期疼痛、肿胀等症状,以及改善慢性期胀痛不适等表现,减轻PTS相关症状。但静脉活性药物不可以替代抗凝药物用于急性期DDVT患者的抗凝治疗。
专家共识24:症状性DDVT患者可以应用静脉活性药物缓解静脉高压相关症状,但静脉活性药物不应替代抗凝治疗。
7 DDVT患者的随访
停止抗凝以后,D-D水平持续高于正常值的患者复发DVT的风险升高,该规律在DDVT患者中同样得到验证[44]。在IDDVT患者中,停止抗凝治疗后D-D水平升高与复发风险显著相关(HR=10.48,95%CI:2.21~49.77,P=0.003);在有诱因的DDVT亚组中,停止抗凝治疗后D-D水平升高导致VTE复发风险升高到3.32倍(HR=3.32,P=0.40);而在无诱因的DDVT亚组中,停止抗凝治疗后D-D水平升高导致VTE复发风险甚至升高至13.46倍(HR=13.46,95%CI:1.63~110.89,P=0.016)[44]。停止抗凝后,复查D-D组患者VTE复发率较未复查D-D组患者更低,但没有统计学意义(HR=0.75,95%CI:0.45~1.25,P=0.27)[44]。
专家共识25:DDVT患者停止抗凝治疗后,应复查D-D水平。对于D-D水平持续升高的患者,寻找可能病因,重新进行抗凝治疗风险-收益评估,确定是否恢复抗凝治疗。
8 专科患者合并DDVT的管理
8.1 肿瘤患者合并DDVT的管理
目前,聚焦于肿瘤相关DDVT研究数量远低于PDVT,但有限数据提示,与无肿瘤IDDVT患者相比,合并肿瘤的IDDVT患者存在较高的血栓复发风险和死亡风险,其预后与PDVT患者相似,而肿瘤相关DDVT患者接受6个月抗凝疗程的出血风险与PDVT相似[20,45-47]。因而对无抗凝禁忌证的肿瘤相关性DDVT患者应考虑抗凝治疗[46,48],存在抗凝禁忌证的肿瘤相关性DDVT需密切随访血栓进展情况,抗凝禁忌证消失后视血栓进展情况决定是否启动抗凝治疗。如未抗凝的肿瘤相关性DDVT血栓蔓延,建议启动抗凝治疗。
初始抗凝阶段(前5~10 d)磺达肝癸钠、LMWH可能优于普通肝素(unfractioned heparin,UFH),长期抗凝阶段磺达肝癸钠、LMWH可能优于UFH和华法林[49-50]。对于非胃肠道肿瘤或非尿路上皮癌的DDVT肿瘤患者,可选择利伐沙班或艾多沙班替代LMWH用于DDVT初始和长期治疗[51-52]。对于非急性白血病、非原发性或转移性脑肿瘤患者,可选择阿哌沙班替代LMWH用于DDVT初始和长期治疗[40,48,53]。如选择口服抗凝药物治疗,则DOACs可能优于华法林[54]。
抗癌药物与DOACs或华法林存在相互作用时,建议选择胃肠外抗凝如LMWH或磺达肝癸钠至抗癌治疗终止[55]。对于化疗后血小板数量减低患者,建议将华法林或DOACs临时转换为依诺肝素,并根据血小板数量调整依诺肝素剂量至血小板数量恢复正常[48,56-57]。频繁恶心、呕吐的患者,建议将华法林或DOACs临时转换为LMWH或磺达肝癸钠至恶心、呕吐症状缓解。接受上消化道肿瘤切除后的患者,LMWH、磺达肝癸钠比DOACs或华法林更适用于DDVT的初始和长期治疗[48,58-59]。
推荐使用正常剂量而非降低剂量的抗凝药物治疗肿瘤相关性DDVT,除非患者存在高出血风险[10,20,45]。肿瘤根治性手术后发生的DDVT抗凝时间与非肿瘤术后DDVT相同。活动性肿瘤相关性DDVT抗凝疗程至少3个月,接受3个月以上抗凝疗程复发风险可能低于6周或更短时间抗凝[20,60-61]。肿瘤姑息手术的患者及内科肿瘤患者,因血栓风险持续存在,如出血风险低,可以考虑延长抗凝时间至3~6个月及以上,延长期抗凝可选择DOACs,或考虑减量的利伐沙班10 mg,1次/日或阿哌沙班2.5 mg,2 次/日[28]。
专家共识26:除非存在抗凝禁忌或高出血风险,建议对肿瘤患者DDVT进行抗凝治疗,抗凝药物应根据肿瘤类型、出血风险、临床状况采取个体化选择,通常抗凝疗程至少3个月。
8.2 DDVT合并PE的管理
DDVT可能并发PE,尽管DDVT的血栓直径小,但对于存在严重心肺疾病、心肺储备功能很差的患者,即便是小血栓脱落也可导致PE,同时也可能会引发严重的血流动力学障碍,甚至猝死[62-63]。因此,对于DDVT合并PE患者应根据年龄、存在的合并症及基础心肺功能状态等给予个体化的处理。
DDVT合并高危PE患者短期病死率高,溶栓是首选治疗方法。对于有溶栓禁忌证患者,有条件的医院可选择外科肺动脉血栓清除术或经皮导管介入治疗[10,64-65]。DDVT合并中危PE的患者应在严密监测下给予积极的抗凝治疗,而不推荐常规足剂量全身溶栓。如果患者出现病情恶化,甚至血流动力学不稳定,则考虑补救性溶栓或介入式血栓清除[10,64-65]。DDVT合并低危PE建议口服抗凝治疗,若适合服用DOACs(如利伐沙班、阿哌沙班、达比加群酯、艾多沙班等),推荐使用DOACs抗凝至少3个月[10,64-65]。
目前,对于DDVT合并亚段PE患者是否应抗凝尚存在争议[66]。亚段PE若存在相关临床症状,建议口服抗凝至少3个月。对无症状的亚段PE,若VTE复发风险低,同时具有良好的心肺储备或出血风险高,建议临床观察DDVT的进展情况;若VTE复发风险高,出血风险低,建议抗凝治疗,抗凝治疗推荐与急性PE相同的方案。
专家共识27:DDVT合并PE,高危患者建议溶栓治疗;中危患者建议在严密监测下给予积极抗凝治疗,病情恶化者应考虑补救性溶栓。低危患者建议口服抗凝药物至少3个月,若适合服用DOACs则优先使用。DDVT合并亚段PE,若存在相关临床症状,建议至少口服抗凝药物3个月。若VTE复发风险低,有良好的心肺储备或出血风险高,建议临床观察DDVT的进展情况;若VTE复发风险高,出血风险低,建议抗凝治疗,抗凝推荐应用与急性PE相同的方案。
8.3 妇科患者合并DDVT的管理
应用避孕药或激素替代治疗的女性是VTE高危人群。一项国际前瞻性试验中,25 000例急性VTE患者,在按年龄组分层分析中,40~69岁女性IDDVT发生率高,尤其是40~49岁的女性;而男性更常出现PDVT事件;其近中期手术、口服避孕药、静脉曲张是女性发生IDDVT的危险因素[67]。目前口服避孕药所致的VTE风险已成为共识,而DDVT是口服避孕药相关VTE最常见的临床表现。在OPTIMEV多中心队列研究中,50岁及以下无恶性肿瘤和VTE病史的非妊娠或产后女性口服避孕药相关DDVT占所有DDVT的43.9%,占口服避孕药相关VTE的51.9%[41]。
性别特异性不仅影响VTE的个体风险及风险分层模型的准确性,甚至会影响患者的预后。在CACTUS-PTS研究中,对首次有症状的DDVT患者进行长达6年的随访以观察PTS的发生风险,女性的PTS发病率达30%,且显著高于男性(OR=3.4,95%CI:1.7~6.6)[19]。
专家共识28:应用避孕药或激素替代治疗的成年女性患DDVT风险显著增加,一旦明确诊断需立即停用避孕药或激素,并进行DDVT的治疗。
8.4 孕产妇合并DDVT的管理
妊娠期和产褥期是发生VTE的危险因素,妊娠期DVT的发病率为0.052%~0.071%[68],但DDVT在妊娠期的发病率尚不明确。一项针对孕产妇VTE的回顾性研究显示,DDVT更常见于产后(P=0.02);不规范抗凝是合并VTE的孕产妇血栓复发的高危因素[68-69]。由于孕产期VTE风险升高,孕产期确诊DDVT时,在无抗凝禁忌证的情况下需要立即启动足量抗凝治疗,治疗原则与PDVT孕产妇相似[31,70-72];存在抗凝禁忌证的孕产期DDVT需采用序贯超声监测策略(每周1次WLUS检查、最少持续2周)随访血栓进展情况,如果观察到血栓蔓延至近端静脉,抗凝禁忌证消失则启动抗凝治疗,否则需放置下腔静脉滤器。妊娠期置入下腔静脉滤器的适应证与非妊娠期相同[73]。
与非妊娠女性的抗凝治疗不同,妊娠期女性抗凝剂的选择需考虑到胎儿安全及母体的围产期问题。理想的抗凝药物应能满足:不通过胎盘屏障,不经母乳分泌,意外出血风险低,胎儿致畸风险低等。UFH和LMWH均不通过胎盘,在妊娠期使用是安全的。以华法林为代表的VKA可通过胎盘,导致胎儿畸形、胎儿神经系统发育异常及母体出血等风险,不作为孕妇常规选择的抗凝药物。华法林不通过乳汁排泄,如产妇出血风险降低,可考虑予以华法林进行抗凝。但对于有机械心脏瓣膜的孕妇,使用UFH或LMWH抗凝治疗时血栓形成的风险仍较高,可考虑继续使用华法林抗凝,但在妊娠早期及分娩前应使用LMWH或UFH替代;磺达肝癸钠对胎儿影响的信息较少,但现有证据表明,对于需要抗凝、但有肝素诱导性血小板减少症(heparin-induced thrombocytopenia,HIT)病史或活动性HIT的孕妇,应首选磺达肝癸钠;DOACs对胎儿和新生儿的安全性及其与胎儿致畸的关系还不明确,此类药物通过乳汁分泌,可在乳汁中检测到,孕产妇应避免使用该类药物。
LMWH是孕产期治疗血栓形成的首选药物,孕产期体重、代谢、血浆容量和肾清除率等多种因素的变化会影响抗凝药物的药动学,LMWH的剂量应按照患者体重进行计算,必要时需监测抗Xa活性[70]。
分娩期如果能够预测分娩时间(如引产或计划性剖宫产),应在计划分娩前至少24 h停用LMWH,如果发生意外临产,应立即停用抗凝药物,严密监测分娩。分娩后如果没有发生显著出血,抗凝治疗应在剖宫产后12 h或阴道分娩后6 h重新开始使用。
孕产妇抗凝治疗的最佳持续时间尚不明确,应根据具体病例个体化确定。对于妊娠期间发生的DDVT,抗凝治疗的总疗程至少应为3~6个月,初始治疗3~6个月后可根据情况降低抗凝方案级别至中间剂量或预防性剂量,持续至产后6周[30]。DDVT危险因素为持续性的患者可能需要更长的治疗时间。
专家共识29:孕产妇DDVT的治疗首选LMWH,治疗剂量依据孕产妇的体重给予,分娩前至少24 h停用,分娩后6~12 h重新开始使用,抗凝治疗的总疗程应持续至产后6周。
8.5 危重症患者合并DDVT的管理
目前尚无明确的危重症患者与DDVT的相关研究。危重症患者本身就是VTE的高危人群,危重症住院患者中VTE高风险占25%~50%[74-75],高龄、肥胖、制动、心力衰竭、呼吸衰竭、VTE病史等因素增加了危重症住院患者发生VTE的概率[76-77]。美国血液学协会[78]、欧洲心脏病学会[64]、亚洲血栓防治组[79]及中华医学会老年医学分会联合中华医学会呼吸病学分会[80]均发布关于院内VTE的防控措施,推荐危重症患者若评估为VTE高风险,应接受7~14 d的预防性抗凝治疗,以有效降低院内发生VTE风险。但需注意,尽管住院期间接受常规的血栓预防措施,部分具有特定危险因素的危重症患者,在出院后至少21~45 d仍存在VTE风险[81]。
8.6 创伤骨科患者合并DDVT的管理
创伤是VTE的高危因素,创伤患者入院后进行损伤程度评分,有利于辨别患VTE的风险,并予以预防。对于低出血风险的外伤患者,可以考虑使用LMWH或DOACs[82]进行预防性抗凝,围手术期内一旦开始进行药物预防,通常需要抗凝至术后35 d,除非发生明显出血事件和(或)HIT等。即使如此,尚没有足够证据证明这种做法可降低DDVT发生率。一项回顾性研究显示,37.61%股骨骨折患者术前发生DVT,其中DDVT占86.59%;术后58.72%患者合并DVT,其中DDVT占90.63%[83]。创伤患者合并DDVT,如非高出血风险患者,应考虑启动抗凝治疗。在一项随机对照试验中,接受抗凝治疗的创伤合并DDVT的患者VTE复发率显著低于未进行治疗者[84]。目前,尚无高等级的证据表明DDVT会阻碍创伤患者实施手术,但可能会增加手术难度和围手术期管理难度[16],手术期间应充分止血,避免肢体的过多挤压;围手术期应严密进行血液和超声监测[85]。
专家共识30:对不伴有抗凝禁忌证的创伤患者,推荐采用药物进行DDVT的个性化预防,一般预防疗程为术后35 d,必要时可延长预防时间。创伤骨科合并DDVT患者,如非出血风险高危,应启动抗凝治疗。
8.7 关节骨科患者合并DDVT的管理
髋膝关节置换术后均应常规进行VTE预防,在无抗凝禁忌证情况下,应选择药物联合物理预防的抗凝措施[10]。髋膝关节置换术围手术期合并DDVT的研究较少,基于ACCP10[10]指南与临床经验,针对关节置换术患者围手术期的DDVT管理做如下建议:(1)首先应强调术前和术后主动肌力锻炼和术后尽早下地,使患肢承重并行走锻炼;(2)术前发现累及多条静脉的DDVT或血栓长度>5 cm,直径>7 mm的新鲜血栓(D-D水平明显升高且合并急性症状)可考虑延迟手术,抗凝治疗待血栓稳定后再行手术;(3)术前发现陈旧性DDVT(D-D水平升高不明显且无急性期症状),应加强康复锻炼并进行常规DVT二级预防措施;(4)术后发生累及多条静脉的DDVT或血栓长度>5 cm,直径>7 mm,应在床上加强主动肌肉力量锻炼,在无抗凝禁忌情况下应进行足量抗凝治疗;(5)术后发生单纯肌间静脉血栓,若担心出血风险,可采取观察策略或低剂量抗凝。
专家共识31:髋膝关节置换术患者围手术期应充分注意DDVT的预防和治疗。
8.8 脑卒中患者合并DDVT的管理
DVT是住院脑卒中患者常见的并发症。未预防情况下,DVT较容易发生在脑卒中后的第2~7天,其中2/3为DDVT[86]。年龄、性别、下肢瘫痪、肺炎、心房颤动和恶性肿瘤是脑卒中患者早期合并DDVT的独立危险因素[86]。
不同类型脑卒中的DVT发生率存在差异,其治疗策略影响不同。研究显示,出血性脑卒中DVT发生风险显著高于缺血性脑卒中[87-88]。当校正年龄、神经功能障碍严重程度等经典潜在混杂因素后,与脑梗死相比,脑出血后DVT的风险增加7倍(OR=7.305,95%CI:2.411~22.130,P<0.001),蛛网膜下腔出血后DVT的风险增加11倍(OR=11.92,95%CI:5.192~27.38,P<0.001)[88]。目前,对于急性缺血性脑卒中且行动不便的患者, 美国心脏病协会/美国卒中协会(American Stroke Association/American Stroke Association,AHA/ASA)指南[89]推荐在常规治疗(如阿司匹林抗血小板,优化容量管理等)的基础上,使用间歇式充气加压泵预防DVT。国际指南推荐间歇充气加压装置(Ⅰ类推荐,A级证据)用于脑出血后DVT的预防[90]。关于脑卒中合并DDVT的抗凝治疗目前还缺乏高质量证据,存在较大争议。
主要执笔人(按姓氏汉语拼音排名)
陈奕(首都医科大学附属北京妇产医院)、陈跃鑫(中国医学科学院 北京协和医学院 北京协和医院)、陈允震(山东大学齐鲁医院)、高红(首都医科大学附属北京妇产医院)、黄强(四川大学华西医院)、柳志红(中国医学科学院阜外医院)、米玉红(首都医科大学附属北京安贞医院)、裴福兴(四川大学华西医院)、邵群(哈尔滨医科大学附属肿瘤医院)、赵性泉(北京天坛医院)
共识专家组成员(按姓氏汉语拼音排名)
卞策(中国人民解放军火箭军总医院)、陈奕(首都医科大学附属北京妇产医院)、陈跃鑫(中国医学科学院北京协和医学院北京协和医院)、陈允震(山东大学齐鲁医院)、邓洪儒(首都医科大学附属复兴医院)、高红(首都医科大学附属北京妇产医院)、郭连瑞(首都医科大学宣武医院)、郭明金(青岛大学附属医院)、何菊(天津市第一中心医院)、黄强(四川大学华西医院)、黄小勇(航天中心医院)、黄晓钟(上海交通大学医学院附属仁济医院)、贾玉龙(北京天坛医院)、刘建龙(北京积水潭医院)、柳志红(中国医学科学院阜外医院)、陆清声(海军军医大学第一附属医院)、禄韶英(西安交通大学第一附属医院)、陆信武(上海交通大学医学院附属第九人民医院)、罗小云(北京世纪坛医院)、米玉红(首都医科大学附属北京安贞医院)、裴福兴(四川大学华西医院)、邵群(哈尔滨医科大学附属肿瘤医院)、史旭波(北京同仁医院)、王劲松(中山大学附属第一医院)、王磊(中国医学科学院 北京协和医学院 北京协和医院)、杨涛(山西白求恩医院)、叶志东(中日友好医院)、张爱启 (哈尔滨医科大学附属第二医院)、张福先(首都医科大学附属北京世纪坛医院)、张望德(首都医科大学附属北京朝阳医院)、张小明(北京大学人民医院)、赵性泉(北京天坛医院)、赵渝(重庆医科大学附属第一医院)、赵志青(海军军医大学第一附属医院)、郑月宏(中国医学科学院 北京协和医学院 北京协和医院)、周为民(南昌大学第二附属医院)、朱国献(深圳市第二人民医院)
利益冲突所有作者均声明不存在利益冲突

