sVAP-1联合ABCD3-I评分对短暂性脑缺血发作后急性脑梗死的预测价值
李 娜,张俊霞,吉维忠,吴芬香,李 沛,马玉青
(1青海省人民医院神经内科,西宁810007;2 华中科技大学同济医学院附属梨园医院神经内科,武汉430077)
短暂性脑缺血发作(transient ischemic attack,TIA)是因椎基底动脉或颈内动脉血供不足所致的局灶性脑组织缺血,以局灶性脑功能障碍为主要临床表现,通常在发病后30 min 内缓解[1]。尽管TIA 具有可逆性,但其容易发展为不可逆性脑梗死。因此,筛选TIA患者发生急性脑梗死(acute cerebral infarction,ACI)的危险因素并尽早干预十分必要。可溶性血管黏附蛋白1(soluble vascular adhesion protein 1,sVAP-1)是一种表达于平滑肌细胞、内皮细胞及脂肪细胞中的内皮细胞黏附分子,与血管病变关系密切,且参与调控血管炎症与免疫反应[2-3]。ABCD3-I 评分是在ABCD2 评分标准的基础上增加影像学检查结果及发作频率等信息,在评估ACI发生风险上更具优势。本研究以90 例TIA 患者为研究对象,探究ABCD3-I 评分与sVAP-1联合对ACI发生的预测价值。
1 资料与方法
1.1 一般资料选取2016 年1 月—2019 年1 月青海省人民医院神经内科接诊的TIA 患者90 例,男性46例,女性44 例,年龄46~78 岁,平均年龄(67.24±8.49)岁。纳入标准:(1)符合《中国脑血管病一级预防指南2015》中TIA 诊断标准[4],因脊髓、脑、视网膜局灶性缺血所致的短暂性神经功能异常,不伴ACI,持续时间<24 h,经颅脑影像学检查证实;(2)无严重视力或听力等沟通障碍;(3)临床资料完整,自愿接受随访。排除标准:(1)合并晕厥、阿斯综合征、局灶性癫痫、梅尼埃病等发作性疾病;(2)合并脑肿瘤、脑出血、脑炎、脑代谢性疾病、脑血管畸形者;(3)颅脑外伤史、手术史;(4)依从性差者。该研究获本院伦理委员会批准,患者或家属对本次研究内容知情同意。
1.2 血清sVAP-1 检测患者入院后清晨抽取肘部静脉血5 mL,3 500 r/min 离心15 min,收集血清冷冻保存。采用酶联免疫吸附法(euzymelinkedimmuno⁃sorbent assay,ELISA)检测血清sVAP-1 水平,严格按照剂盒说明书要求展开实验流程,Multiskan Sky 酶标仪(美国Thermo Fisher Scientific 公司)检测570 nm 波长光密度值,以标准品浓度和吸光度值绘制标准曲线,根据标准曲线计算血清sVAP-1水平。
1.3 ABCD3-I 评分方式[5]年龄≥60 岁计1 分;收缩压≥140 mmHg 或(和)舒张压≥90 mmHg 计1 分;存在语言障碍但肢体活动正常计1分,一侧肢体活动障碍计2 分;TIA 持续<10 min 计0 分,10~59 min 计1 分,≥60 min计2分;合并糖尿病计1分;7 d内发生双重TIA计2 分;磁共振弥散加权成像显示高信号计2 分;同侧颈动脉中度或重度狭窄计2分。总分13分。
1.4 TIA 治疗及随访入院后采用低分子肝素、阿司匹林治疗,针对发作频繁的患者采用小剂量尿激酶或者降纤酶,发作持续时间>60 min 的患者采用溶栓治疗。如TIA 超过7 d 未再次发作即可出院,出院后常规口服阿司匹林、氯吡格雷抗血小板治疗。出院后随访2 年,以患者发生ACI 或死亡为随访终点。将发生ACI 的患者设为ACI 组,未发生ACI 患者设为非ACI 组。ACI 诊断标准:急性起病;一侧面部或肢体麻木、无力;脑部MRI 排除脑出血;排除非血管性病因[6]。
1.5 临床资料收集与赋值收集ACI 组、非ACI 组临床资料,并进行赋值,包括性别(女=0,男=1)、吸烟(否=0,是=1)、饮酒(否=0,是=1)、高脂血症(无=0,有=1)、心脏病(无=0,有=1)、ACI 家族史(无=0,有=1)、抗血小板聚集治疗(有=0,无=1),年龄、体质指数(body mass index,BMI)、同型半胱氨酸、尿酸、TIA 发作频率、TIA 持续时间、TIA 首次发作至治疗时间、sVAP-1、ABCD3-I 为连续变量。对上述可能影响TIA 后ACI 发生的因素进行赋值,并以之为自变量,以是否发生ACI(否=0,是=1)为因变量行Logistic回归分析。
1.6 统计学方法采用SPSS 19.0 统计软件处理、分析数据,计量资料的结果以均数±标准差(±s)表示,两组间比较采用t检验;计数资料的结果以[n(%)]表示,两组间比较采用χ2检验;以Logistic回归分析法计算导致ACI 的危险因素比值比(odd ratio,OR)、95%可信区间(confidence interval,CI);建立受试者工作特征曲线(receiveroperating characteristic curve,ROC)分析sVAP-1 联合ABCD3-I 对发生急性脑梗死的预测价值。P<0.05为差异有统计学意义。
2 结果
2.1 随访结果对90例TIA 患者进行随访,其中8例失访,最终纳入82 例,随访时间24 h 至2 年,平均(0.89±0.13)年。 82 例 患 者 中 发 生ACI 者32 例(39.02%),其中24 h 发生ACI 的患者有3 例(3.66%),1~7 d 发 生15 例(46.88%),7~30 d 发 生6 例(18.75%),>30 d 至1 年发生5 例(15.63%),>1 年发生3 例(3.66%)。32 例ACI 患者设为ACI 组,其余50 例设为非ACI组。
2.2 ACI 组、非ACI 组血清sVAP-1、ABCD3-I 评分及其他可能影响因素差异比较与非ACI 组比较,ACI组患者心脏病构成比、TIA发作频率、血清sVAP-1 水平、ABCD3-I 评分较高,TIA 持续时间较长,差异均有统计学意义(P<0.05);两组年龄、性别、体质指数(BMI)、吸烟、饮酒、高脂血症、ACI 家族史、同型半胱氨酸、尿酸、TIA 首次发作至治疗时间、抗血小板聚集治疗等临床资料比较,差异无统计学意义(P>0.05)。见表1。

表1 两组血清sVAP-1、ABCD3-I评分及其他可能影响因素差异比较
2.3 Logistic回归分析法分析TIA后发生ACI的影响因素Logistic回归分析显示,高sVAP-1、高ABCD3-I 评分均是TIA 后发生ACI 的危险因素(OR=4.674、3.873,P<0.05)。见表2。

表2 Logistic回归分析法分析TIA后发生ACI的影响因素
2.4 sVAP-1 联合ABCD3-I 对TIA 后发生ACI 的预测价值sVAP-1、ABCD3-I 预测TIA 后发生ACI 的最佳截断点分别为79.19 ng/mL、7.15 分,两者单独及联合预测TIA 后发生ACI 的ROC曲线下面积(AUC)分别为0.778、0.788、0.844。见表3、图1。

表3 sVAP-1联合ABCD3-I对TIA后发生ACI的预测价值
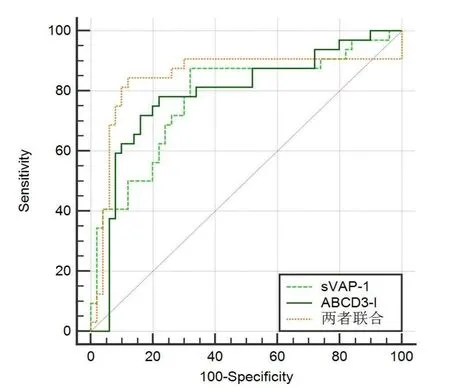
图1 sVAP-1、ABCD3-I单独及联合预测TIA后发生ACI的ROC曲线
3 讨论
TIA 是一种常见的、反复发作的缺血性脑血管疾病,目前关于其发病机制尚存在争议,其中心脏疾病、血液成分及血流动力学变化、微栓塞、动脉粥样硬化斑块形成广为认可,与缺血性脑卒中的病理生理基础相似[7]。研究已证实,TIA 是ACI 的超级预警信号,患者继发ACI 的风险很高[8]。有研究发现,在2 d 内发生ACI 的TIA 患者有10.40%,7 d 内23.10%,30 d 内30.8%[9]。本研究结果中7 d 内发生ACI 的TIA 患者占21.96%,与上述研究结果相似,但高于国外某些研究[10],分析原因可能为本次入选的研究对象为住院患者,存在病情反复、症状较严重及高危因素多等问题;部分TIA 患者先至门诊就诊,延误早期病情评估及治疗,导致病情控制效果不理想发展为ACI。
本研究通过比较发生ACI 与未发生ACI 的患者临床资料时发现,发生ACI 患者心脏病构成比、TIA发作频率、血清sVAP-1 水平、ABCD3-I 评分较高,TIA 持续时间较长,经Logistic回归分析法显示,高sVAP-1、高ABCD3-I 评分均是TIA 后发生ACI 的独立危险因素。(1)ABCD3-I 评分以年龄、血压、临床表现、TIA 特征、糖尿病、颈动脉狭窄程度和影像学特征为作为评分细则,能够较为全面地评估TIA 患者的病情严重程度[11]。该评分将血压和颈动脉狭窄作为重要指标进行评估。高血压是ACI 的独立危险因素已被临床公认,高血压可导致内皮细胞及血小板激活、凝血因子增加、血液黏稠度升高,并引发小动脉中层损伤,动脉内膜纤维化、玻璃样变甚至微动脉坏死,故而可显著增加TIA 患者发生ACI 的风险[12]。颈动脉狭窄时,血流速度加快,但远端血流速度缓慢,导致低灌注状态,且狭窄段形成湍流,有形成分开始聚集,形成血栓。颈动脉狭窄程度越严重,狭窄段血流越快,血流切应力作用越大,血管越易发生破裂。(2)sVAP-1 属于同型二聚体糖蛋白,可诱导白细胞浸润TIA 缺血组织及动脉粥样斑块,导致微循环通道发生机械性堵塞,并释放大量毒性物质加剧内皮损伤及组织损伤。此外,sVAP-1 所具有的酶活性作用可促进血管内皮成分发生氧化,生成过氧化物、胺、醛等物质,从而加快动脉粥样硬化斑块形成。张艳迪等[13]研究显示,sVAP-1 与动脉僵硬度具有明显的独立相关性,即其水平越高动脉僵硬度越严重。(3)ACI危险因素间存在相互关联,仅依靠一种因素对TIA 患者进行危险分层并不全面。ABCD3-I 评分是患者年龄、血压、肢体活动、语言障碍、TIA持续时间、TIA发生频率、颈动脉影像学结果的综合体现。ABCD3-I 评分高提示患者合并多种危险因素,此时危险因素非相加而是相乘,ACI发生风险呈倍数增长[14]。
本研究ROC结果显示,sVAP-1、ABCD3-I 预测TIA 后发生ACI 的最佳截断点分别为79.19 ng/mL、7.15 分,两者单独及联合预测的AUC 分别为0.778、0.788、0.844,提示两者联合对TIA 后发生ACI 的预测价值高于单独预测。尽管ABCD3-I 评分评价内容全面,但在临床实践中发现,根据ABCD3-I 评分划分为中、低危险分层的患者仍有较高的ACI 发生率,可能与其未涉及实验室指标有关[15]。 二聚体糖蛋白sVAP-1是参与动脉粥样硬化斑块形成的新型血清学指标,检测方便、结果准确,其作为单独预测TIA 后ACI 发生的灵敏度和特异度分别达78.13%、70.00%,说明sVAP-1 预测价值较高。 血清sVAP-1 与ABCD3-I 联合进行预测时,灵敏度和特异度分别达75.00%、84.00%,说明sVAP-1 联合ABCD3-I 可更加准确地评估患者内皮损伤及炎症、氧化应激反应程度,提高预测价值。
综上所述,TIA 后ACI 患者血清sVAP-1 水平及ABCD3-I评分异常升高,两者联合对ACI的发生具有较高的预测价值,提示临床中可应用此二指标对TIA患者预后ACI 进行预测,以及时选择有效干预手段,降低ACI发生风险。
本研究由于经费及研究时间的限制,纳入样本量较小,可能使结果产生偏倚,在今后的研究中将扩大样本量,并进一步对结果进行验证。

