一株根霉菌在提高米醋风味方面的应用
黄艳,周其洋,高庭,童星,2*
(1.佛山市海天(高明)调味食品有限公司,广东 佛山 528511;2.佛山市海天调味食品股份有限公司,广东 佛山 528000)
米醋是以大米为原料,经过液化、糖化、酒精发酵、醋酸发酵等工艺制备而成的调味品。含有丰富的氨基酸、有机酸、维生素及矿物质,营养丰富。米醋品质的好坏,除与醋酸菌有关外,还与米酒息息相关,原料大米的液化、糖化及酒精发酵是提升米酒及米醋品质的关键。好曲出好酒,通过提升微生物的糖化力、液化力及产酒、产酸性能,选育不同类型的微生物,如醋酸菌等的选育或者固定化[1-3],高产糖化酶的米根霉、酵母选育[4-5],进行相应的工艺优化,均在米酒品质提升上取得了不错的进展。随着技术的进步,酶在调味品中广泛应用[6],2种微生物的协同制曲已在酱油中应用,4种酶活力都不同程度地提高[7],为米曲微生物共发酵带来了新的思考。本文通过对传统酒曲的筛选,获得一株高糖化酶、高产酸性蛋白酶,不产黑孢子的根霉菌。采用该菌株与增香产酯酵母共同培养制备米曲,发酵米酒,再经醋酸菌作用获得米醋,可显著改善液态发酵食醋的口感与风味,提升米醋的品质。
1 材料与方法
1.1 材料
原材料:以佛山市海天调味食品有限公司生产的酒曲作为菌种筛选原材料。
培养基的制备方法:初筛培养基的制备方法:称取200 g马铃薯,洗净、去皮、切碎,加水1000 mL煮沸0.5 h,用纱布过滤,再加10~20 g葡萄糖和15~20 g琼脂,充分溶解,分装,高压蒸汽灭菌(121 ℃,20 min)。复筛培养基的制备方法:牛肉膏 5 g,蛋白胨10 g,氯化钠 5 g,可溶性淀粉2 g,水1000 mL,pH 7.0~7.2,琼脂20 g,高压蒸汽灭菌(121 ℃,20 min)。
1.2 菌种的选育与鉴定方法
1.2.1 初筛方法
在灭菌后的超净台内,将酒曲粉碎后,过40目筛,称取筛下物25 g加入装有225 mL无菌三级水的三角瓶中,加入数颗玻璃珠,于150 r/min摇床中振荡30 min,使得酒曲的微生物均匀分布形成菌悬液。
将所得到的菌悬液进行梯度稀释,添加无菌水制成不同的稀释梯度10-3,10-4,10-5,10-6CFU/mL的稀释液,吸取0.2 mL加入含有去氧胆酸钠和链霉素的PDA固体培养基,用涂布棒涂布均匀。
将上述平板置于30 ℃培养箱培养24 h后,挑选具有根霉菌典型菌落形态的单菌落,挑种至PDA培养基再培养,进而纯化出根霉纯菌。
1.2.2 复筛方法
将上述纯化的单菌落转接到淀粉鉴别培养基中进行培养,以水解圈大小对各菌落进行编号,培养一段时间后,挑选水解圈/菌落圈最大的菌株。
将挑选后的菌株经过多次初筛、复筛后,最终筛选出一株根霉菌,命名为ZH805。
1.2.3 菌种鉴定
采用常规微生物鉴定方法。
1.3 协同制备种曲的方法
1.3.1 小斜面培养
将选育的根霉菌接种于PDA固体培养基中,增香产酯酵母接种于麦芽汁固体培养基(制备方法:1000 mL麦芽汁,15~20 g琼脂,高压蒸汽灭菌(115 ℃,20 min)中,分别于30 ℃培养2~3 d,即活化为一代菌株。
1.3.2 三角瓶培养
将1.3.1步骤的选育根霉菌接种于已灭菌的PDA液体培养基(制备方法:称取200 g马铃薯,洗净、去皮、切碎,加水1000 mL煮沸30 min,用纱布过滤,再加10~20 g葡萄糖,充分溶解后趁热用纱布过滤,分装,高压蒸汽灭菌(121 ℃,20 min),于30 ℃,150 r/min培养24 h,使其菌体浓度为107~108CFU/mL,于4 ℃冰箱中保藏备用。
将1.3.1步骤的增香产酯酵母接种于已灭菌的PDA液体培养基中,于30 ℃,150 r/min培养24 h,使其菌体浓度为107~108CFU/mL,于4 ℃冰箱中保藏备用。
1.3.3 种曲培养
将麸皮与米糠按照7∶3(质量比)进行混合、润水,装于曲盘中,每盘装5 kg曲料并进行灭菌,然后将1.3.2步骤的选育根霉菌和增香产酯酵母分别接种于已事先灭菌的曲料中,于30 ℃条件下进行扩大培养,培养2~3 d即可成熟,为种曲。
1.4 成曲及米酒制备方法
大米→洗净→浸泡→蒸饭→淋冷→拌曲→糖化发酵→过滤处理→巴氏灭菌→成品米酒。
以大米为原料,加入自来水浸泡6~8 h,滤干水后,于0.15 MPa压力下蒸煮30 min,待米饭冷却后分别添加上述种曲,选育根霉菌接种量为1%,产酯酵母接种量为6‰~8‰,同时以根霉菌3.866、根霉菌Q303为对照,于30 ℃、相对湿度80%左右条件下培养48~72 h,培养结束即为成熟曲料,取成熟曲料检测糖化酶、酸性蛋白酶和酯化酶活力。
将曲料加水,接入已活化好的活性干酵母,接种量为5%,接种后将曲料搅拌均匀。于28~33 ℃条件下静置发酵4~5 d,发酵结束后通过板框过滤器进行压榨,得到米酒清液,并检测米酒清液的酒精度。
1.5 发酵米醋制备方法
将上述米酒清液泵送至醋酸发酵罐,接入已活化好的醋酸菌进行醋酸发酵,采用Frings深层液态发酵罐(德国福林斯公司),获得对应米醋醋坯。
1.6 检测方法
1.6.1 糖化酶活力、酯化酶活力的测定
参照国标GB 1886.174-2016《食品添加剂 食品工业用酶制剂》中的方法。
1.6.2 酸性蛋白酶活力的测定
参照国标GB/T 23527-2009《蛋白酶制剂》。
1.6.3 酒精度的测定
采用蒸馏-重铬酸钾比色法测定[8]。
1.6.4 还原糖的测定
采用国标GB/T 5009.7-2016《食品中还原糖的测定》[9]。
1.6.5 总酸、氨基酸态氮的测定
参照国标GB/T 13662-2008《黄酒》中的方法[10]。
1.6.6 总酯的测定
参考GB/T 19777-2013《地理标志产品 山西老陈醋》[11]。
1.6.7 不挥发酸的测定
采用酸碱中和滴定法。
2 实验结果
2.1 菌种的选育及鉴定
将筛选出的选育根霉菌进行相关的生理生化特性检测,其检测结果与根霉菌3.866对比,基本一致。
依据1973年科学出版社出版的周德庆主编的《微生物学实验手册》、《常见与常用真菌》相关书籍作为菌株形态学特征的参考依据。
本文筛选的选育根霉菌的菌落形态为PDA固体培养基培养15 h后,菌落直径约为1.0~1.4 cm,菌丝致密。36 h后菌丝铺满整个平板,该平板的形态见图1。

图1 根霉ZH805菌落形态图Fig.1 The colony morphology of Rhizopus ZH805
由图1可知,选育根霉菌均为白色孢子,无黑色孢子产生。
2.2 不同根霉菌制备成曲及发酵米酒关键指标的检测结果
对不同根霉制备的成熟曲料检测糖化酶、酸性蛋白酶和酯化酶活力,对应曲料发酵成熟后,检测米醋的酒精度和还原糖指标,其检测结果见表1。
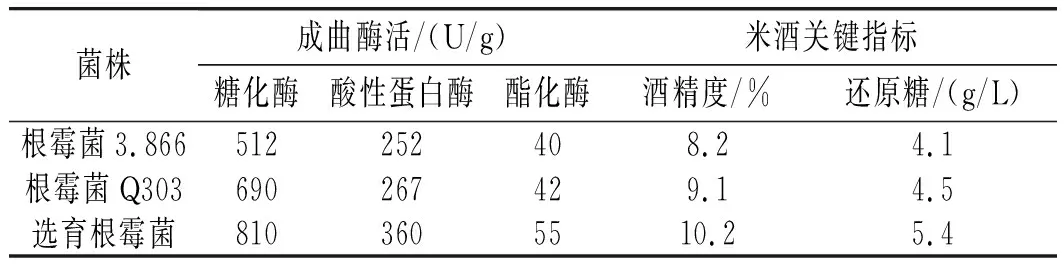
表1 不同根霉菌制备曲料及发酵米酒检测结果Table 1 The testing results of koji materials prepared by different Rhizopus and fermented rice wine
由表1可知,采用选育根霉菌制备的米曲检测糖化酶、酸性蛋白酶和酯化酶较根霉菌3.866分别提高了58%、43%、37.5%,较根霉菌Q303分别提高了17.4%、35%、31%。采用选育根霉菌发酵的米酒,其酒精度较根霉3.866和根霉Q303分别提高了24.4%和12%,且其清液残留的还原糖也明显高于其他两株根霉,充分说明根霉ZH805较其他两株根霉具有较高的原料利用率。
2.3 米醋关键理化指标和感官鉴评结果
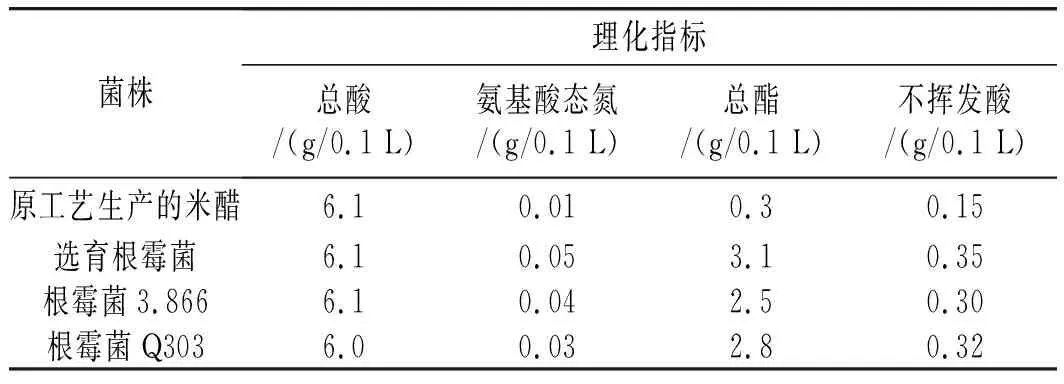
表2 不同曲料发酵米醋检测结果Table 2 The testing results of fermented rice vinegar with different koji materials
由表2可知,对比现有工艺生产米醋与选育根霉菌制备的米醋,选育根霉菌的各项理化指标均要远远优于常规的液态发酵米醋,特别是其氨基酸态氮、总酯与不挥发酸方面。对比不同根霉菌制备的米醋,选育根霉菌在酸度相近的情况下,其他各项理化指标均优于另外两组根霉发酵的米醋。
将现有工艺生产的米醋、选育根霉菌与根霉菌3.866、根霉菌Q303发酵的米醋在色泽、香气、刺激性、回甜度、酸味等方面进行感官鉴评分析,感官鉴评由经过专业训练的专业人员进行,以上评价指标的分值为0~5分,分数越高,该项指标越好,其鉴评结果见表3和图2。
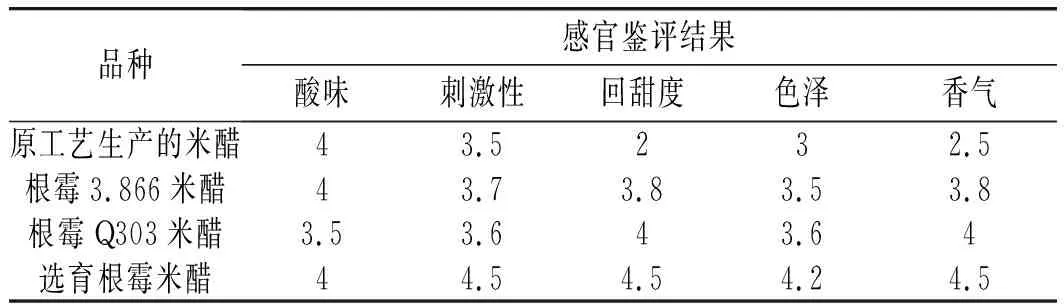
表3 米醋感官鉴评结果Table 3 The sensory evaluation results of rice vinegar

图2 发酵米醋感官鉴评结果Fig.2 The sensory evaluation results of fermented rice vinegar
由表3和图2可知,与原工艺生产的米醋相比,根霉菌大米制曲发酵的米醋在香气、色泽、回甜度等方面均有较大改善,且选育根霉菌在香气、色泽和回甜度3个维度上的表现均要优于其他两株根霉菌。综上所述,采用选育根霉菌米曲制备工艺可以显著改善液态发酵食醋的口感与风味,全面提升米醋的质量。
3 结论
本文通过从米曲中筛选优势根霉菌,结合我司优秀的产酯酵母共同制曲后,进行米酒发酵,进而借助醋酸菌制备米醋。不同于同行业以往的思路,进行单一优势菌种的选育,本文中选育的根霉来源于酒曲,增香酵母为我司自有优势酵母,借助这种优势微生物互补作用,首先增大工业化大生产下米酒工艺的稳定性,进而更加稳定地提升米醋的品质。

