禽流感病毒(H9亚型)重组CHO细胞258株的构建及鉴定
宋 扬,于 镭,梁宛楠,李 倩
(哈药集团生物疫苗有限公司,哈尔滨 150069)
禽流感(Avian influenza,AI)是由禽流感病毒(Avian influenza virus,AIV)引起的一种以全身性败血症和呼吸系统疾病为特征的人兽共患传染病。根据致病性和毒力不同,AIV可分为非致病性禽流感(NPAIV)、高致病性禽流感(HPAIV)和低致病性禽流感(LPAIV)。HPAIV以死亡率高和传播范围广为主要特征。H9 亚型禽流感为LPAIV,感染后不会导致群体大批死亡,但是感染率较高,感染后会引起禽类呼吸困难、采食下降、产蛋率下降等临床症状,且易继发其他疾病。同时,流感病毒变异速度极快,极有可能由原来的低致病性禽流感进化为致病能力更强的毒株。国际检验兽疫局(OIE)已将禽流感定为A类传染病,我国农业农村部将其列为甲类监测传染病。目前禽流感疫苗主要有灭活疫苗和减毒活疫苗。灭活疫苗主要诱导机体产生体液免疫应答,不能抵抗异源毒株的感染,长期使用易导致不同亚型抗原间的重排和抗原变异,常出现免疫失败的现象。减毒活疫苗仍存在活病毒成分,有返毒风险,且疫苗的保存、成本和运输条件要求较高。为了弥补传统疫苗不足,利用基因工程重组技术开发新型有效的疫苗是十分必要的。
本研究以“禽流感病毒(H9 亚型)258 株”为模板,以AIV 的HA 基因的胞外域与3 个重复串联的M2 蛋白胞外域为靶基因,插入真核表达载体pCIGS 中,构建了含有HA-M2e 基因的重组质粒,并转染CHO 细胞,经加压筛选获得重组高度表达HA-M2e 蛋白的重组CHO 细胞株。以期为禽流感病毒(H9亚型)重组疫苗的研制奠定基础。
1 材 料
1.1 病毒、细胞、菌株和载体
pUC-HA-M2e 质粒载体,由上海桑尼生物科技有限公司对AIV HA-M2e蛋白基因进行优化后构建并供应;pCI-GS 质粒,由苏州世诺生物技术有限公司构建并提供;CHO 细胞,购自武汉大学中国典型培养物保藏中心;DH5α 感受态细胞,北京全式金生物技术有限公司产品。
1.2 主要试剂仪器
低熔点琼脂糖,BD 公司产品;PVDF 膜(聚偏氟乙烯),Millipore 公司产品;Xho Ⅰ、EcoR Ⅰ限制性内切酶,T4 DNA连接酶以及DNA Marker均为New England Biolab(北京)有限公司产品;PCR 扩增所用聚合酶,购自天根生化科技(北京)有限公司;pfu PCR Master Mix,购自天根生化科技(北京)有限公司;胎牛血清,购自GIBCO BRL 公司;抗AI VHA-M2e蛋白的单克隆抗体,由哈药集团生物疫苗有限公司实验室制备;CHO 细胞无血清无蛋白培养基(CHO-WM 培养基),苏州市沃美生物技术有限公司产品;胰蛋白胨、酵母提取物、氯化钠,购自国药试剂有限公司;化学发光成像仪,上海天能科技有限公司产品。
PCR引物,由生工生物工程(上海)股份有限公司合成,引物序列及扩增基因见表1。
2 方 法
2.1 HA-M2e基因扩增与纯化
在上海桑尼生物科技有限公司合成了密码子优化后的HA-M2e 基因并克隆到pUC-57 载体上,得到pUC-HA-M2e 质粒载体。以pUC-HA-M2e 质粒作为模板,HA-M2e-F、HA-M2e-R作为上、下游引物进行PCR扩增,扩增体系(25 μL),见表2。

表2 HA-M2e基因扩增体系 μL
扩增条件为:94 ℃预变性5 min;95 ℃变性45 s,60 ℃复性45 s,72℃延伸2 min,30 个循环;72 ℃延伸10 min,4 ℃保藏。
将PCR 产物进行凝胶电泳验证目的基因大小,用凝胶回收纯化试剂盒进行回收纯化。
2.2 HA-M2e基因与pCI-GS质粒的连接
将凝胶回收纯化PCR 产物和pCI-GS 质粒载体使用Xho Ⅰ、 EcoR Ⅰ酶37℃酶切3 h,具体酶切反应体系见表3、表4。

表3 HA-M2e基因酶切反应体系 μL

表4 pCI-GS质粒酶切反应体系 μL
将酶切产物进行凝胶电泳,分别使用凝胶回收纯化试剂盒纯化酶切的pCI-GS 质粒以及HA-M2e基因片段。
2.3 连接
将酶切过的pCI-GS 质粒和HA-M2e 基因酶切产物使用T4 DNA连接酶16 ℃水浴连接过夜。具体连接反应体系见表5。

表5 HA-M2e基因与pCI-GS质粒连接体系
2.4 转化
将10 μL连接产物加入100 μL的DH5α感受态细胞中混匀,冰浴30 min,42 ℃水浴热休克90 s,再冰浴2 min,加入900 μL 不含氨苄西林(Amp)的LB培养基。37 ℃培养1 h,将1.0 mL 菌液离心浓缩成100 μL 涂布于含有Amp 的LB 固体培养基上,37 ℃培养16 h。
2.5 重组质粒的提取
挑取平板上4 个单菌落分别接种LB 液体培养基中,37 ℃培养2 h,以菌液作为模板,以HAM2e-F 和HA-M2e-R 为引物进行菌落PCR。反应条件为:94 ℃预变性5 min;95 ℃变性45 s,60 ℃复性45 s,72 ℃延伸2 min,30个循环;然后72 ℃延伸10 min,4 ℃保藏。将PCR产物凝胶电泳,EB染色,紫外灯下查看电泳胶。待检样品出现一条分子量约为1.7 kb的DNA带,判为阳性;反之,判为阴性。对鉴定出的阳性克隆进行测序,选择序列以及连接方向正确的菌株保藏。
2.6 细胞转染
2.6.1 准备细胞
取对数生长期的CHO 细胞,取样计数,以1×106cells·mL-1的细胞密度继续传代,维持种子,剩余细胞离心,1000 r·min 离心4 min 后弃上清,用20 mL 左右的新鲜CHO-WM 培养基重悬,再次离心,1000 r·min 离心4 min,弃上清后用少量培养基重悬计数,最终将细胞密度调整为1.43×107cells·mL-1。
2.6.2 质粒与细胞混合
取pCI-HA-M2e-GS重组质粒5 μg,加入至EP管中,添加0.7 mL细胞,混合均匀后静置15 min。
2.6.3 电转
280 V 20 ms电击2个脉冲,电击完成后立刻将细胞转入至摇瓶中,悬浮培养48 h 后观察细胞状态,换液培养,等细胞密度生长到0.6×106cells·mL-1时,添加50 μmol·L-1MSX(L-methionine sulphoximine)加压筛选。
2.7 单克隆筛选
2.7.1 重悬
用苏州沃美生物技术有限公司的CHO 细胞无血清无蛋白培养基CHO-WM细胞培养基+50 μmol·L-1MSX重新悬浮细胞,计数。
2.7.2 铺板
稀释细胞至5 个·mL-1,取200 μL 混匀的细胞加入到96 孔板中,放置到37℃、5% CO2细胞培养箱中孵育4~6 h。记录单个细胞的孔。
2.7.3 筛选
待96 孔板中单个细胞的孔长起来时,弃掉培养基, 用PBS 液洗1 次, 100 μL 0.25% trypsin-EDTA室温消化2 min左右,加入2 mL CHO-WM 培养基(含10% FBS+50 μmol·L-1MSX)终止消化反应,并用移液器将细胞吹散。将细胞转移至12 孔板,待12 孔板长满时,取上清液,酶联免疫吸附试验(ELISA)检测克隆是否为阳性,高效表达的阳性克隆继续扩大培养,冻存。
2.8 细胞摇瓶发酵
2.8.1 传代培养基的配置
使用CHO-WM培养基添加50 μmol·L-1MSX作为传代培养基,置于37 ℃水浴锅预热至37 ℃。
2.8.2 计数
从CO2恒温摇床取出摇瓶细胞,进行计数。
2.8.3 孵育
稀释细胞至2.5~3.5×105个cells·mL-1,接种30 mL培养基于一个125 mL摇瓶中。细胞培养瓶放置到37 ℃、5% CO2恒温摇床中100 r·min-1孵育过夜。
2.8.4 测蛋白
每隔24 h计数细胞密度以及活力,监测葡萄糖浓度,当糖浓度低于2 g·L-1的时候添加葡萄糖到4 g·L-1;每天取1 mL 样品,上清液用于检测蛋白质表达情况。
2.9 表达HA-M2e蛋白的重组CHO细胞的鉴定
2.9.1 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)检测
将收获的上清液进行SDS-PAGE检测,同时使用空的CHO细胞作为阴性对照。取40 μL收获的细胞培养物,加入10 μL 的5×上样缓冲液,沸水浴5 min,12000 r·min-1离心1 min,取上清液进行SDS-PAGE 凝胶(12%浓度)电泳,电泳后取凝胶经染色、脱色后观察目的条带。
2.9.2 蛋白质免疫印迹(Western Blot)鉴定
将SDS-PAGE电泳后的产物转印到硝酸纤维素(NC)膜上,用5%脱脂牛奶封闭2 h,AIV HA-M2e单克隆抗体阳性血清孵育2 h,漂洗,HRP 标记的羊抗鸡多克隆抗体二抗孵育2 h,漂洗,然后滴加增强型化学发光荧光底物,使用化学发光成像仪拍照。
2.9.3 琼扩检测
在琼脂糖凝胶板上打梅花孔,在梅花孔中间加入AIV 琼扩检测标准血清,周围分别加入稀释了20、21、22、23、24、25、26、27、28、29、210倍的表达抗原。倒置孵育72 h后观察沉淀线。出现沉淀线的最大稀释比例为其琼扩效价。
2.9.4 间接免疫荧光检测
向96 孔培养板中加入重组CHO 细胞悬液,100 μL·孔-1(细胞浓度为2.5×105~4.0×105个·mL-1),接种4 孔,27 ℃静置15 min,使重组CHO 细胞贴于培养板底壁,同时设空白细胞对照。细胞置27 ℃恒温培养箱中培养72~96 h,弃培养液,冷甲醇∕丙酮(1∶1)固定。首先与鸡源抗AIV多抗血清反应,然后与FITC 标记的羊抗鸡IgG 反应,倒置荧光显微镜观察结果。
2.9.5 目的蛋白的表达量测定
将收获的上清用双抗体夹心ELISA法进行蛋白含量测定。
3 结果与分析
3.1 重组质粒pCI-HA-M2e-GS构建及鉴定
以pUC-HA-M2e作为模板,HA-M2e-F、HAM2e-R 作为引物进行PCR 扩增,凝胶电泳结果显示在约1.7 kb 处出现目的条带,与预期结果相符,表明HA-M2e 基因片段扩增成功,具体结果见图1。将扩增成功的HA-M2e 基因片段克隆于pCI-GS 质粒,菌落PCR 鉴定在约在1.7 kb 处出现目的条带,与预期结果相符,具体结果见图2。表明重组质粒pCI-HA-M2e-GS构建成功。

图1 HA-M2e基因的PCR扩增结果

图2 pCI-HA-M2e-GS酶切鉴定结果
3.2 重组HA-M2e蛋白的鉴定
3.2.1 SDS-PAGE检测
将收获的上清进行SDS-PAGE检测,同时使用空的CHO 细胞作为阴性对照。结果显示样品在66 ku 附近出现明显条带,对照未出现相应条带,具体结果见图3。

图3 SDS-PAGE检测重组病毒表达产物
3.2.2 Western Blot鉴定
将SDS-PAGE 电泳后的产物进行Western Blot鉴定,表达HA-M2e 蛋白的重组CHO 细胞上清样品有对应条带,阴性对照没有目的条带,说明目的抗原蛋白在CHO 细胞中得到正确表达。具体结果见图4。

图4 Western Blot鉴定结果
3.2.3 琼扩检测
使用琼扩方法检测表达的重组HA-M2e 蛋白,结果表明HA-M2e蛋白琼扩效价为1∶512。
3.2.4 间接免疫荧光检测
结果空白细胞对照均无绿色荧光,重组CHO细胞观察到绿色荧光。具体结果见图5。
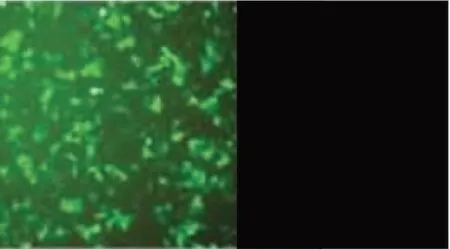
图5 间接免疫荧光检测结果
3.2.5 目的蛋白的表达量测定
将收获的上清液用双抗体夹心ELISA法进行蛋白含量测定,结果蛋白含量为1.13 mg·mL-1。
4 结论
本研究利用分子生物学操作技术成功构建了表达AIV HA-M2e 蛋白的重组CHO 细胞,即含AIV HA-M2e基因的重组bCHO细胞258株。
通过SDS PAGE 和Western Blot 鉴定,证实了AIV HA-M2e基因在CHO细胞中能够正确表达,表达蛋白琼扩效价为1∶512,表达抗原蛋白含量达到1.13 mg·mL-1。以上结果表明,通过基因工程技术构建的含AIV HA-M2e 基因的重组CHO 细胞258株,能特异表达AIV HA-M2e蛋白,与AIV单抗的免疫学反应良好,且在CHO 细胞上能稳定增殖,可作为疫苗研制用毒株。
——一道江苏高考题的奥秘解读和拓展

