叶酸介导的一碳代谢在癌症中的研究进展*
杨成灿,张吉发,陈俊成,欧阳亮
610041成都,四川大学华西医院 生物治疗国家重点实验室
癌症的代谢通常以代谢需求、营养供应和代谢酶调节为特征[1]。虽然这些特征中有许多与特定的遗传因素有关,但越来越多的证据表明,代谢调节与遗传因素一致,对癌症的发病率和生物学进展有重要影响[2-3]。因此,特异性靶向肿瘤代谢成为肿瘤治疗的主要治疗策略。叶酸是一种水溶性B族维生素,从食物中提取,在体内转化为四氢叶酸(tetrahydrofolate,THF),参与体内许多生化反应。通过叶酸介导的一碳代谢(folate-mediated one-carbon metabolism,FOCM),THF可以为DNA复制或甲基化提供必需的核苷酸或一碳基团,在表观遗传学中具有重要作用[4]。最早关于FOCM和癌症治疗的报告可以追溯到20世纪40年代(图1)。抗叶酸剂氨基蝶呤被发现可以缓解儿童急性淋巴性白血病(acute lymphoid leukemia,ALL)的症状,在治疗急性白血病、绒毛膜癌和肺腺癌方面曾具有重要意义[5],表明靶向FOCM治疗癌症是一个行之有效的方法。本文重点综述FOCM中关键酶(SHMT2和MTHFD2)作为潜在的癌症治疗靶标,讨论其在癌症中的表达、潜在功能、调控机制以及部分抑制剂,为未来开发对应的药物提供参考。

图1 FOCM在癌症中发现的时间线
1 癌症中叶酸介导的一碳代谢
FOCM包括与叶酸代谢相互连接的代谢途径网络,这些代谢途径对丝氨酸和甘氨酸的相互转化、从头嘌呤合成、从头胸腺嘧啶合成以及同型半胱氨酸到蛋氨酸的甲基化至关重要。FOCM在细胞中被室隔化,分别定位于细胞质、细胞核或线粒体(图2)[6]。FOCM作为细胞营养状态的调节器和传感器,控制一碳基团在不同受体之间分配,进而影响核苷酸、某些氨基酸、S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)和谷胱甘肽的合成[7]。此外,FOCM通过产生谷胱甘肽参与氧化还原稳态的调节[8]。因此,FOCM不仅合成生物所需的各种营养物质,而且通过其表观遗传和氧化还原状态调节细胞的营养状态。FOCM涉及多种途径,包括核苷酸合成、甲基化和氧化还原稳态,是细胞增殖所必需的。在乳腺癌、肝癌、肺癌、结直肠癌和膀胱癌等多种癌症中都发现了叶酸代谢异常[9-12]。表明癌症中叶酸代谢的研究具有普遍性:1)它为细胞增殖提供必要的营养物质;2)影响氧化还原在体内的稳定性。因此,FOCM作为癌症治疗的可行目标引起了广泛关注。

图2 FOCM在细胞中的室隔化
2 癌症治疗中的抗叶酸药物
目前美国食品药品监督管理局列出的抗叶酸抗肿瘤药物主要为胸腺嘧啶核苷酸合酶(thymidylate synthase, TYMS)和二氢叶酸还原酶(dihydrofolate reductase, DHFR)的抑制剂。这两类药物通过影响FOCM中嘌呤和胸苷酸的合成,抑制癌细胞中DNA的复制[13]。到目前为止,相关药物已被广泛应用于急性淋巴细胞白血病、结直肠癌、晚期非鳞状细胞癌和外周血淋巴细胞淋巴瘤[14]。最近,针对线粒体中的SHMT2和MTHFD2在癌症治疗中受到高度关注。线粒体不仅是细胞的能量工厂,还为细胞的生长提供各种营养素。在对癌细胞中的mRNA的分析研究中发现,SHMT2和MTHFD2为多种肿瘤中表达水平最高的五大基因之一[15-16]。此外,有研究表明,SHMT2和MTHFD2的异常表达会影响DNA合成并破坏氧化还原平衡[17]。因此,FOCM是癌症治疗中一个有吸引力的目标。鉴于线粒体代谢与癌症之间的关系,我们在此重点介绍线粒体酶SHMT2和MTHFD2,以突出其作为癌症治疗目标的潜力。
3 SHMT2
人类肿瘤的大规模基因组研究结果显示,SHMT2对肿瘤细胞的存活至关重要[15]。此外,SHMT2在许多癌症中高表达,如胶质瘤、结直肠癌和乳腺癌[10,18-19]。在敲除SHMT2之后能够抑制癌细胞的增殖,这为靶向SHMT2进行癌症治疗提供了良好的思路[20]。
3.1 SHMT2影响氨基酸代谢
丝氨酸是叶酸循环中重要的一碳单位供体,它参与核苷酸合成、甲基化反应和NADPH形成,并在氧化还原稳态中发挥作用[18]。SHMT2可以催化线粒体中丝氨酸分解为甘氨酸和CH2-THF(图2)。甘氨酸也被纳入下游代谢物,如谷胱甘肽和嘌呤,而CH2-THF通过一碳单位转移到细胞质,产生嘌呤和胸腺嘧啶[13,21]。谷胱甘肽能维持氧化还原稳态,提示SHMT2影响氨基酸代谢后,进一步影响体内氧化还原稳态和核苷酸合成。
3.2 SHMT2能够影响线粒体呼吸链
SHMT2与氧化还原状态之间的关系和线粒体呼吸链有关[22-23]。研究表明SHMT2敲除可以下调线粒体呼吸链相关复合物,包括复合物I和复合物IV;相比之下,SHMT2的过度表达具有相反的效果[24]。证实SHMT2的表达对线粒体呼吸链的正常功能是有益的。事实上,抑制SHMT2导致的复合物下调是翻译而非转录调控的结果,当复合物I被翻译时,线粒体核糖体倾向于留在密码子AAG和UUG上[25]。此外,SHMT2敲除基本上消除了复合物I单体、复合物III二聚体和复合物IV超复合物的表达;相比之下,复合物III和复合物V单体的含量没有受到影响[26]。SHMT2的敲除选择性地阻碍了293A细胞中复合物I和复合物III二聚体和复合物IV超复合物的组装[26]。基于以上内容,我们推测SHMT2的缺失抑制了复合物I的表达,并对复合物III/IV/V的组装有抑制作用,但影响复合物III/IV/V组装的具体机制有待进一步研究。
3.3 调控机制
一些研究已经描述了SHMT2表达的潜在调控机制,其中包括大量已知的信号通路和相关转录因子(图3)[27-30]。mTOR是哺乳动物中的一种丝氨酸/苏氨酸激酶,对调节核苷酸、脂类和蛋白质的合成至关重要。mTORC1的激活可抑制糖原合成酶激酶3(glycogen synthase kinase-3,GSK-3)介导的转录因子叉头/翼螺旋族k1(transcription factor forkhead/winged helix family k1,FOXK1)磷酸化,并促进代谢重编程,同时还上调了SHMT2的表达[27]。JAK/STAT信号通路是多种细胞因子信号转导的共同途径,广泛参与细胞增殖、分化、凋亡和炎症等过程。在LNCaP细胞中,白细胞介素6(interleukin-6,IL-6)激活JAK2/STAT3后,活化的STATs在细胞核内迅速积累,并与SHMT2启动子结合,上调SHMT2的线粒体表达[30]。SHMT2可维持氧化还原稳态,通过减少氧化磷酸化过程中的糖酵解和催化细胞代谢生成生物合成前体[28]。此外,其他调控SHMT2表达的途径已经被证实。核因子E2相关因子2(nuclear factor E2-related factor 2,NRF2)是氧化应激的主要传感器,通过激活激活转录因子4(activating transcription factor 4,ATF4)促进SHMT2的表达,以维持正常的氧化还原稳态[29]。最近对内质网应激的研究表明,EIF2AK3/EIF2AK4也可以上调SHMT2的表达[28]。鉴于SHMT2的异常表达与多种癌症相关因素有关,包括氧化还原稳态和代谢重编程,靶向SHMT2治疗癌症是一个很好的前瞻性策略。
3.4 抑制剂的开发
根据SHMT2的表达模式及其在各种癌症中敲除后产生的效应,开发其选择性抑制剂对癌症治疗具有一定的前景。NSC127755是第一个SHMT抑制剂,但由于不良反应,其开发受到限制[31]。Leukopsin也被证明能抑制两种SHMT亚型,因其在体内容易转化为其他叶酸类似物而并未应用于临床[32]。2015年,Marani等[33]发现化合物2.12(图3a)是一种植物源性SHMT抑制剂(专利申请WO2013182472A1),可以通过凋亡诱导肺癌细胞死亡。2017年,Ducker等[20]基于植物源性抑制剂优化了SHIN1(图3b),体外实验显示SHIN1对SHMT的活性增强(SHMT1:IC50=5 nM,SHMT2:IC50=13 nM),且可以抑制HCT116的增殖。然而,由于其清除迅速,无法进行进一步的体内研究。对SHIN1进一步优化得到SHIN2(图3c)(IC50=318 nM),可抑制人T细胞ALL(T-ALL)细胞系的增殖,并在NOTCH1驱动的小鼠模型和异种移植模型中均具有体内抗白血病作用[34]。此外,Han等[35]通过虚拟筛选验证了吡唑啉结构(图3d、e、f)可用作SHMT2抑制剂。Dekhne等[36]报告了关于吡咯并吡啶叶酸类似物的研究。其中,AGF347(图3g)在体外对羟甲基转移酶1/2(serine hydroxymethyltransferase 1/2, SHMT1/2)有抑制作用,对肺癌、结肠癌和胰腺癌有广谱抗肿瘤作用[36]。最近的研究揭示了抗叶酸药物的结构基础,通过洛美曲索(lometrexol,LTX)(图3h)和培美曲塞(pemetrexed,PTX)(图3i)与SHMT2共结晶,证实LTX和PTX是该酶的抑制剂,体外对SHMT2的抑制活性分别为49.7%±4.7%和79.2%±6.8%[37]。因此,LTX也可以被认为是开发有效SHMT2抑制剂的良好起点。
4 MTHFD2
MTHFD2在胚胎和转化细胞的线粒体中均有表达[38-41]。在叶酸途径中,MTHFD2催化两个连续的步骤:CH2-THF脱氢和NADH/NAD+介导的CHO-THF生成,产物可以提供甲酸盐充当一碳单位[42]。大量研究表明,MTHFD2在许多类型的快速增殖肿瘤(如乳腺癌和结肠直肠癌)中显著上调,提示其高表达与低生存率之间存在相关性[9,12,16,43]。此外,MTHFD2在大多数健康成人组织中均未发现表达,所有组织中均有MTHFD2 mRNA的低表达,但未发现MTHFD2 mRNA的翻译[44]。MTHFD2在细胞核中调节DNA复制位点共定位,参与RNA合成的核蛋白相互作用及转录后修饰[45-46]。
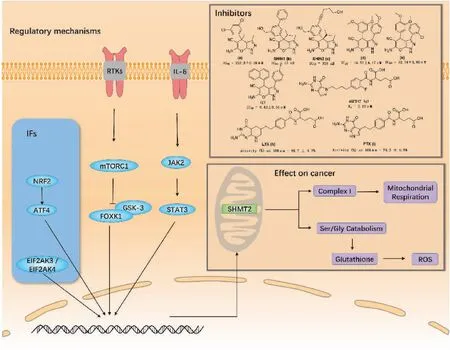
图3 SHMT2的调控机制和相关抑制剂
4.1 MTHFD2影响嘌呤的合成
最近研究报道了MTHFD2如何影响癌症,包括嘌呤和NADPH的合成[12,47]。mTORC1可通过激活ATF4诱导MTHFD2在乳腺癌细胞中的表达[47]。进一步的实验表明,MTHFD2可以影响对嘌呤从头合成至关重要的甲酸盐的生产[47]。此外,MTHFD2基因敲除导致了嘌呤合成的重要中间体4-氨基胺-卡巴酰胺核糖核苷酸(aminoimidazole-4-carboxamide ribonucleoside, AICAR)的显著堆积[48]。MYCN通过MTHFD2提供的一碳单位来增强嘌呤合成,进一步调节癌症进展[49]。敲除MTHFD2后,可降低细胞增殖、集落形成、迁移能力和DNA合成,提示MTHFD2可以影响增殖细胞中嘌呤的合成[50]。
4.2 MTHFD2影响氧化还原稳态
MTHFD2是一种NAD(P)依赖的酶,在一定条件下能维持氧化还原的稳态[12,40]。MTHFD2抑制剂LY345899可以通过降低NADPH的产生来调节结直肠癌的氧化还原稳态[12]。此外,抑制MTHFD2可以降低NADPH/NADP+和GSH/GSSG比值[17,51-53],可以抑制肿瘤的增殖和转移[12,54-55]。相关机制研究表明,c-Myc通过KRAS激活的AKT和ERK途径转录上调MTHFD2的表达[12]。因此,MTHFD2被认为在氧化还原稳态中具有重要作用,并具有靶向肿瘤治疗的潜力。
4.3 调控机制
MTHFD2表达的潜在调控机制已相继被报道(图4)。与SHMT2类似,MTHFD2受mTOR通路的影响。在KRAS相关和细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)途径中也发现MTHFD2受到其调控。在非小细胞肺癌中,KRAS的诱导可激活AKT和ERK1/2通路,并通过c-Myc识别并结合MTHFD2启动子上调MTHFD2的表达[12]。此外,一些转录因子也被报道影响MTHFD2的调控。性别决定区域Y‐相关高迁移率组框7(sex-determining region Y‐related high mobility group box 7, SOX7)作为一种肿瘤抑制因子,能与MTHFD2启动子结合,抑制MTHFD2的表达,有利于SOX7介导的肿瘤抑制[56]。在Ewing肉瘤(Ewing sarcoma, EWS)中,嵌合转录因子EWS-FLI1是主要的致癌驱动因子,正调控MTHFD2和MTHFD1L的表达,并影响细胞氧化还原状态[57]。考虑到MTHFD2在多种癌症中的异常表达,靶向MTHFD2治疗癌症是一个很好的前瞻性策略。
4.4 抑制剂的开发
MTHFD2在多种癌症中存在广泛的表达,显示出癌症治疗的潜力[12,16]。目前已有MTHFD2晶体结构的报道[43]并发现4种MTHFD2抑制剂。Ly345889(图4j)是首次报道的MTHFD2合成抑制剂[42],但LY345889对MTHFD2缺乏足够的选择性,MTHFD1和MTHFD2的IC50值分别为96 nM和663 nM[42]。在天然产物中发现的carolacton(图4k)抑制腺癌细胞和人口腔表皮癌细胞的生长,当U-937细胞在去叶酸培养基中生长时,EC50为42 mM,最大抑制率为70%[58]。最近,DS44960156(图4l)被报道对MTHFD2具有良好的选择性(MTHFD2 IC50=1.6 mM;MTHFD1 IC50>30 mM)。在进一步优化后,获得了DS18561882(图4m),对MTHFD2的IC50值为6.3 nM[59]。在小鼠异种移植模型中,口服DS18561882显著抑制肿瘤增殖[59]。DS18561882被认为是一种很有前途的MTHFD2抑制剂,用于乳腺癌的临床治疗,但其在其他类型癌症中的生物学功能亟待研究。
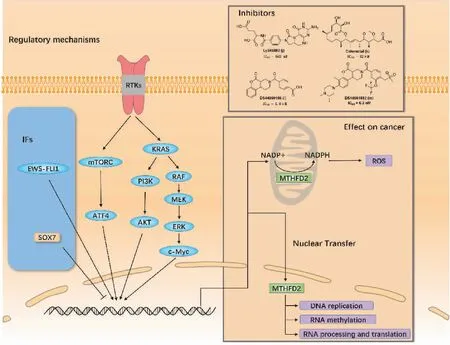
图4 MTHFD2的调控机制和相关抑制剂
5 其他潜在的靶点
5.1 ALDH1L2
ALDH1L2也是线粒体中提供NADPH还原的关键酶[17]。研究表明,ALDH1L2产生的NADPH能降低黑色素瘤细胞的氧化应激,促进肿瘤转移。在NSG小鼠中,敲除ALDH1L2可抑制远处转移,而使用抗氧化剂可促进远处转移[54]。与正常组织相比,人类结直肠肿瘤组织中ALDH1L2的表达上调[19]。此外,编码一碳代谢酶基因的表达与结直肠癌和肺腺癌患者的生存率相关,与线粒体SHMT2、MTHFD2和ALDH1L2低表达的患者相比,高表达的患者总生存率较低。
5.2 SHMT1
SHMT1是SHMT2在细胞质的同工酶形式[60]。SHMT1的功能似乎与dTMP和维生素B6的合成有关[61]。SHMT1阻止dUMP整合到双链DNA上,防止它破坏DNA双链的稳定性[62]。Neu5Ac是氨基糖和核苷酸代谢的中间产物,能促进促癌细胞因子IL-6和IL-8的表达。有研究表明,SHMT1的下调通过影响Neu5Ac水平,进而阻止卵巢癌的生长和迁移[63]。SHMT1也可以通过抑制尼克酰胺腺嘌呤二核苷酸磷酸氧化酶1(recombinant nicotinamide adenine dinucleotide phosphate oxidase 1, NOX1)介导的活性氧产生来抑制肝癌的转移[64]。此外,一种能优先靶向SHMT1的吡喃衍生物也能诱导肺癌细胞凋亡[33]。
6 结语与展望
本文综述了叶酸代谢中的关键酶SHMT2和MTHFD2在肿瘤异常生长中的多因素作用。叶酸代谢的关键酶MTHFD2和SHMT2的表达具有一定的特异性,在多种肿瘤细胞中均有显著的高表达(如乳腺癌、膀胱癌),这无疑是在叶酸代谢与癌症之间架起了一座新的桥梁。目前的研究已经表明SHMT2和MTHFD2可以影响癌中重要的氨基酸代谢,嘌呤合成以及氧化还原稳态,相关小分子抑制剂也在体内实验中表现出一定的治疗效果,提示靶向调控SHMT2和MTHFD2在癌症治疗中的巨大潜力。在未来,针对肿瘤细胞中异常高表达的叶酸代谢酶或许是一个主流方向。

