海洋放线菌S187产抗补体活性物质的发酵工艺优化
徐小娜,牛海青,王晓霞,田 晴,高 茜,苏 春
(1.咸阳职业技术学院医药化工学院,陕西 咸阳 712000;2.陕西师范大学生命科学学院,陕西 西安 710119)
海洋占地球表面积的70%,拥有非常丰富的微生物资源[1]。高压、低温、氧气和盐含量分布不均匀、营养匮乏、环境复杂等特殊性造就了海洋放线菌独特复杂的代谢途径,使得海洋放线菌代谢产物结构新颖、复杂多样和生物活性较高[2]。人们从19世纪20年代开始对海洋放线菌代谢产物进行研究,大多集中在抗肿瘤、抗病毒和抗菌等方面,对抗补体活性方面的研究非常少。
补体系统是由30多种膜结合性蛋白、补体受体和可溶性蛋白组成的多分子系统,是存在于正常动物和人组织液及血清中的一组经活化后具有酶活性的蛋白质。补体系统的主要组分为C1~C9化合物,激活途径主要有3种:经典途径(classical pathway,CP)、旁路途径(alternative pathway,AP)和凝集素途径(lectin pathway,LP)[3]。但是,补体异常激活会引起许多疾病,如阿尔兹海默症、风湿性关节炎等,其过度激活也会对红细胞、血管、肾脏和关节等组织造成实质性损伤[4]。所以,抗补体活性药物的研发引起了人们的广泛关注。目前,临床上普遍使用甲胺蝶呤、糖皮质激素、环磷酰胺等免疫抑制剂治疗某些与补体异常激活相关的疾病,但这些抑制剂并非专一的补体抑制剂,选择性较差,长期使用会造成机体的防御机能降低,从而造成抗感染能力下降,容易使潜在病灶扩散和继发感染,并产生多种副作用和并发症[5]。所以,临床医学上急需具有高效、低毒和专一等特性的补体抑制剂。
作者以抗补体活性为评价指标,在单因素实验的基础上,采用正交实验优化海洋放线菌S187产抗补体活性物质的发酵工艺,拟为海洋放线菌S187抗补体活性物质的开发研究奠定基础。
1 实验
1.1 菌株与培养基
海洋放线菌S187,采自大连星海湾海底沉积物,保存于-80 ℃冰箱。
TSB培养基(M1)(g·L-1):胰蛋白胨 17,大豆蛋白胨 3,葡萄糖 5,NaCl 5,K2HPO42.5,自然pH值。
二号培养基(M2)(g·L-1):葡萄糖 10,可溶性淀粉 20,牛肉膏 3,蛋白胨 5,酵母提取物 5,(NH4)2SO45,CaCO34,pH值7.5。
ISP4培养基(M3)(g·L-1):可溶性淀粉 10,(NH4)2SO42,K2HPO41,NaCl 1,蛋白胨 1,酵母粉 0.5,CaCO32,微量元素 100 μL,pH值7.2~7.5。
ISP2培养基(M4)(g·L-1):酵母提取物 4,麦芽提取物 10,葡萄糖 4,pH值7.2~7.5。
AM2ab 培养基(M5)(g·L-1):大豆粉 5,酵母粉 5,可溶性淀粉 20,蛋白胨 2,CaCO32,pH值7.2~7.5。
RA培养基(M6)(g·L-1):麦芽提取物10,葡萄糖 10,玉米粉 5,可溶性淀粉 20,麦芽糖 10,微量元素 100 μL,pH值7.2~7.5。
豆粉培养基(M7)(g·L-1):可溶性淀粉 20,大豆粉 25,(NH4)2SO42,NaCl 2,K2HPO40.5,CaCO35,pH 值7.2。
A1培养基(M8)(g·L-1):可溶性淀粉 10,酵母粉 4,蛋白胨 2,人造海盐 28(可用75%的海水代替人造海盐),自然pH值。
九号培养基(M9)(g·L-1):玉米粉 30,大豆粉 7,KNO31.5,K2HPO40.5,pH值7.5。
大豆粉先煮沸,用8层纱布过滤后再加入到培养基中;微量元素(mg·L-1):ZnCl2800,FeCl3·6H2O 4 000,CuCl2·2H2O 200,MnCl2·4H2O 200,NaB4O7·10H2O 200;配制固体培养基均加入2%琼脂;所有培养基均用灭菌锅121 ℃灭菌20 min。
1.2 方法
1.2.1 菌种活化及种子液的制备
菌种活化:取保存于-80 ℃冰箱中的菌悬液1 mL,涂布于M9固体培养基平板上,于28 ℃培养4~8 d。
种子液的制备:用接种环从平板上刮取1 cm2活化的菌株S187孢子,接种于装有50 mL M1液体培养基的250 mL三角瓶中,于28 ℃、220 r·min-1培养2 d。
1.2.2 样品制备
种子液经离心后,得到上清液和菌丝体;用乙酸乙酯反复萃取上清液3次;用甲醇-丙酮(体积比1∶1)过夜破壁浸提菌丝体,减压蒸馏得到菌丝体水溶液,再用等体积的乙酸乙酯反复萃取3次;将上述两个乙酸乙酯萃取液合并,浓缩得到浸膏;再用5% 二甲基亚砜溶液超声溶解、稀释,得到浓度为0.06 mg·mL-1的菌株S187代谢产物的粗提物。
1.2.3 菌株S187代谢产物的抗补体活性测定
(1)5倍巴比妥缓冲液(5×BBS):取2.875 g巴比妥钠溶于250 mL热水中,加入42.5 g NaCl、0.84 g MgCl2·6H2O、0.14 g CaCl2、1.0 g巴比妥,再加入三蒸水至1 000 mL,即得。实验时将5×BBS缓冲液直接稀释成1×BBS缓冲液。
(2)2%绵羊红细胞(2%SRBC):取2 mL绵羊血,用1×BBS缓冲液洗涤后,3 000 r·min-1离心5 min,重复洗涤3次,再补加1×BBS缓冲液至2 mL,混匀;取约0.5 mL于红细胞的压积管中,3 000 r·min-1离心10 min,测定绵羊红细胞的体积百分比,加入适量1×BBS缓冲液配制成2%SRBC。
(3)溶血素(效价1∶4 000):实验时用1×BBS缓冲液将效价1∶4 000的溶血素稀释成1∶1 000。
采用经典途径溶血法[6-7]测定菌株S187代谢产物的抗补体活性:将样品与补体混合均匀,置于37 ℃水浴锅中水浴10 min;按表1加入1×BBS缓冲液、溶血素和2%SRBC,于37 ℃水浴30 min后,放在冰上冷却;于4 ℃、5 000 r·min-1离心10 min,取上清液0.2 mL于96孔板中,用酶标仪测定OD405值。同时设置样品对照组、补体组和全溶血组。将样品组的OD405值扣除相应样品对照组的OD405值后计算溶血抑制率(抑制率越高,抗补体活性越高)。按下式计算抗补体活性:
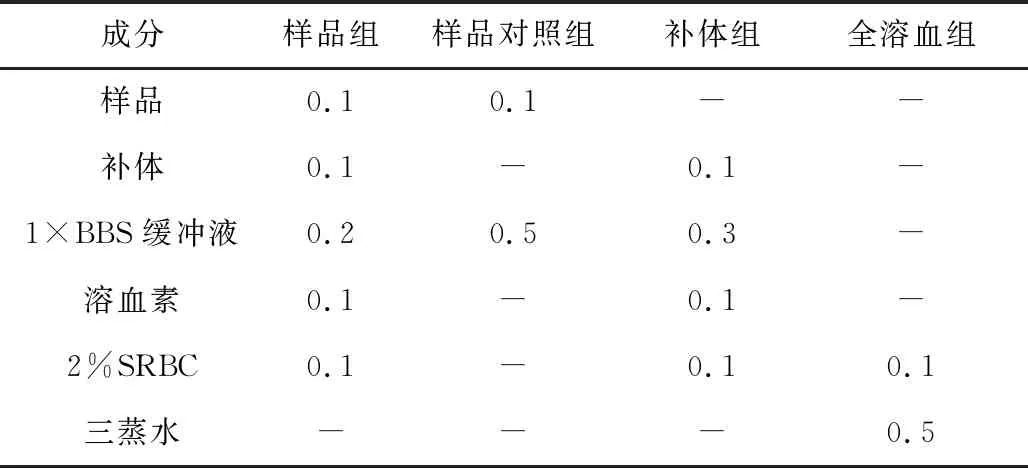
表1 经典途径溶血法测定抗补体活性实验中各处理组成分/mL

1.2.4 发酵工艺优化
以抗补体活性为评价指标,先分别考察碳源、氮源、发酵时间、初始pH值对菌株S187代谢产物抗补体活性的影响;然后在单因素实验的基础上,选取碳源含量、氮源含量、发酵时间、初始pH值为考察因素,采用L9(34)正交实验优化菌株S187产抗补体活性物质的发酵工艺,利用SAS软件分析数据。
2 结果与讨论
2.1 基础培养基的筛选
取3 mL种子液分别接种于M1、M2、M3、M4、M5、M6、M7、M8等8种液体培养基中,于28 ℃、220 r·min-1培养6 d,测定菌株S187代谢产物的抗补体活性,结果如图1所示。
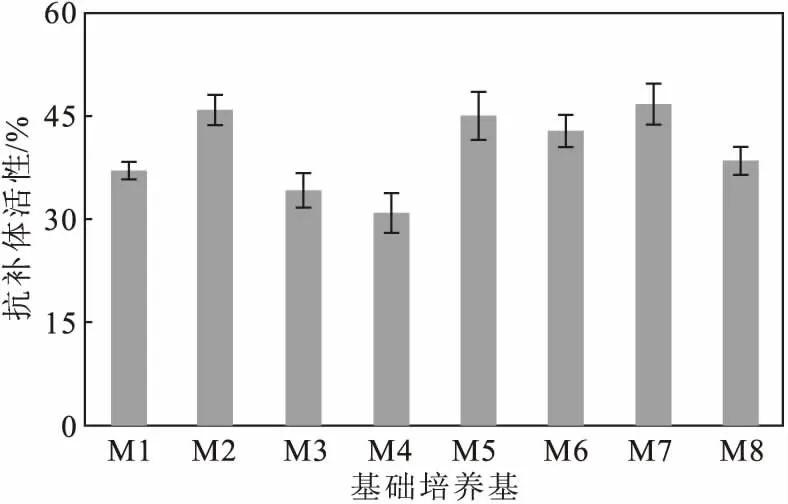
图1 菌株S187在不同培养基中代谢产物的抗补体活性
从图1可以看出,菌株S187在M7培养基中培养时,代谢产物的抗补体活性最高。因此,选择M7培养基作为基础培养基进行发酵工艺优化。
2.2 单因素实验结果
2.2.1 碳源对抗补体活性的影响
在基础培养基其它成分不变的条件下,分别以葡萄糖、麦芽糖、蔗糖和乳糖等量替换基础培养基中的可溶性淀粉,测定菌株S187代谢产物的抗补体活性,考察碳源对抗补体活性的影响,结果如图2所示。

图2 碳源对抗补体活性的影响
从图2可以看出,以可溶性淀粉为碳源时,菌株S187代谢产物的抗补体活性最高,其次是葡萄糖、蔗糖和麦芽糖;以乳糖为碳源时的抗补体活性最低。因此,确定最佳碳源为可溶性淀粉。
2.2.2 氮源对抗补体活性的影响
在基础培养基其它成分不变的条件下,分别以花生粉、蛋白胨、玉米粉和牛肉粉等量替换基础培养基中的大豆粉,测定菌株S187代谢产物的抗补体活性,考察氮源对抗补体活性的影响,结果如图3所示。

图3 氮源对抗补体活性的影响
从图3可以看出,以大豆粉为氮源时,菌株S187代谢产物的抗补体活性最高,其次是玉米粉、花生粉和牛肉粉;以蛋白胨为氮源时的抗补体活性最低。因此,确定最佳氮源为大豆粉。
2.2.3 发酵时间对抗补体活性的影响
将种子液按6%的接种量接种于基础培养基中,于28 ℃、220 r·min-1下分别发酵3 d、4 d、5 d、6 d、7 d,测定菌株S187代谢产物的抗补体活性,考察发酵时间对抗补体活性的影响,结果如图4所示。
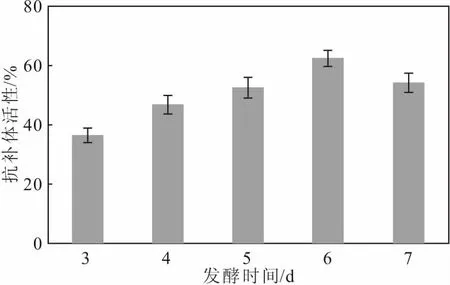
图4 发酵时间对抗补体活性的影响
从图4可以看出,发酵时间对菌株S187代谢产物的抗补体活性影响较大;随着发酵时间的延长,抗补体活性呈先升高后降低的趋势,在发酵第6 d时,抗补体活性达到最高。这是因为,随着发酵时间的延长,抗补体活性物质的产量逐渐增多,抗补体活性相应逐渐升高;但发酵时间过长,抗补体活性物质逐渐被消耗,抗补体活性反而会降低。因此,发酵时间以6 d为宜。
2.2.4 初始pH值对抗补体活性的影响
将基础培养基初始 pH值分别调至4.0、5.0、6.0、7.0、8.0,将种子液按6%的接种量接种于基础培养基中,28 ℃、220 r·min-1下发酵6 d,测定菌株S187代谢产物的抗补体活性,考察初始pH值对抗补体活性的影响,结果如图5所示。

图5 初始pH值对抗补体活性的影响
从图5可以看出,当基础培养基初始pH值为7.0时,菌株S187代谢产物的抗补体活性最高,进一步证明,在发酵过程中,只有在合适的环境下,菌株才能正常生长并产生代谢产物;当初始pH值低于7.0或者高于7.0时,代谢产物的抗补体活性均有不同程度的降低。因此,基础培养基初始pH值以7.0为宜。
2.3 正交实验结果与方差分析
在单因素实验的基础上,选取可溶性淀粉含量(A)、大豆粉含量(B)、发酵时间(C)、初始pH值(D)为考察因素,采用L9(34)正交实验优化菌株S187产抗补体活性物质的发酵工艺。正交实验的结果与分析见表2,方差分析见表3。
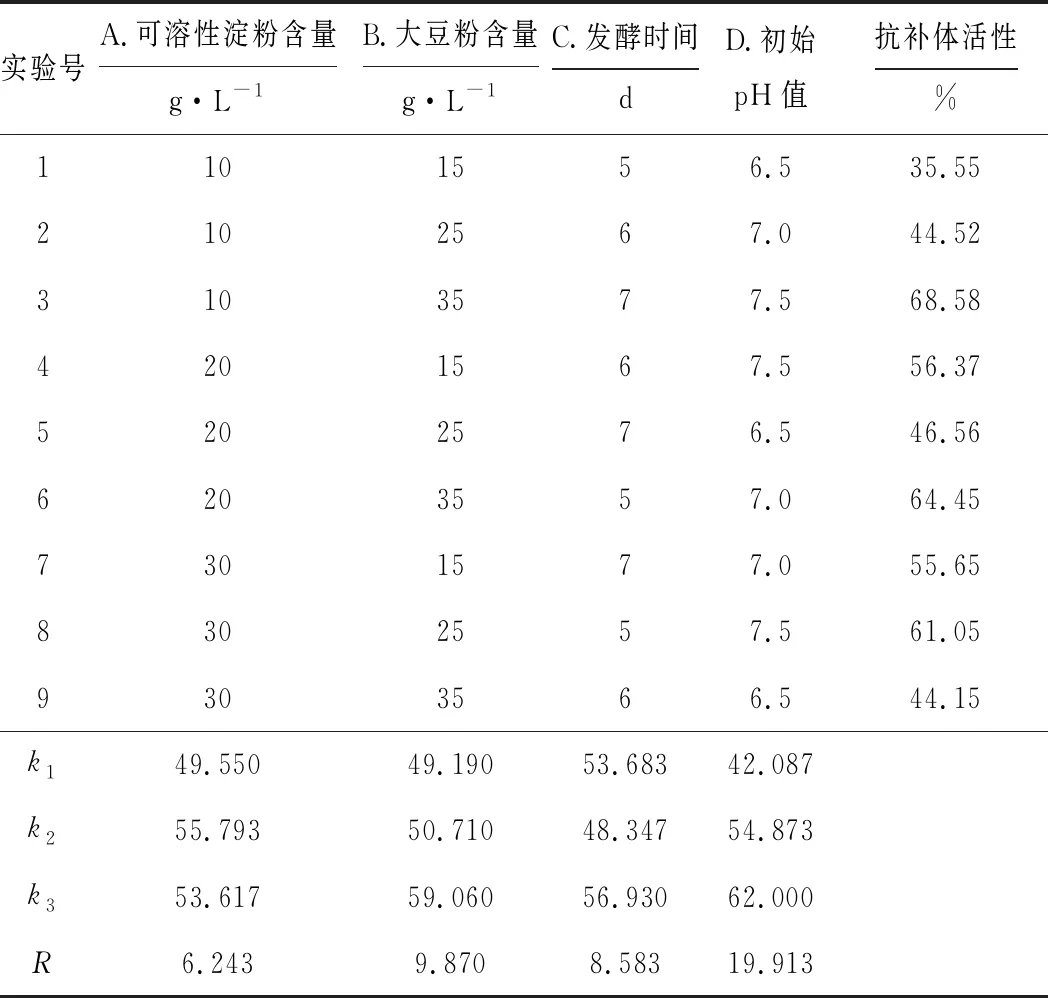
表2 正交实验的结果与分析
从表2、3可以看出,各因素对抗补体活性影响的大小顺序依次为D>B>C>A;因素B和D有显著性差异,因素A和C没有显著性差异。结合极差分析,最终确定最佳发酵工艺为A2B3C3D3,即可溶性淀粉20 g·L-1、大豆粉35 g·L-1、发酵时间7 d、初始pH值7.5。
2.4 工艺验证
分别称取20 g·L-1可溶性淀粉、35 g·L-1大豆粉,基础培养基其余成分不变,调节初始pH值为7.5,发酵7 d,进行3次重复实验。测得菌株S187代谢产物的抗补体活性分别为69.35%、69.38%、69.33%,平均抗补体活性为69.35%。表明该工艺稳定可靠。
3 结论
采用单因素实验和正交实验优化了海洋放线菌S187产抗补体活性物质的发酵工艺。确定最佳发酵工艺为:可溶性淀粉20 g·L-1,大豆粉35 g·L-1,(NH4)2SO42 g·L-1,NaCl 2 g·L-1,K2HPO40.5 g·L-1,CaCO35 g·L-1,初始pH值7.5,于28 ℃、220 r·min-1下发酵7 d。在此条件下,海洋放线菌S187代谢产物的抗补体活性为69.35%。为海洋放线菌S187代谢产物的抗补体活性的进一步研究奠定了基础。

