云南喙尾琵琶甲幼虫提取物抗氧化活性的初步研究
杨建云,倪 俊,高玉婷,杨 旭2,,佘 容2,*,肖 文2,,4,5
(1.大理大学药学院,云南 大理 671003;2.大理大学 天然抗氧化剂与抗氧化炎症研究院,云南 大理 671003;3.大理大学 东喜玛拉雅研究院,云南 大理 671003;4.中国三江并流区域生物多样性协同创新中心,云南 大理 671003;5.大理大学 三江并流区域生物多样性保护与利用云南省创新团队,云南 大理 671003)
昆虫种类繁多,数量庞大,昆虫资源是目前地球上最大的尚未被充分利用的自然资源[1-2]。喙尾琵琶甲(BlapsrynchopeteraFairmaire)属于鞘翅目(Coleoptera)、拟步甲科(Tenebrionidae)、琵琶甲属(Blapsfabiricus),在我国西南地区云南、四川、贵州和广西等省均有分布,其中以云南省分布较为集中,又称为“云南琵琶甲”,是云南彝族和白族民间广泛使用的一种药用昆虫[3]。喙尾琵琶甲成虫繁殖能力强,日均产卵量为5.3粒,寿命超过18个月,终生产卵量在600粒以上[3]。喙尾琵琶甲是一种重要的可再生资源,其药用价值及营养价值都较高,含有16种游离氨基酸和16种蛋白氨基酸,其中8种是人体必需氨基酸[4-5]。喙尾琵琶甲成虫提取物具有抑菌、抗肿瘤活性,喙尾琵琶甲幼虫乙酸乙酯提取物对金黄色葡萄球菌和藤黄微球菌具有抑菌活性[6-9]。
生物机体在有氧代谢过程中,活性氧的产生和清除处于动态平衡状态。若打破抗氧化防御机制间的平衡,就会产生氧化应激;过度的应激反应会引起机体应激损伤,导致相关疾病的发生[10-11]。昆虫的生理结构特殊,气管系统所输送的氧经扩散作用直抵组织,从而增加正常情况下机体的氧化胁迫,昆虫也由此发展了一套高效的抗氧化系统[12-13]。崔文博等[14]研究发现,喙尾琵琶甲成虫的氯仿和乙酸乙酯提取物具有较高的抗氧化活性;何钊等[15]研究了5种昆虫多糖的抗氧化活性,发现喙尾琵琶甲多糖对DPPH自由基的清除效果较明显;马娇等[16]研究发现,7种云南可食用昆虫的醇提物均对ABTS自由基具有不同程度的清除作用;另外,黄粉虫黄酮提取物[17]、白蜡虫多糖提取物[18]、黑水虻幼虫蛋白质[19]、碧伟蜓稚虫的胃蛋白酶解液[20]以及金银花尺蠖蛹粗多糖[21]等都具有体外抗氧化活性。
喙尾琵琶甲的幼虫和蛹可以增加喙尾琵琶甲的食用性。但由于喙尾琵琶甲幼虫饲养难度大、发育历期长,目前关于喙尾琵琶甲幼虫及蛹的应用价值的研究报道较少,涉及抗氧化活性的报道更少。为此,作者以喙尾琵琶甲幼虫为研究对象,通过DPPH法、ABTS法、FRAP法评价喙尾琵琶甲幼虫提取物的体外抗氧化活性,为云南药食两用昆虫资源的合理开发利用提供科学依据。
1 实验
1.1 材料
于大理大学内野外环境中采集喙尾琵琶甲成虫,室内交配产卵后,收集卵,孵化,在人工饲养室内饲养至高龄幼虫,收集体长29.25~30.85 mm、头宽2.81~3.08 mm的鲜活虫体(图1),冷冻干燥,备用。

图1 喙尾琵琶甲幼虫
1.2 试剂与仪器
DPPH(1,1-二苯基-2-三硝基苯肼),梯希爱(上海)化成工业发展有限公司;ABTS[2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐]、2,4,6-三吡啶基三嗪(TPTZ),上海麦克林生化科技有限公司;抗坏血酸(VC),国药集团化学试剂有限公司;正己烷、乙酸乙酯,天津风船化学试剂科技有限公司;甲醇,太仓沪试试剂有限公司;氯仿,利安隆博华医药化学有限公司。
SCIENTZ-10N型冷冻干燥机,宁波新芝生物科技股份有限公司;RE-2000A型旋转蒸发器,上海亚荣生化仪器厂;LG10-2.4A型高速离心机,北京医用离心机厂;722N型可见分光光度计,上海菁华科技仪器有限公司;PX224ZH型电子天平,奥豪斯仪器有限公司。
1.3 方法
1.3.1 抗氧化活性成分的提取
称取鲜活喙尾琵琶甲幼虫200 g,冷冻干燥得到干虫体83 g,用研钵将虫体研碎,放入250 mL锥形瓶中。首先用250 mL正己烷浸提2次,每次超声5 min;再用250 mL乙酸乙酯浸提2次,将提取后虫体残渣中的溶剂挥发,干燥;最后用600 mL甲醇浸提3次,每次超声10 min,浸泡30 min,合并甲醇提取液,旋转蒸发,得到甲醇膏状粗提物4.2 g。
1.3.2 抗氧化活性的测定
1.3.2.1 DPPH法
DPPH法是体外评价抗氧化剂抗氧化活性的一种快速、简便、灵敏可行的方法。其原理为:DPPH自由基是一种稳定的自由基,其醇溶液呈深紫色,能够接受一个电子或是氧离子,在517 nm 处有吸收峰;而具有自由基清除能力的抗氧化剂可以和DPPH自由基的单电子配对,使得517 nm处的吸收峰强度减弱,据此可通过吸光度的变化来检测DPPH自由基的清除情况。
DPPH自由基溶液的配制:称取DPPH自由基粉末1 g,用无水乙醇溶解,转入1 L棕色容量瓶中,用无水乙醇定容,摇匀,得1 000 mg·L-1的DPPH自由基储备液,置于冰箱中冷藏,备用。
DPPH自由基标准曲线的绘制:吸取DPPH自由基储备液1 mL,加入无水乙醇19 mL,配制50 mg·L-1的DPPH自由基工作液;用无水乙醇将工作液稀释成梯度浓度40 mg·L-1、25 mg·L-1、12.5 mg·L-1、6.25 mg·L-1,测定各浓度溶液在517 nm处吸光度;以DPPH自由基浓度为横坐标、517 nm处吸光度为纵坐标绘制标准曲线。
DPPH自由基清除率的测定:准确称取喙尾琵琶甲幼虫甲醇粗提物0.12 g,用15 mL甲醇溶解,4 000 r·min-1离心5 min,得到8 mg·mL-1粗提物母液;将粗提物母液稀释成浓度(mg·mL-1)分别为6、4、3、2、1、0.5、0.25、0.125的待测溶液;吸取2 mL待测溶液,加入2 mL DPPH自由基工作液,混匀,30 ℃暗室放置30 min,测定517 nm处吸光度,按式(1)计算DPPH自由基清除率。以等浓度VC为对照,同时设置试剂空白和样品空白[22-23]。
(1)
式中:Ai为待测溶液+DPPH自由基溶液的吸光度;Aj为待测溶液+甲醇的吸光度;A0为甲醇+DPPH自由基溶液的吸光度。
清除DPPH自由基能力IC50值的测定:根据DPPH自由基清除率,通过SPSS软件计算喙尾琵琶甲幼虫甲醇粗提物对DPPH自由基清除能力的IC50值。
1.3.2.2 ABTS法
ABTS法[24]测定抗氧化活性原理:ABTS与K2S2O8反应可以生成绿色的ABTS自由基,该自由基在734 nm处有最大吸收峰;当具有自由基清除能力的抗氧化剂加入到ABTS自由基溶液后,会使734 nm处的吸收峰强度减弱,据此可通过吸光度的变化来检测ABTS自由基的清除情况。
ABTS自由基工作液的配制:用蒸馏水分别配制7 mmol·L-1ABTS自由基溶液、2.45 mmol·L-1K2S2O8溶液;将两种溶液按体积比1∶1混合,4 ℃避光静置15 h,得到ABTS自由基母液;将ABTS自由基母液用无水乙醇稀释成734 nm处吸光度为0.70±0.02的工作液。
ABTS自由基清除率的测定:准确称取喙尾琵琶甲幼虫甲醇粗提物0.12 g,用15 mL甲醇溶解,4 000 r·min-1离心5 min,得到8 mg·mL-1粗提物母液;将粗提物母液稀释成浓度(mg·mL-1)分别为6、4、3、2、1、0.5、0.25、0.125、0.062 5、0.031 25的待测溶液;吸取1 mL待测溶液,加入3 mL ABTS自由基工作液,混匀,25 ℃反应30 min,测定734 nm处吸光度[25],按式(2)计算ABTS自由基清除率。
(2)
式中:Ai为待测溶液+ABTS自由基溶液的吸光度;Aj为待测溶液+甲醇的吸光度;A0为甲醇+ABTS自由基溶液的吸光度。
清除ABTS自由基能力IC50值的测定:根据ABTS自由基清除率,通过SPSS软件计算喙尾琵琶甲幼虫甲醇粗提物对ABTS自由基清除能力的IC50值。
1.3.2.3 FRAP法
FRAP法测定抗氧化活性原理:在酸性条件下,Fe3+-TPTZ可被抗氧化剂还原成Fe2+-TPTZ蓝色络合物,该络合物在593 nm处有最大吸收峰,可用来反映抗氧化剂的总抗氧化活性。
FRAP工作液的配制:将pH值为3.6的醋酸盐缓冲液、10 mmol·L-1TPTZ溶液、20 mmol·L-1FeCl3溶液按体积比10∶1∶1混合,即得。
FeSO4·7H2O标准曲线的绘制:取2 mmol·L-1、1 mmol·L-1、0.5 mmol·L-1、0.25 mmol·L-1、0.125 mmol·L-1、0.062 5 mmol·L-1的FeSO4·7H2O溶液各0.15 mL,加入3.6 mL FRAP工作液,混匀,于37 ℃反应30 min,测定各浓度溶液在593 nm处吸光度;以FeSO4·7H2O溶液浓度为横坐标、593 nm处吸光度为纵坐标绘制标准曲线。
FRAP值的测定:准确称取喙尾琵琶甲幼虫甲醇粗提物0.12 g,用15 mL甲醇溶解,4 000 r·min-1离心5 min,得到8 mg·mL-1粗提物母液;将粗提物母液稀释成浓度(mg·mL-1)分别为6、4、2、1、0.5的待测溶液;吸取0.15 mL待测溶液,加入3.6 mL FRAP工作液,混匀,37 ℃反应30 min,测定593 nm处吸光度。以FRAP值表征总抗氧化活性,以1 mmol·L-1FeSO4·7H2O为标准,总抗氧化活性以达到同样吸光度时为一个FRAP值[24-25]。
2 结果与讨论
2.1 DPPH法测定喙尾琵琶甲幼虫甲醇粗提物抗氧化活性结果
从DPPH自由基标准曲线(图2)可以看出:DPPH自由基溶液浓度在6.25~50 mg·mL-1范围内,与517 nm处吸光度线性关系良好,线性方程为y=0.0226x+0.0162,R2=0.9994。

图2 DPPH自由基标准曲线
喙尾琵琶甲幼虫甲醇粗提物对DPPH自由基的清除率如图3所示。

图3 喙尾琵琶甲幼虫甲醇粗提物对DPPH自由基的清除率
从图3可以看出,喙尾琵琶甲幼虫甲醇粗提物具有清除DPPH自由基的能力。粗提物对DPPH自由基的清除率随着浓度的增加逐渐升高,当粗提物浓度增至3 mg·mL-1时,DPPH自由基清除率升至(92.53±2.26)%;之后,继续增加粗提物浓度,清除率基本无变化;粗提物对DPPH自由基清除能力的IC50值为1.086 mg·mL-1(VC的IC50值为1.470 mg·L-1)。
2.2 ABTS法测定喙尾琵琶甲幼虫甲醇粗提物抗氧化活性结果
喙尾琵琶甲幼虫甲醇粗提物对ABTS自由基的清除率如图4所示。

图4 喙尾琵琶甲幼虫甲醇粗提物对ABTS自由基的清除率
从图4可以看出,喙尾琵琶甲幼虫甲醇粗提物具有清除ABTS自由基的能力。在0.031 25~1 mg·mL-1浓度范围内,粗提物对ABTS自由基的清除率随着浓度的增加迅速升高,在粗提物浓度为1 mg·mL-1时,清除率达到(99.60±0.49)%;之后,继续增加粗提物浓度,清除率基本无变化;粗提物对ABTS自由基清除能力的IC50值为0.177 mg·mL-1(VC的IC50值为7.822 mg·L-1)。
与DPPH自由基清除率相比,喙尾琵琶甲幼虫甲醇粗提物对ABTS自由基的清除率更高。与文献[14,16]报道结果比较,喙尾琵琶甲幼虫甲醇粗提物对ABTS自由基的清除作用低于7种云南可食用昆虫生样和熟样醇提液对ABTS自由基的清除作用,但是高于喙尾琵琶甲成虫醇提物依次用石油醚、氯仿、乙酸乙酯、正丁醇萃取的提取物。
2.3 FRAP法测定喙尾琵琶甲幼虫甲醇粗提物抗氧化活性结果
从FeSO4·7H2O标准曲线(图5)可以看出:FeSO4·7H2O溶液浓度在0.062 5~2 mmol·L-1范围内,与593 nm处吸光度呈良好的线性关系,线性方程为y=0.9057x+0.0638,R2=0.9972。

图5 FeSO4·7H2O的标准曲线
喙尾琵琶甲幼虫甲醇粗提物的总抗氧化活性随着浓度的增加而升高,在0.5~8 mg·mL-1浓度范围内,FRAP值从0.12增至0.70(图6)。
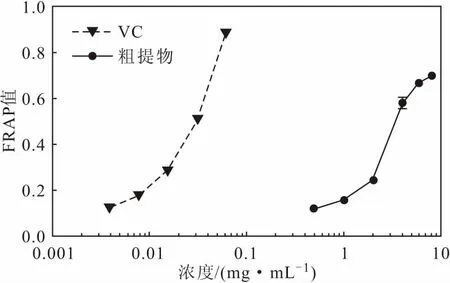
图6 喙尾琵琶甲幼虫甲醇粗提物的总抗氧化活性
3 结论
DPPH法、ABTS法、FRAP法等3种体外抗氧化活性评价方法都表明喙尾琵琶甲幼虫提取物具有体外抗氧化活性。在喙尾琵琶甲幼虫甲醇粗提物浓度为3 mg·mL-1时,其对DPPH自由基的清除率为(92.53±2.26)%;在喙尾琵琶甲幼虫甲醇粗提物浓度为1 mg·mL-1时,其对ABTS自由基的清除率为(99.60±0.49)%;在喙尾琵琶甲幼虫甲醇粗提物浓度为8 mg·mL-1时,其总抗氧化活性的FRAP值为0.70。在低浓度下,粗提物的抗氧化活性虽然低于VC,但随着浓度的增加,其抗氧化活性逐渐升高,甚至可以达到VC的抗氧化效果。本研究仅对喙尾琵琶甲幼虫粗提物进行了抗氧化活性分析,其幼虫虫态是否具有成虫一样的药用功效还有待进一步研究。未来将进一步对喙尾琵琶甲幼虫粗提物进行分离纯化,提高其抗氧化活性,并对有效成分进行鉴定以促进其开发利用。

