雷公藤多甙通过调控miR-146a表达来减轻LPS诱导的AR42J细胞炎症损伤
蒙振发 李以萍 谭德敏 陈绵军 陈军
(儋州市人民医院 1重症医学科,海南 儋州 571700;2门诊药房)
急性胰腺炎(AP)是临床上常见的急性腹症,临床一般表现为腹痛、恶心呕吐、发热、血胰酶升高等症状,具有起病迅速、病死率高、预后差等特点,除胰腺本身病变外,还可引发其他组织和器官损伤,甚至诱发患者全身性炎症反应和器官功能性障碍〔1~3〕。脂多糖(LPS)即热源或内毒素,是革兰阴性菌细胞壁的成分,具有毒性、炎症损伤作用,能诱发机体的免疫反应。雷公藤多甙(TWP)是卫矛科植物雷公藤去皮根中提取而成的总皂苷,其中二萜类化合物和雷公藤甲素发挥主要作用,临床上应用于免疫调控、抗炎、肾病等,其不良反应少、用量小,是目前国内外研究免疫调节、抗炎药的热点之一〔4〕。微小RNA(miRNA)是内源性非编码RNA,在炎症、免疫调节方面发挥着重要作用,大部分miRNA通过抑制基因表达,发挥负反馈调节作用,miR-146是最先发现在免疫应答中具有正反馈调节作用的miRNA,有miR-146a和miR-146b两个成员〔5〕。miR-146b在炎症反应中已被广泛研究报道,因此本研究以胰腺腺泡细胞(AR42J)为模型细胞,拟通过研究TWP在减轻LPS诱导的AR42J炎症损伤中的作用及对miR-146a表达的影响。
1 材料与方法
1.1试剂和仪器 TWP(≥98%)购自湖北恒景瑞化工有限公司;地塞米松(DXM) 磷酸钠注射液购自湖北天药药业股份有限公司(1 ml∶5 mg);LPS(≥99%)购自上海酶联生物科技有限公司;DMEM培养基、胎牛血清购自美国Gibico公司;青链霉素双抗、四甲基偶氮唑蓝(MTT)试剂购自美国Hyclone公司;肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6和IL-1β酶联免疫吸附试验(ELISA)检测试剂盒购自美国Neomarker公司;总RNA提取试剂盒购自北京索莱宝科技有限公司;U6内参(E021010)购自美国EARTHOX公司;miR-146a PCR引物(CD106)购自北京天根生化科技有限公司;兔抗鼠NF-κB p65、兔抗鼠Toll样受体(TLR)4、兔抗鼠内参β-Actin、羊抗兔二抗购自美国Bioworld公司;CFX96型实时荧光定量(RT-qPCR)仪购自美国BIO-RAD公司;Multiskan FC酶标仪、赛默飞世尔BB15 CO2细胞培养箱购自美国赛默飞公司;细胞培养接种专用超净台购自郑州安晟科学仪器有限公司;电泳槽和转膜槽购自美国Bio-Rad公司。
1.2细胞系 大鼠胰腺腺泡细胞(AR42J)购自中科院上海细胞库,加入含10%胎牛血清、1%青链霉素双抗的DMEM培养液,置于37℃ 5%CO2培养箱中常规培养,隔天换液。细胞生长至70%~80%融合后进行传代。收集对数生长期细胞进行后续试验。
1.3MTT法测定不同浓度TWP对AR42J细胞活性的影响 取对数生长期的AR42J细胞,用培养液将细胞密度调整为4×104个/ml,以每孔200 μl接种到96孔板,继续培养过夜后弃培养液,并用磷酸盐缓冲液(PBS)清洗3遍,加入含不同浓度的TWP培养液(终浓度分别为2、5、10、25、50、100 μmol/L),每组设置6个复孔,同时设置不加TWP的对照组,只加0.1%二甲基亚砜(DMSO)组。培养箱培养24 h,之后加入25 μl 5 mg/ml的MTT溶液,继续培养4 h,弃去培养基,加入150 μl DMSO溶液,100 r/min 37℃震荡10 min,使用全自动酶标仪测定在490 nm处吸光度(OD值)。计算不同浓度TWP对AR42J细胞活性。细胞活性按下式计算:细胞活性(%)=实验组OD值/对照组OD值×100%。
1.4LPS刺激后AR42J细胞形态学观察 实验分组,对照组:不经任何处理的AR42J细胞;LPS组:加入2 ml 终浓度为10 μg/ml LPS培养液〔6〕;L-TWP+LPS组:加入2 ml终浓度为10 μg/ml LPS和2 μmol/L TWP培养液(LPS加入24 h后,再加入TWP培养24 h,以下分组操作与此相同);M-TWP+LPS组:加入2 ml终浓度为10 μg/ml LPS和5 μmol/L TWP培养液;H-TWP+LPS组:加入2 ml终浓度为10 μg/ml LPS和10 μmol/L TWP培养液;DXM+LPS组:加入2 ml终浓度为10 μg/ml LPS和25 μg/mL DXM培养液〔7〕。将AR42J细胞接种到含有细胞爬片的6孔板上,培养24 h后,按照上面分组进行加药操作,待培养结束后染色、封片,用激光共聚焦观察细胞形态并拍照。
1.5ELISA检测TNF-α和IL-6表达水平 ELISA法检测细胞上清液中TNF-α和IL-6表达水平,将各孔的细胞培养基在4℃ 5 000 r/min离心半径10 cm条件下离心10 min,用移液器取上清液,严格按照ELISA试剂盒说明书操作测定各组细胞TNF-α和IL-6表达水平,显色后,用多功能酶标仪测定样品在450 nm处的吸光度,根据建立的标准曲线计算TNF-α和IL-6浓度。
1.6RT-qPCR检测细胞中miR-164a表达水平 收集AR42J细胞,实验分组同“1.4”,使用总RNA提取试剂盒提取AR42J细胞中的总RNA,经过反转录得cDNA,采用RT-qPCR仪对miR-164a进行扩增。RT-qPCR体系共20.0 μl,其中SYBR Mix10.0 μl,cDNA(25 ng/ml) 2.0 μl,上下游引物(5 μmol/L)各2.0 μl,ddH2O 4.0 μl。反应条件:95℃预变性300 s,95℃变性30 s,63℃退火30 s,73℃延伸15 s,40个循环后,73℃终末延伸5 min。miR-164a上游引物:5′-UGAGAACUGAAUUCCAUGGGUU-3′,下游引物:5′-CCCAUGGAAUUCAGUUCUCAUU-3′;U6上游引物:5′-ATTGGAACGATACAGAGAAGATT-3′,下游引物5′-GGAACGCTTCACGAATTTG-3′。每个样本均做3个副孔,采用2-ΔΔCt法对AR42J细胞miR-164a表达水平进行定量分析。
1.7Western印迹法测定TWP对AR42J细胞TLR4/核转录因子(NF)-κB信号通路的影响 Western印迹测定胶质瘤AR42J细胞NF-κB p65和TLR4表达情况,实验分组同“1.4”。用细胞裂解液十二烷基硫酸钠(SDS)提取各组细胞总蛋白,二喹啉甲酸(BCA)法测定各组细胞蛋白含量,每组设置6个副孔,40 μg蛋白加入到点样孔中,SDS-聚丙烯酰胺凝胶电泳(PAGE)分离目标蛋白,根据目标蛋白大小剪切大小适当的凝胶。用湿转法将凝胶上蛋白转至聚偏氟乙烯(PVDF)膜上,5%的脱脂奶粉封闭结合位点2 h。加入兔抗鼠NF-κB p65(1∶1 000)、兔抗鼠TLR4(1∶1 000)、兔抗鼠内参β-Actin(1∶1 000)4℃孵育过夜,用PBS清洗3次,每次5 min,加入羊抗兔二抗(1∶1 000),25℃孵育15 min,PBS清洗3次,每次5 min,用显色剂电化学发光(ECL)显色、曝光。用凝胶成像设备观察。
1.8统计学分析 采用SPSS22.0软件进行单因素方差分析、t检验。
2 结 果
2.1不同浓度TWP对AR42J细胞活性的影响 0 μmol/L、2 μmol/L、5 μmol/L、10 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L TWP处理24 h后AR42J细胞活性,分别为:(102.67±3.31)%、(98.46±4.27)%、(94.27±3.64)、(87.59±4.06)%、(76.91±4.16)%、(52.47±3.94)%、(32.65±3.92)%。AR42J细胞经10 μmol/L TWP处理24 h后,仍保持较高活性,为保证实验结果准确性,后续实验选取TWP浓度2 μmol/L、5 μmol/L、10 μmol/L进行。
2.2LPS刺激后AR42J细胞形态 AR42J细胞经LPS诱导后,细胞逐渐变形、皱缩、边缘不规则、核仁不清晰,经不同浓度TWP处理后,随着浓度增加细胞形态逐步恢复,细胞逐渐恢复圆整饱满。见图1。
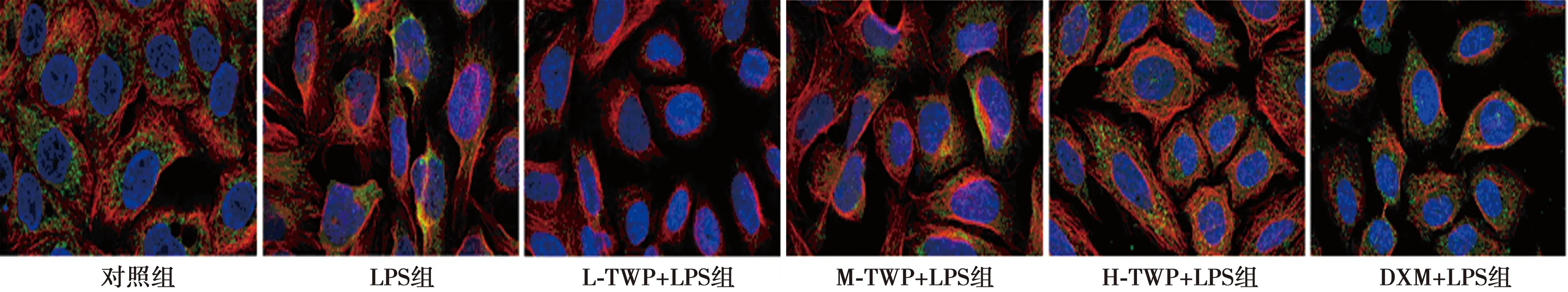
图1 LPS刺激后AR42J细胞形态(免疫荧光染色,×100)
2.3TWP对AR42J细胞促炎症因子TNF-α、IL-6、IL-1β表达的影响 与对照组相比,LPS组TNF-α、IL-6、IL-1β蛋白表达水平显著升高(P<0.05)。与LPS组相比,L-TWP+LPS组、M-TWP+LPS组、H-TWP+LPS组TNF-α、IL-6、IL-1β蛋白表达水平显著降低(P<0.05),随着TWP浓度升高,蛋白表达水平也随之降低,任意两组相比差异有统计学意义(P<0.05)。DXM+LPS组TNF-α、IL-6、IL-1β蛋白表达水平与LPS组、L-TWP+LPS组及M-TWP+LPS组相比显著降低(P<0.05),与H-TWP+LPS组相比差异无统计学意义(P>0.05),见表1。
2.4TWP对AR42J细胞中miR-146a水平的影响 与对照组相比,LPS组miR-146a表达水平显著升高(P<0.05)。与LPS组相比,L-TWP+LPS组、M-TWP+LPS组、H-TWP+LPS组miR-146a表达水平显著升高(P<0.05),随着TWP浓度升高,miR-146a表达水平也随之升高,任意两组相比差异有统计学意义(P<0.05)。DXM+LPS组miR-146a表达水平与LPS组、L-TWP+LPS组及M-TWP+LPS组相比显著升高(P<0.05),与H-TWP+LPS组相比差异无统计学意义(P>0.05),见表1。
2.5TWP对AR42J细胞TLR4/NF-κB信号通路的影响 与对照组相比,LPS组NF-κB p65蛋白、TLR4蛋白表达水平显著升高(P<0.05)。与LPS组相比,L-TWP+LPS组、M-TWP+LPS组、H-TWP+LPS组NF-κB p65蛋白、TLR4蛋白表达水平显著降低(P<0.05),随着TWP浓度升高,TNF-κB p65蛋白、TLR4蛋白表达水平也随之降低,任意两组相比差异有统计学意义(P<0.05)。DXM+LPS组NF-κB p65蛋白、TLR4蛋白表达水平与LPS组、L-TWP+LPS组及M-TWP+LPS组相比显著降低(P<0.05),与H-TWP+LPS组相比差异无统计学意义(P>0.05),见表1和图2。

表1 TWP对AR42J细胞TNF-α、IL-6、IL-1β表达及miR-146a、NF-κB p65、TLR4水平的影响
3 讨 论
p38MAPK和核转录因子NF-κB是胰腺炎发病中产生促炎症因子的主要途径,有学者认为肠黏膜受损,导致肠道菌群细胞壁成分LPS刺激机体是胰腺炎发病的主要原因〔8,9〕。研究表明LPS可激活机体免疫系统分泌大量炎症因子,从而引起炎症损伤,在实验性胰腺炎模型中,LPS刺激后上调TNF-α和IL-6等促炎症因子的表达,而TNF-α和IL-6的上调以正反馈方式持续活化NF-κB通路,导致炎症反应得以持续和放大〔10,11〕。本实验细胞形态结果说明炎症细胞模型构造成功。
TWP因其保留雷公藤的抗炎、免疫调节作用,去除毒性部分,在临床上主要用于治疗类风湿关节炎、皮肌炎、肾脏疾病、红斑狼疮等疾病〔12〕。TNF-α由非免疫或免疫细胞分泌的细胞因子,可与前炎症因子共同启动早期炎症反应,并维持炎症。IL-6是多效能的细胞因子,在炎症和免疫调节中发挥着重要作用〔13,14〕。徐光标等〔15〕研究表明TWP能够下调糖尿病肾病患者炎症因子TNF-α和IL-6表达水平从而改善患者免疫失衡状态,恢复肾脏功能,减少尿蛋白生成;进一步细胞实验发现,TWP预处理可抑制LPS诱导的大鼠星形胶质细胞促炎症因子TNF-α和IL-6释放,说明TWP能够改善LPS诱导的星形胶质细胞炎性损伤。本研究结果说明TWP能下调AR42J细胞促炎症因子TNF-α、TNF-α和IL-1β的表达,减轻LPS所致AR42J细胞炎症反应。
miRNA是目前生命科学研究的热点之一,可促进mRNA降解或抑制翻译,在转录水平上调控基因,最终影响下游蛋白分子的表达。研究表明miR-146a能够通过负反馈调节TNF受体相关因子(TRAF)6和IL-1受体相关激酶(IRAK)1,降低NF-κB活性,从而进一步降低下游促炎因子的表达〔16〕。本研究结果说明TWP能够上调炎症AR42J细胞miR-146a表达水平来减轻炎症损伤。周兴宏等〔17〕发现三七皂苷R1可能通过上调miR-146a表达水平,降低TNF-α和IL-6表达水平,以降低动脉粥样硬化小鼠血脂、血糖水平,并保护肝功能。随后研究〔18〕发现在PM1诱导的炎症BEAS-2B细胞中IL-6和IL-8表达水平上调,并通过激活NF-κB信号通路上调miR-146a的表达,过表达的miR-146a通过抑制IRAK1/TRAF6表达来阻止p65的核转位,并下调IL-6和IL-8的表达,说明miR-146a可以通过BEAS-2B细胞中的NF-κB信号传导途径负调节PM1诱导的炎症反应。本研究说明AR42J细胞经TWP处理后,TLR4/NF-κB信号通路受到抑制。
综上所述,TWP可能通过上调miR-146a表达水平抑制TLR4/NF-κB信号通路,降低炎症因子TNF-α、IL-6、IL-1β蛋白表达水平,从而减轻LPS诱导的AR42J细胞炎症损伤。

