乳腺癌中长链非编码RNA H19可变剪接体的鉴定
王喜周,李凌云,周 武
(1.丽水学院职业技术学院,浙江丽水 323000;2.丽水市人民医院,浙江丽水 323000;3.嘉兴学院医学院,浙江嘉兴 314001)
长链非编码RNA(Long non-coding RNA,LncRNA)是指长度大于200 nt、缺少或无开放阅读编码框(opening reading frame,ORF)不表达蛋白质的基因。与编码蛋白质的基因相比,这类基因物种间的保守序列低、具有更高的组织器官特异性并且不一定都带多聚腺苷酸尾巴[1]。H19是一类特殊的长链非编码RNA,是第一个被发现的印迹基因。所谓印迹基因是指同源基因在表达时,只有一方的等位基因进行表达,来自另外一个亲本的等位基因不表达或者表达极弱[2]。人H19基因位于11号染色体p15.5位置,是母源性的印迹基因,只有mRNA的表达,不编码蛋白质。
可变剪接,也称选择性剪接(alternative splicing),是基因转录为mRNA前体(pre-mRNA)之后,在mRNA加工成熟过程中出现的一种多样性的剪接方式。一般情况下,前体mRNA的加工成熟是剪除所有内含子,留下外显子,外显子再连接形成成熟的mRNA。在此过程中,如果出现不同的剪接方式,就会出现成熟mRNA的可变剪接体,这些剪接体称为剪接异构体[3-4]。可变剪接不但发生在编码基因上,也发生在非编码基因上。长链非编码基因的可变剪接是长链非编码基因进行调控的重要手段,长链非编码基因的异常可变剪接会导致多种疾病的发生,特别是癌症[5]。
乳腺癌是女性中发病率最高的癌症,是女性的“第一杀手”,严重威胁着女性的身体健康。尽管近年来乳腺癌的死亡率出现下降趋势,但对乳腺癌的治疗仍然面临着巨大的挑战。本研究利用几株常用的乳腺癌细胞系细胞,对乳腺癌中长链非编码RNA H19(H19LncRNA)的可变剪接情况进行鉴定,为进一步研究H19LncRNA的各剪接体介导乳腺癌中肿瘤发生发展各阶段的作用提供理论依据,从而为乳腺癌的治疗指明新的研究方向。
1 材料与方法
1.1 材料
ZR-75-30、T-47D、BT-474、MDA-MB-231和MCF-7细胞购自中国科学院上海细胞库,所有细胞培养于添加10%胎牛血清和双抗的DMEM细胞培养液,置于5%CO2含量的37℃培养箱。
1.2 方法
1.2.1 套式PCR反应
设计并合成针对H19的套式扩增引物(#1 F:5’-AGTTAGAAAAAGCCCGGGC-3’,R:5’-GCAG GGTGAGGGAGGGGGTGGGAT-3’;#2 F:5’-CTTC AGCAGGAGCCCTGGACTCA-3’#2 R:5’-TGTGCC CCTCCCCACCAGGGCTTC-3’),以各细胞提取的DNA为模板,设定如下程序进行PCR扩增(94℃2 min,98℃15 s-60℃30 s-68℃1.5 min 15 cycles,68℃5 min)。PCR产物经琼脂糖凝胶电泳分离后,参照OMEGA胶回收试剂盒说明书对目的条带进行回收。回收后条带经纯化后送至上海生工公司测序。
1.2.2 5’RACE和3’RACE检测
提取MCF细胞总RNA,以21 Nanodrop检测RNA纯度及浓度,普通琼脂糖凝胶电泳(1.5%)分析RNA完整性之后,QIAGEN逆转录试剂盒进行cDNA合成,通过RACE引物(#3:5’-GTCCTAGCC CGGGCTTTTCTA-3’#4:5’-GTCCAGGGCTCCTGCT GAAG-3’)进行RACE检测。
2 结果与分析
2.1 RACE分析及引物设计
H19LncRNA的可变剪接与癌症相关性的研究不多,乳腺癌中是否存在H19LncRNA的可变剪接体尚未见报道。我们根据H19LncRNA的UTR序列,通过设计巢式PCR引物(图1),对H19全长cDNA序列进行扩增,以期发现新的H19剪接体。因为以上的巢式引物位于H19mRNA的UTR区域,为了避免H19在5’端和3’端存在其他的转录起始和终止位点而漏检,我们在此基础上进行了5’端和3’端的RACE分析。在表达H19的乳腺癌细胞MEF7中,5’端(引物#3)和3’端(引物#4)的RACE分析结果显示:它们的PCR扩增产物都是单一的条带(图2),说明在前体mRNA区域内,H19不存在其他的转录起始或终止位点。

图1 H19LncRNA的结构及引物设计

图2 RACE分析
2.2 H19LncRNA剪接体在乳腺癌细胞中的表达
通过以上设计的巢式引物,我们在几种常用的乳腺癌细胞系细胞中对H19LncRNA的可变剪接情况进行了检测。如图3所示,各乳腺癌细胞中的PCR产物表现为7种大小不一的片段。经进一步测序比对,这7条片段分别为H19的1条成熟mRNA(H19mRNA)和6种不同的可变剪接形式(图4)。

图3 H19在乳腺癌中的可变剪接
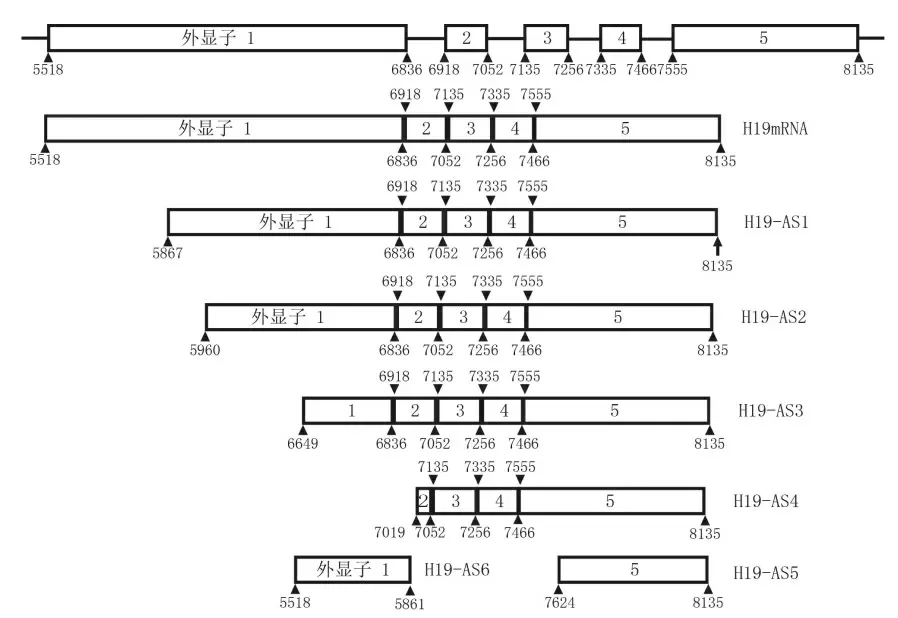
图4 H19各剪接体示意图
各剪接体的剪接位点和剪接产物具有一定的特征。与成熟的全长mRNA相比,剪接体H19-AS1、H19-AS2、H19-AS3、H19-AS4、H19-AS5的剪接方式表现为可选择的5’剪接位点。其中,剪接体H19-AS1、H19-AS2、H19-AS3是在外显子1上进行的5’剪接位点的可变剪接,可变剪接位点分别是5867、5960和6649;剪接体H19-AS4则是在外显子2上可变剪接位点7019处进行的可变剪接;而剪接体H19-AS5则是在外显子5上可变剪接位点7621处进行的可变剪接。另外,与成熟的全长mRNA相比,剪接体H19-AS6则是在外显子1上进行的3’剪接位点的可变剪接,剪接位点为5861。
3 结论与讨论
H19是人类最早发现的印迹基因。研究表明,H19在多种肿瘤中呈现高表达,H19LncRNA参与了肿瘤发生发展过程中多个方面的调控,包括肿瘤细胞增殖、肿瘤细胞转移、肿瘤细胞干性维持、肿瘤代谢、肿瘤耐药、肿瘤血管生成以及肿瘤自噬调控等等[6]。然而,在不同癌症中H19的作用机制有所差别。比如:H19可与miR-675形成复合物,通过调节Fas相关蛋白与死亡结构域(FADD)的表达介导胃癌的发生[7]。H19也可通过“分子海绵”的作用吸附miR-138分子,从而增强结肠癌细胞的迁移和侵袭能力[8]。本研究中,我们在乳腺癌细胞中鉴定出H19的6种可变剪接体,提示乳腺癌与H19的可变剪接有关。
关于H19的可变剪接研究不多,已发现的H19可变剪接体主要包括外显子4缺失[9]和外显子1部分缺失[10]两类。这两类已报道的可变剪接体主要是在胚胎或者正常组织中的存在形式,而本研究则以乳腺癌细胞为研究对象,通过巢式引物的设计,PCR鉴定出H19的新剪接体。这些新的剪接体在各细胞中存在的类型各不相同。ZR-75-30细胞中有三种剪接体AS2、AS3和AS5,T-47D细胞中鉴定出AS1、AS4和AS6三种可变剪接体,BT-474和MCF-7细胞中存在AS1、AS4和AS5三种可变剪接体,而MDA-MB-231细胞中则只有AS2和AS6两种可变剪接体,并且,ZR-75-30和BT-474细胞中没有鉴定出全长的成熟H19mRNA(图3)。
由于肿瘤存在异质性的特征,不同的肿瘤细胞甚或是同一肿瘤的不同细胞,其侵袭转移能力都存在一定差别。在对乳腺癌的研究中发现,相关基因的选择性剪接及其选择性剪接后的相应产物,对乳腺癌的肿瘤转移、侵袭具有重要的作用。这些基因包括原癌基因Mdm2、C-erbB-2,抑癌基因PTEN,雌激素受体β(ERβ),凋亡抑制蛋白Survivin等。乳腺癌相关基因的选择性剪接作为乳腺癌发生发展的特征,新型选择性剪接异构体的发现和鉴定正成为乳腺癌诊断和治疗的新策略。本研究结果提示不同的剪接体有可能介导不同的肿瘤发生发展过程,势必有利于阐明选择性剪接对肿瘤发生发展的调控机制,对乳腺癌和其他肿瘤的发病机理、诊断和治疗提供更多更有利的参考。

