LSC-100树脂吸附铅(Ⅱ)的研究
莫建军
(丽水学院生态学院,浙江丽水323000)
铅存在于大自然中,是原子量最大的非放射性元素。作为材料金属,铅是一种耐蚀的重有色金属材料,它具有X射线和γ射线等不易穿透、熔点低、耐蚀性高、塑性好等优点,广泛用于化工、蓄电池和放射性防护等领域。然而将未经处理的含铅离子溶液排放到自然环境中,人类及生物赖以生存的土壤和水资源将受到严重危害。近年来,重金属回收及环境保护等方面的研究比较活跃[1-9]。用LSC-100树脂对铅的吸附进行研究,具有操作简单、吸附材料可再生等优点,该研究有望在铅离子废水处理中有一定的理论指导作用。
1 实验材料与方法
1.1 仪器与试剂
仪器:SHZ—B型数显水浴恒温振荡器;分光光度计722型;Sartorius BS 210S电子天平;电热恒温鼓风干燥箱。
试剂:硝酸铅;浓盐酸;无水乙酸钠;冰醋酸;氯化钠;氯化镁;二甲酚橙;氯化镉。
1.2 实验方法
1.2.1 树脂的预处理
称取适量的LSC-100树脂(官能团为-N(CH2COONa)2),先用清水冲洗,去除杂质,然后使用5%氢氧化钠浸泡,清洗完成后再用5%盐酸浸泡,最后用清水淋洗至中性,烘干待用。
1.2.2 分析方法
在锥形瓶中加入一定量树脂和缓冲溶液,浸泡24 h,加入铅标准溶液,振荡至平衡,取一定量的溶液加入2.5 mL pH=6的HAc-NaAc缓冲溶液和1.5 mL的二甲酚橙溶液,加蒸馏水,稀释到刻度,以试剂空白为参比,在波长560 nm处测定吸光度,计算水相中铅离子的平衡浓度。
1.2.3 计算公式

铅(Ⅱ)吸附平衡时的浓度,单位为mg·L-1。
2 结果与讨论
2.1 不同pH缓冲液对吸附效果的影响
称取10.0 mg树脂于6个干燥的锥形瓶中,分别加入pH为3.6、4.0、4.6、5.2、5.6、6.2的HAc-NaAc缓冲溶液26 mL,浸泡24 h,再分别加入4 mL的2 mg/mL的Pb溶液,置于25℃的恒温振荡器振荡48 h。按1.2方法测得吸光度,计算吸附量Q,结果如图1所示。由图1可知,树脂在pH=4.6的HAc-NaAc缓冲液中吸附效果最佳。

图1 pH对铅吸附量的影响
2.2 吸附平衡时间和吸附速率常数的测定
称取20.0 mg干燥的树脂于锥形瓶中,加入44 mL pH=4.6的HAc-NaAc缓冲液,静置24 h。加入6 mL的2 mg·mL-1的Pb标准溶液,置于25℃恒温振荡器振荡。每间隔一定时间测定吸光度,计算吸附量,如图2所示,平衡时的反应时间为35 h。

图2 LSC-100树脂吸附铅的速率曲线
根据公式-ln(1-F)=kt[10],式中F=Qt/Qe,Qt为反应时间t时的吸附量,Qe为平衡时的吸附量,k为吸附速率常数。以-ln(1-F)和t作图得一直线,如图3所示,由直线斜率可得吸附速率常数为k298=5.64×10-2s-1。

图3 LSC-100树脂吸附铅的速率常数的测定
2.3 等温吸附曲线的测定
准确称取10.0 mg、15.0 mg、20.0 mg、25.0 mg树脂于干燥锥形瓶中,加入44 mL pH=4.6的HAc-NaAc缓冲液,静置24 h。再分别加入6 mL 2 mg/mL的铅标准溶液,保持温度在25℃,使用恒温振荡器振荡至平衡。测定溶液中平衡浓度ρe,然后换算成相应的吸附量Q。
数据用Freundlich等温吸附方程lgQ=lgK+1/nlgρe(K,n为常数)进行拟合计算,图形为直线,如图4所示,系数r为0.999 6。用Langmuir等温吸附方程ρe/Q=1/KbAs+ρe/As(As为饱和吸附量,Kb为结合常数)进行拟合,图形为直线,如图5所示,系数r为0.999 2。说明该吸附符合Freundlich和Langmuir等温吸附方程。由Freundlich等温吸附方程直线斜率1/n=0.497 6,得n=2.01,Freundlich方程参数n大于1,表明LSC-100树脂对Pb2+的吸附为优惠吸附[11]。
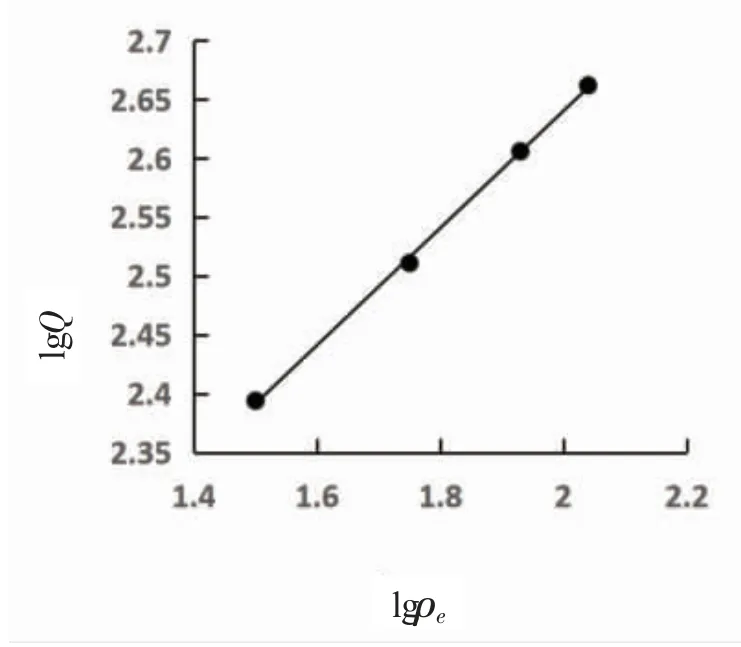
图4 Freundlich曲线
2.4 温度对树脂吸附的影响
准确称取10.0 mg树脂于4个干燥锥形瓶中,分别加入25 mL pH=4.6的HAc-NaAc缓冲液,静置24 h。再分别加入2 mg·mL-1的铅标准溶液5 mL,分别置于15℃、25℃、35℃、45℃的恒温振荡器振荡至平衡。测出吸光度,计算分配比D。
以lgD对1/T作图,见图6。相关系数r为0.993 0。由lgD=-∆H/2.303RT+∆S/R,图6的直线斜率k斜=-0.550 4,可得∆H=13.81 kJ·mol-1。
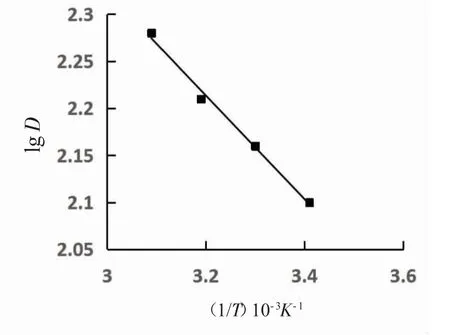
图6 温度对LSC-100树脂吸附铅的分配比的影响
由Gibbs方程[12]推得,式中,∆G为吸附自由能变,X代表溶质在溶液中的摩尔分数,q为吸附等温方程。
采用Freundlich吸附等温方程取代式中q时,推导出单位吸附质的吸附自由能变∆G与q无关:∆G=-nRT。式中,n代表Fueundlich常数,由n=2.01得∆G=-4.98 kJ·mol-1。自由能的减小对树脂吸附铅是有利的[13]。
吸附熵可以采用Gibbs-Helmholtz方程[14]进行计算:∆S=(∆H-∆G)/T。即∆S=(13.81+4.98)/298=63.05 J·mol-1·K-1。
2.5 不同介质对树脂吸附的影响
研究不同介质对树脂吸附铅的影响,选用4种介质(HCl、NaCl、MgCl2、CdCl2)分别加入溶液中,图7显示树脂吸附铅离子与所加入介质有关系。其中NaCl和MgCl2在体系中影响较小,随着NaCl和MgCl2浓度的增加,树脂吸附量变化幅度不大。具体原因:一是体系离子强度增大,干扰树脂与铅离子之间的离子交换;二是盐析作用使得溶液中的硝酸铅的溶解度降低,树脂吸附铅离子更趋向于物理吸附;三是碱金属和碱土金属离子由于半径较小很难与树脂功能基产生配位,所以加入这两种盐对树脂吸附铅的影响很小。因此向体系中加入NaCl和MgCl2时,吸附量变化幅度不大。当溶液体系中加入HCl和CdCl2时,树脂吸附量波动幅度较大,有一个较为明显下降趋势,这可能是HCl中的氢离子与铅离子产生了竞争,从而铅离子与树脂功能基的吸附量减小。而加入CdCl2时,可能是镉离子半径较大,可与树脂功能基团配位,从而极大地阻碍了铅离子与树脂功能基团配位,导致铅的吸附量随CdCl2浓度的增加而明显降低。

图7 不同介质对LSC-100树脂吸附铅的影响
2.6 树脂的解吸
对树脂的解吸能力的探讨十分必要。通过对不同解析剂实验比较,盐酸的解析能力比较好,因此本实验选择不同浓度的盐酸作为解吸剂,对吸附饱和的树脂进行解吸。在吸附等量Pb(Ⅱ)的树脂中分别加入0.5 mol·L-1、1.0 mol·L-1、2.0 mol·L-1、3.0 mol·L-1的盐酸溶液,振荡平衡后测水相中Pb(Ⅱ)的含量,解吸率见表1。从表1可见这几种浓度的盐酸都有较好的解吸效果,其中0.5 mol·L-1的盐酸解吸率最高,一次解吸率达到98%。

表1 不同浓度盐酸对解吸率的影响
解吸速率实验用0.5 mol·L-1的盐酸溶液进行,从图8可知,解吸完全需要50 min,表明0.5 mol·L-1的盐酸可望作为实用解吸剂。
3 结论
(1)在pH=4.6的HAc-NaAc体系中铅离子可以被LSC-100树脂很好地吸附,在温度为298 K条件下静态饱和吸附量为589 mg·g-1。
(2)LSC-100树脂吸附铅离子的过程符合Langmuir和Freundlich等温式。反应中的∆H=13.81 kJ·mol-1,∆S=63.05 J·mol-1·K-1,∆G=-4.98 kJ·mol-1,表观速率常数k298=5.64×10-2s-1。
(3)不同介质对LSC-100树脂吸附铅有不同程度的影响,体系中存在HCl和CdCl2时对吸附效果影响较大;而体系中存在NaCl和MgCl2时对吸附效果影响不大。
(4)采用不同浓度的盐酸进行解吸,0.5 mol·L-1HCl的解吸率最高,达到98%。用0.5 mol·L-1HCl作解吸速率实验,在50 min时基本解吸完成,因此HCl溶液有望作为一种实用的解吸剂。

