lncRNA SLC8A1-AS1在脓毒症大鼠心肌组织中的表达及其对炎症因子分泌的影响
刘枫,张韩,李彦明,鲁雪丽
(河南大学淮河医院a.重症医学科;b.心血管内科,河南 开封 475000)
脓毒症是由于微循环障碍、细胞凋亡等多种原因引起的全身多个器官功能异常的疾病,凝血异常、心血管反应失调、内皮功能障碍是脓毒症的常见特征,心脏是脓毒症最常见的受损器官之一,约有50%的脓毒症患者伴有心肌损伤[1]。脂多糖(lipopolysaccharide,LPS)是常见的体外诱导脓毒症心肌细胞损伤的因子,心肌细胞分泌炎症因子和过度凋亡是脓毒症心肌损伤发生的关键机制[2]。长链非编码RNA(long non-coding RNA,lncRNA)是长度超过200个核糖核苷酸的长链非编码RNA,通过RNA的形式调控多个生理活动,如细胞凋亡、新陈代谢、血管再生、心脏老化、胚胎发育等[3]。很多研究已报道,lncRNA与缺氧复氧心肌损伤、脓毒症心肌损伤、糖尿病心肌病等心脏疾病有关[4]。以前的研究发现,lncRNA SLC8A1-AS1在心肌梗死中表达下调,而上调SLC8A1-AS1可改善心脏功能,减少炎症因子分泌,缩小心肌梗死面积,SLC8A1-AS1可能是心肌损伤的保护因子[5]。现阶段对SLC8A1-AS1在脓毒症心肌细胞损伤中的作用还不清楚。本研究首先检测了脓毒症大鼠心肌组织中SLC8A1-AS1的表达,并以LPS诱导构建体外脓毒症心肌细胞模型,探讨SLC8A1-AS1对脓毒症心肌细胞炎症因子分泌的影响,为靶向分子治疗脓毒症心肌损伤提供方向。
1 材料与方法
1.1 实验材料清洁级SD大鼠购自郑州大学动物实验中心,体质量180~200 g,雌雄各半。动物生产许可证号:SCXK(豫)2018-001,动物使用许可证号:SYXK(豫)2018-005,动物质量合格证号:0050472。大鼠心肌H9C2细胞购自深圳市拓普生物科技有限公司;TNF-α含量检测试剂盒购自深圳市科润达生物工程有限公司;IL-6含量检测试剂盒购自武汉艾美捷科技有限公司;RNA反转录试剂盒购自大连TaKaRa;IL-1β含量检测试剂盒购自上海研谨生物科技有限公司;p65抗体购自美国Santa Cruz Biotechnology。阴性对照表达载体(pcDNA)、SLC8A1-AS1过表达载体(pcDNA-SLC8A1-AS1)均由武汉金开瑞生物工程有限公司构建。本实验符合动物伦理学标准,并经河南大学淮河医院实验动物伦理委员会审查通过。
1.2 脓毒症心肌损伤大鼠模型构建Model组大鼠按照下述方法构建[6]:用100 g·L-1的水合氯醛麻醉大鼠,将大鼠仰卧置于操作台上,消毒,于大鼠的前腹部中线进行3 cm剖腹手术,将腹腔打开,分离盲肠,以3.0无菌丝线结扎盲肠,并用16号针头将结扎位置对穿2次,挤压盲肠,观察穿孔位置出现少量粪便时,将盲肠返回,缝合,关腹,将切口消毒。Normal组大鼠不做穿刺,其余同Model组。最后每组大鼠剩余9只。各组大鼠在造模后24 h再次以水合氯醛麻醉,处死,打开胸腔,留取心肌组织,用于1.3中检测。
1.3 qRT-PCR方法检测脓毒症大鼠心肌组织中SLC8A1-AS1表达采用Trizol提取心肌组织中的总RNA,以RNA反转录试剂盒获得第1条cDNA,反转录体系如下:1 μL总RNA、1 μL 5×gDNA Eraser Buffer、1 μL gDNA Eraser、6 μL RNase free ddH2O,42 ℃孵育2 min。在上述体系中加4 μL 5×PrimerScript Buffer、1 μL RT Primer mix、1 μL PrimerScript RT Enzyme mixI、10 μL Reaction mix before,最后加RNase free ddH2O至20 μL,37 ℃孵育15 min,85 ℃孵育5 s,置于4 ℃保存。取cDNA,配制如下体系:2 μL上游和下游引物、5 μL cDNA模板、0.4 μL DYE Ⅱ、10 μL 2×SYBR RT-PCR mix,最后加ddH2O至20 μL。置于PCR仪中,设置程序为:95 ℃ 30 s(预变性),95 ℃ 5 s(变性),60 ℃退火延伸,循环40次。结果以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为参照,以2-△△Ct法计算SLC8A1-AS1的表达。
1.4 细胞转染和分组将心肌H9C2细胞分成以下几组。(1)Control组:正常培养。(2)LPS组:实验0 h时用10 mg·L-1的LPS处理培养。(3)Vector+LPS组:实验前12 h,在细胞中转染阴性对照表达载体;实验0 h时,用10 mg·L-1的LPS处理培养。(4)SLC8A1-AS1+LPS组:实验前12 h,在细胞中转染SLC8A1-AS1过表达载体;实验0 h时,用10 mg·L-1的LPS处理培养。细胞转染方法按照Lipofectamine 2000转染试剂说明书进行。取培养12 h后的Control、LPS、Vector+LPS、SLC8A1-AS1+LPS组细胞,按照1.3中qRT-PCR方法检测SLC8A1-AS1的表达。
1.5 ELISA法检测细胞分泌的IL-1β、IL-6、TNF-α水平收集培养12 h后的Control、LPS、Vector+LPS、SLC8A1-AS1+LPS组细胞培养液上清,分别用ELISA法检测培养液上清中IL-1β、IL-6、TNF-α含量,按照检测试剂盒的说明书进行检测。
1.6 NF-κB信号激活剂PMA对SLC8A1-AS1影响心肌细胞的作用检测取转染SLC8A1-AS1过表达载体以后的心肌细胞,用10 mg·L-1的LPS和1 μmol·L-1的NF-κB信号激活剂PMA处理培养,记为SLC8A1-AS1+LPS+PMA组,以SLC8A1-AS1+LPS组为参照,用ELISA法检测细胞分泌的IL-1β、IL-6、TNF-α水平。

2 结果
2.1 SLC8A1-AS1在脓毒症大鼠心肌组织中表达下调Model组大鼠心肌组织中SLC8A1-AS1表达低于Normal组(P<0.05)。SLC8A1-AS1在脓毒症大鼠心肌组织中表达下调。见表1。
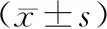
表1 脓毒症大鼠心肌组织中 SLC8A1-AS1表达变化
2.2 SLC8A1-AS1过表达载体上调脓毒症心肌细胞模型中SLC8A1-AS1表达与Control组比较,LPS组心肌细胞中SLC8A1-AS1表达降低(P<0.05)。与Vector+LPS组比较,SLC8A1-AS1+LPS组心肌细胞中SLC8A1-AS1表达升高(P<0.05)。见表2。
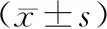
表2 SLC8A1-AS1过表达载体转染后脓毒症心肌细胞模型中SLC8A1-AS1表达
2.3 上调SLC8A1-AS1对脓毒症心肌细胞模型炎症因子分泌的影响与Control组比较,LPS组心肌细胞分泌的IL-1β、IL-6、TNF-α增多(P<0.05)。与Vector+LPS组比较,SLC8A1-AS1+LPS组心肌细胞分泌的IL-1β、IL-6、TNF-α减少(P<0.05)。见表3。
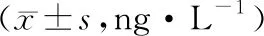
表3 上调SLC8A1-AS1后脓毒症心肌细胞模型分泌IL-1β、IL-6、TNF-α水平
2.4 上调SLC8A1-AS1对脓毒症心肌细胞模型NF-κB信号的影响与Control组比较,LPS组心肌细胞中p65蛋白表达升高(P<0.05)。与Vector+LPS组比较,SLC8A1-AS1+LPS组心肌细胞中p65蛋白表达降低(P<0.05)。见图1和表4。

图1 Western blot方法检测上调SLC8A1-AS1对脓毒症心肌细胞模型中p65蛋白表达的影响
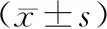
表4 上调SLC8A1-AS1后脓毒症心肌细胞模型中p65蛋白水平
2.5 NF-κB信号激活剂对上调SLC8A1-AS1影响脓毒症心肌细胞炎症因子分泌的作用与SLC8A1-AS1+LPS组比较,SLC8A1-AS1+LPS+PMA组分泌的IL-1β、IL-6、TNF-α水平升高(P<0.05)。见表5。
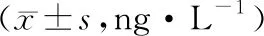
表5 NF-κB信号激活剂对上调SLC8A1-AS1影响脓毒症心肌细胞分泌的IL-1β、IL-6、TNF-α水平
3 讨论
非编码RNA是近些年来生命科学领域中的研究热点,包含lncRNA、miRNA、环状RNA等,其中lncRNA是指长度超过200个核糖核苷酸的非编码RNA,lncRNA在人体组织的各个器官中表达,并且参与多个生理活动,lncRNA与细胞生长、染色质印记、细胞凋亡、炎症等有关[7]。很多研究已经证实,lncRNA调控人类疾病进展,并且lncRNA有望成为疾病治疗的分子靶点[8]。心肌损伤是造成心脏功能异常的关键,其受到lncRNA的调控[9]。有研究显示,SLC8A1-AS1在心肌梗死动物模型中下调,而上调SLC8A1-AS1能够减轻心肌损伤,缩小梗死面积,抑制炎症[5]。本研究结果显示,SLC8A1-AS1在脓毒症大鼠心肌组织中下调。
脓毒症是一种全身系统疾病,病死率和发病率极高,心功能不全、心肌抑制等是脓毒症患者常见的并发症,心肌损伤也是诱导多个器官衰竭的关键因素[10]。研究显示,脓毒症心肌细胞释放大量的炎症因子如IL-1β、IL-6、TNF-α,这些炎症因子可以加重炎症反应,促进炎症损伤,另一方面还可以激活细胞凋亡,促进心肌细胞损伤[11]。本研究表明,LPS诱导的体外脓毒症心肌细胞分泌的IL-1β、IL-6、TNF-α增多,而上调SLC8A1-AS1能够减弱LPS对心肌细胞的上述作用,这说明SLC8A1-AS1具有抑制体外脓毒症炎症因子释放的作用。
lncRNA发挥作用的机制较为复杂,目前尚未完全阐明,其可以通过作用于下游基因或信号通路的转导而发挥多重生物学功能[12]。NF-κB作用复杂,具有多向转录调节作用,在哺乳动物体内广泛存在,参与免疫反应、肿瘤生长、炎症反应、细胞凋亡等多个过程[13]。NF-κB家族庞大,其中p65是NF-κB信号发挥作用的关键亚单位[14]。研究报道,NF-κB过度激活加重心肌细胞损伤,而抑制NF-κB信号能够减弱心肌损伤[15]。本研究结果显示,上调SLC8A1-AS1能够降低体外脓毒症心肌细胞模型中p65蛋白表达,而NF-κB信号激活剂逆转了上调SLC8A1-AS1对体外脓毒症心肌细胞炎症因子释放的作用,上调SLC8A1-AS1通过NF-κB信号发挥作用。
综上,SLC8A1-AS1在脓毒症心肌细胞损伤中可能发挥保护作用,上调SLC8A1-AS1抑制体外脓毒症心肌细胞炎症因子释放,这与下调NF-κB信号有关。目前尚未分析SLC8A1-AS1通过何种靶向机制影响NF-κB信号发挥作用,在以后研究中会对这部分内容进行探讨。本研究为靶向基因治疗脓毒症心肌损伤提供了思路,为研究SLC8A1-AS1在心脏疾病中的作用奠定了基础。

