复合诱变选育高产α-环糊精葡萄糖基转移酶的菌株及产酶条件优化
陶大炜,张小丹,宁喜斌,2,3,4*,孙梦洁
1(上海海洋大学 食品学院,上海,201306) 2(上海水产品加工及贮藏工程技术研究中心,上海,201306) 3(农业部水产品贮藏保鲜质量安全风险评估试验室(上海),上海,201306) 4(国家淡水水产品加工技术研发分中心(上海),上海,201306)
环糊精通常由6个以上D-吡喃葡萄糖基通过α-1,4-糖苷键相连而成,由于葡萄糖基个数的不同,又被分为α-、β-和γ-环糊精三种,其中α-环糊精有6个葡萄糖基,β-环糊精有7个,而γ-环糊精有8个[1]。环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase,CGTase)是一种典型的淀粉分解酶,可对淀粉等物质进行降解,使葡萄糖基团发生转移,从而获得环糊精[2]。环糊精分子具有的外表亲水、内里疏水的中空圆筒结构,使得环糊精可以包络不同化合物,从而改变它们物理和化学性质,例如抗氧化、避免热分解、提高物质的溶解度和稳定性等,因此环糊精可以被广泛地应用于食品工业、农药、化妆品、医药、环保、化学分析与检测等诸多领域里[3-6]。CGTase可广泛应用于多种反应:环化、歧化、耦合和水解反应,其中前3种为转糖基反应,环糊精由于其高效的转糖基反应而具有广阔的工业运用价值[7-8]。紫外线(ultraviolet,UV)可穿透细菌细胞直接作用于DNA,使得碱基无法正常配对,从而产生基因突变,其具有成本低、操作简便、高突变率、高安全性等特点[9]。微波作为一种高频率(300 MHz~3 000 GHz)电磁波,具有设备简单、操作简便和安全可靠的诱变特点。微波诱变可通过引起极性分子的剧烈震动,使菌悬液内DNA分子间强烈摩擦,细菌DNA结构发生变化,发生遗传变异的可能[10]。
目前国内报道的关于此类酶的诱变育种与培养基优化等方面,多为物理-化学复合诱变,未见紫外-微波复合诱变方法[11-13]。国内外报道的产α-CGTase菌株酶活力较低[14-16]、热稳定性较差[17-19]。本试验在前期菌株筛选的基础上,使用紫外-微波复合诱变菌株,研究菌株的最适诱变条件后筛选出酶活力高且遗传性状稳定的菌株,结合Plackett-Burman试验及Box-Behnken中心组合试验2种方法优化菌株发酵条件,旨在高效地提高出发菌株PaenibacillusmaceransTLLY7的产酶能力,为进一步工业化开发利用性状稳定且高产α-CGTase的菌株提供借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
α-环糊精葡萄糖基转移酶产生菌株P.maceransTLLY7,由本实验室自行筛选鉴定,-80 ℃冰箱甘油管保存[20]。其生理生化特性为可水解淀粉、葡萄糖产酸产气、硝酸盐还原试验阳性,吲哚试验、分解酪氨酸试验阴性等。菌株PCR扩增产物经测序得到的16S rRNA序列为1 480 bp,经构建系统发育树后,与P.maceransNBRC 15307T(NR112729.1)在同一分支上,同为类芽孢杆菌属,结合形态学、生理生化鉴定确定菌株TLLY7为浸麻类芽孢杆菌(P.macerans),菌株的核酸序列通过Bankit向GenBank申请的登录号为MT705866。该菌株产酶的酶活力为1.35 U/mL,其最适反应温度为50 ℃、最适反应pH值为6.0,并且在40~45 ℃、pH 6.0~9.0稳定性良好。
1.1.2 试剂
酵母浸粉、可溶性淀粉、蛋白胨等,上海生工生物工程有限公司;α-环糊精,Sigma(上海)公司;NaCl、K2HPO4·3H2O、MgSO4·7H2O、Na2CO3、酚酞、甲基橙及其他试验所用试剂均为分析纯。
1.1.3 培养基
筛选培养基(g/L):可溶性淀粉10,蛋白胨5,酵母浸粉5,琼脂15,NaCl 5,Na2CO31,K2HPO4·3H2O 1,MgSO4·7H2O 0.5,酚酞 0.3,甲基橙 1,自然pH,121 ℃,0.1 MPa灭菌20 min。
种子及发酵培养基(g/L):可溶性淀粉10,蛋白胨5,酵母浸粉5,NaCl 5,K2HPO4·3H2O 1,MgSO4·7H2O 0.5,pH 7.0,121 ℃,0.1 MPa灭菌20 min。
斜面培养基(g/L):蛋白胨10,牛肉膏3,NaCl 5,琼脂 15,pH 7.0,121 ℃,0.1 MPa灭菌20 min。
1.2 主要仪器与设备
UV-1800PC紫外可见分光光度计,上海美谱达仪器有限公司;立式高压蒸汽灭菌锅,上海申安医疗器械厂;超净工作台,苏净集团安泰公司;台式pH精密测试仪,德国WTW公司;高速台式离心机,上海安亭科学仪器厂。
1.3 试验方法
1.3.1 生长曲线的测定
接种5 mL菌株TLLY7种子液至100 mL/250 mL发酵培养基中,在37 ℃,160 r/min下培养,每隔4 h取样,在波长600 nm下测定吸光度,绘制菌株生长曲线。
1.3.2 酶活力测定
制备粗酶液:发酵培养基装液量50 mL/250 mL,菌种接种量为体积分数4%的种子培养基,37 ℃、160 r/min摇床培养48 h,于10 000 r/min离心10 min后所得上清液即为粗酶液。
采用甲基橙褪色法测定酶的环化活力。在酸性(pH 1.1~1.4)条件下,α-环糊精与甲基橙发生反应,形成络合物,使溶液的吸光度下降。在一定范围内,吸光度的下降与α-环糊精的浓度存在着线性关系[21]。用浓度为50 mmol/L Na2HPO4-NaH2PO4缓冲液(pH 6.0)配制40 g/L的可溶性淀粉溶液做底物,取0.9 mL于试管中,加入适当稀释的粗酶液0.1 mL,均匀混合。50 ℃水浴反应10 min,加入浓度为1 mol/L HCl溶液1 mL中止反应。再加入浓度为0.1 mmol/L甲基橙溶液1 mL,于20 ℃静置15 min,507 nm测定吸光度[22]。对应α-环糊精标准曲线计算浓度,酶活力单位(U)定义为上述条件下每分钟生成1 μmol α-环糊精所需的酶量。
1.3.3 菌悬液的制备
在100 mL/250 mL的发酵培养基中接种活化完成的菌株种子液(4%,体积分数)作为发酵液。取处于对数生长后期的发酵液,于10 000 r/min离心10 min,弃上清液收集菌体。用无菌生理盐水充分振荡洗涤后,离心2 min弃去上清液,重复2~3次后用生理盐水重新悬浮菌体,所得即为菌悬液。用显微镜进行观察计数,适当稀释后使菌液浓度在108CFU/mL左右。
1.3.4 紫外诱变
1.3.4.1 紫外诱变条件的确定
选用的功率为20 W紫外灯,设置其与培养皿间距30 cm。预热紫外灯30 min后,吸取10 mL菌悬液加入到直径9 cm的无菌空培养皿中,分别照射10、20、30、40、50、60、70、80、90、100 s,并用磁力搅拌器搅拌均匀。对紫外诱变后的菌悬液梯度稀释,吸取100 μL稀释度为10-4、10-5、10-6的稀释液至筛选培养基中,涂布均匀,37 ℃避光倒置培养48 h,进行菌落计数[9]。挑选出长势良好的单菌落,发酵培养并分别测定酶活力,计算正突变率。取未经诱变处理的等浓度菌悬液作为对照组,对致死率进行计算。根据致死率和正突变率确定紫外诱变的最佳时间。按公式(1)(2)计算致死率和正突变率:

(1)

(2)
1.3.4.2 紫外诱变选育高酶活力菌株
对菌株TLLY7在最佳的紫外诱变条件下进行诱变,并测定平板中长势良好的菌株酶活力,得到酶活力较高的菌株做进一步研究。
1.3.5 微波诱变
1.3.5.1 微波诱变条件的确定
选用额定功率为700 W,脉冲频率为2 450 MHz的微波炉。吸取1 mL菌悬液至2 mL离心管中,将离心管放在盛有蒸馏水的烧杯中,每隔15 s换1次水,以减少微波的热效应造成菌悬液温度过高而导致菌体大量死亡。使用低火档,辐照时间依次为15、30、45、60、75、90 s,并对微波诱变后的菌悬液梯度稀释,吸取100 μL稀释度为10-4、10-5、10-6的稀释液至筛选培养基中,涂布均匀,37 ℃避光倒置培养48 h,进行菌落计数[10]。挑选出长势良好的单菌落,发酵培养并分别测定酶活力,计算正突变率。取未经诱变处理的等浓度菌悬液作为对照组,计算致死率。根据致死率和正突变率确定微波诱变的最佳时间。
1.3.5.2 微波诱变选育高酶活力菌株
对经紫外诱变后得到的高酶活力菌株UV2-10在最佳微波诱变条件下进行诱变,并对平板中长势良好的菌株进行酶活力测定,得到酶活力较高的菌株做进一步研究。
1.3.6 突变菌株遗传稳定性的测定
对经复合诱变处理后选取的高酶活力菌株UM2-6连续传代8次培养,每代菌株均测酶活力,考察其遗传的稳定性。
1.3.7 复合诱变菌株产α-CGTase条件的优化
在前期单因素试验的基础上,对复合诱变菌株UM2-6的产酶条件进行优化,通过Plackett-Burman(PB)试验对显著因素进行筛选,再中心组合Box-Behnken(BBD)设计响应面试验,以获得最优产酶条件。
1.3.7.1 PB试验设计
选取影响产酶的9个因素进行考察,分别为可溶性淀粉含量、酵母浸粉含量、培养温度、初始pH、NaCl含量、接种量、CaCl2含量、装液量、K2HPO4·3H2O含量,以酶活力(Y)为响应值,进行PB试验设计(N=12),记低水平为-1,高水平为+1。此外K为虚拟因素,用来考察实验误差。PB试验设计的因素与水平见表1。
1.3.7.2 响应面试验设计
利用PB设计试验筛选出的3个显著性因素,即培养温度(A)、初始pH(B)、接种量(C),采用BBD中心组合设计,以A、B、C为自变量,以酶活力(Y)为响应值设计3因素3水平试验。中心组合试验方案中的因素及水平见表2,使用Design-Expert 8.0.6进行分析处理数据。

表1 Plackett-Burman设计变量Table 1 Process variables used in Plackett-Burman design

表2 响应面试验因素与水平Table 2 Factors and levels of response surface experiments
2 结果与分析
2.1 菌株TLLY7的生长曲线
图1为菌株的生长曲线。从培养8 h开始,菌株TLLY7的菌体数快速增长,并在24 h后逐渐缓慢增长并趋于稳定,40 h后菌体逐渐走向衰亡。
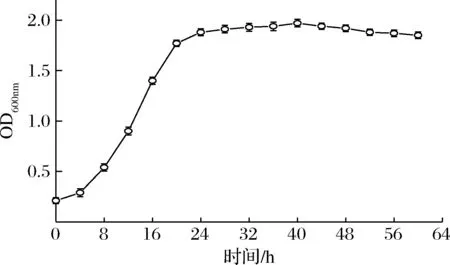
图1 菌株TLLY7的生长曲线Fig.1 The growth curve of strain TLLY7
2.2 α-环糊精的标准曲线
根据标准方法绘制α-环糊精标准曲线。拟合线性回归方程:y=0.546 1x-0.000 8,R2=0.999 1,表明线性良好。
2.3 物理诱变
2.3.1 紫外诱变的致死率和正突变率
图2反映了紫外诱变时间与菌株致死率和正突变率的关系。菌株致死率随着紫外线照射时间的延长而逐渐升高,当紫外线照射时间为100 s时,紫外诱变菌株致死率接近100%。在0~70 s时,菌株正突变率随着紫外线照射时间的延长也在不断升高。当紫外线照射时长为70 s时,菌株正突变率最高,为21.42%,此时菌株致死率为80.95%。近年来许多学者的研究表明,正向突变的菌株较多出现在致死率为80%左右,结合致死率和正突变率曲线,确立菌株TLLY7的紫外诱变的最佳时间为70 s,这与前人研究中的致死率选择相近[23-24]。
2.3.2 紫外诱变选育高酶活力菌株
对菌株TLLY7进行紫外诱变后,得到共计56株诱变菌株。挑选出长势较好的菌株19株进行发酵复筛,得到高酶活力诱变菌株UV2-10,菌株酶活力由初始的1.35 U/mL提高到2.27 U/mL。表3为部分紫外诱变菌株的酶活力测量值。
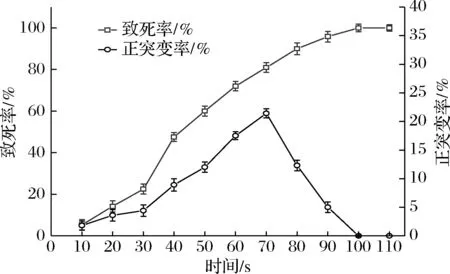
图2 紫外诱变的致死率和正突变率Fig.2 Lethal rate and positive mutation rate of ultraviolet mutagenesis

表3 紫外诱变菌株的筛选结果Table 3 Screening results of ultraviolet mutagenesis strains
2.3.3 微波诱变的致死率和正突变率
图3反映了微波诱变时间与菌株致死率和正突变率的关系。菌株致死率随着微波辐照时间延长而逐渐升高,当微波辐照时间为105 s,致死率为100%。在0~60 s时,菌株正突变率随着微波辐照时间的延长也在不断升高,当微波诱变时间为60 s,致死率为77.36%,此时正突变最高,为23.61%。结合致死率和正突变率曲线,确立最佳微波诱变时间为60 s。
2.3.4 微波诱变选育高酶力菌株
对菌株UV2-10进行微波诱变后,得到共计72株诱变菌株。挑选出长势较好的菌株31株进行发酵复筛,得到高酶活力复合诱变菌株UM2-6,酶活力由2.27 U/mL提高到3.09 U/mL。表4为部分微波诱变菌株的酶活测量值。
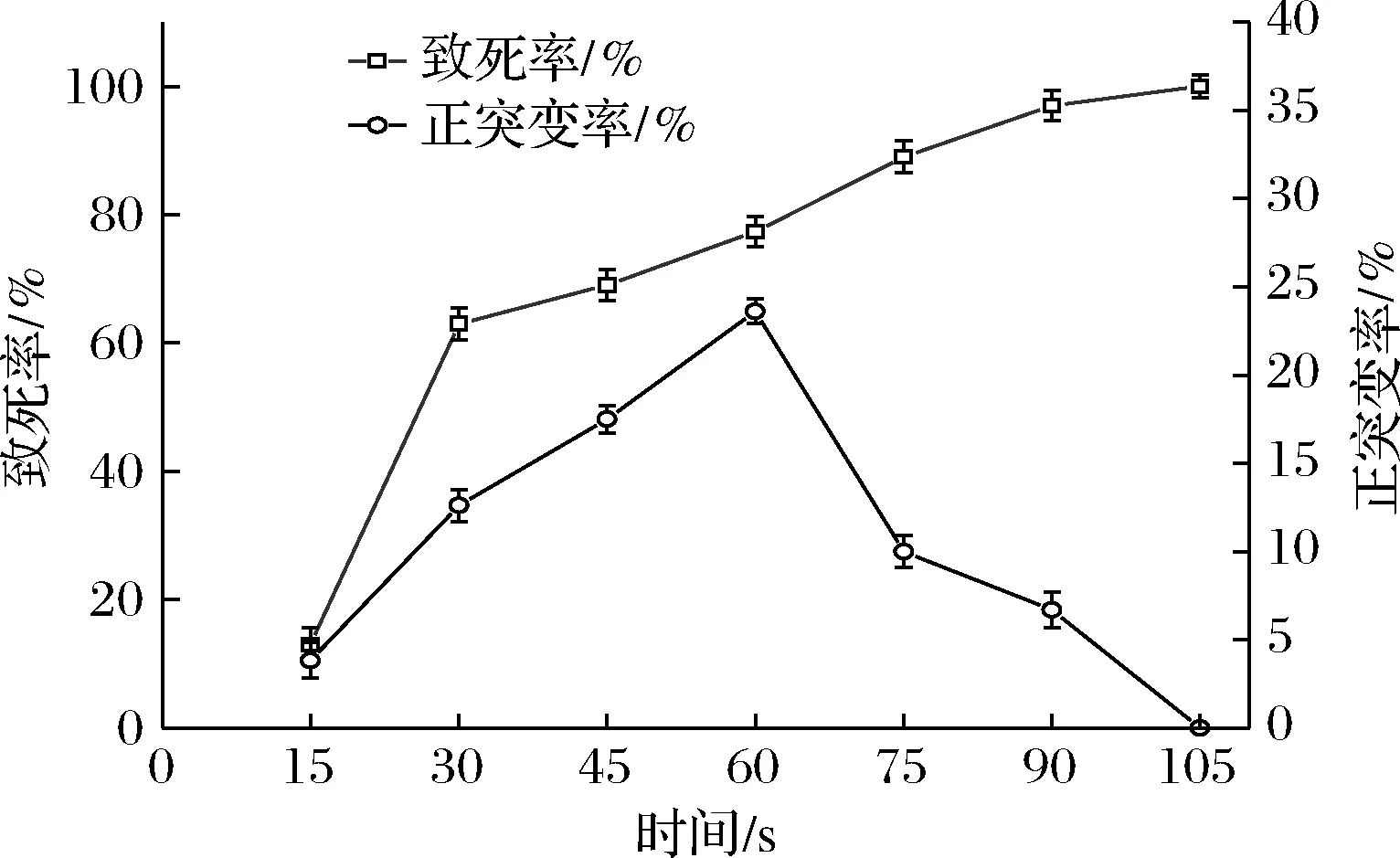
图3 微波诱变的致死率和正突变率Fig.3 Lethal rate and positive mutation rate of microwave mutagenesis

表4 微波诱变菌株的筛选结果Table 4 Screening results of microwave mutagenesis strains
2.3.5 复合诱变菌株UM2-6遗传稳定性的测定
对复合诱变菌株UM2-6进行连续传代8次,测定各代菌株产α-CGTase酶活力,结果见表5。复合诱变菌株UM2-6产酶活力比较稳定,没有显著变化,说明遗传性能稳定,具有进一步研究的价值。

表5 突变株UM2-6各代产α-CGTase活力Table 5 α-CGTase activity produced by mutant UM2-6 of every generation
2.4 突变菌株UM2-6产酶条件的优化
2.4.1 PB试验设计与显著性因素筛选结果
前期通过单因素试验已分析出9个影响菌株产酶的因素,分别为可溶性淀粉含量、酵母浸粉含量、培养温度、初始pH、NaCl含量、接种量、CaCl2含量、装液量、K2HPO4·3H2O含量。在此基础上,对这9个因素进行PB试验设计(N=12),以考察各因素对菌株产酶能力的影响,并筛选显著性影响因素,对试验设计结果进行主效应分析,结果见表6。筛选出的显著因素分别为培养温度、初始pH、接种量,P值分别为0.033、0.034、0.045,均小于0.05。
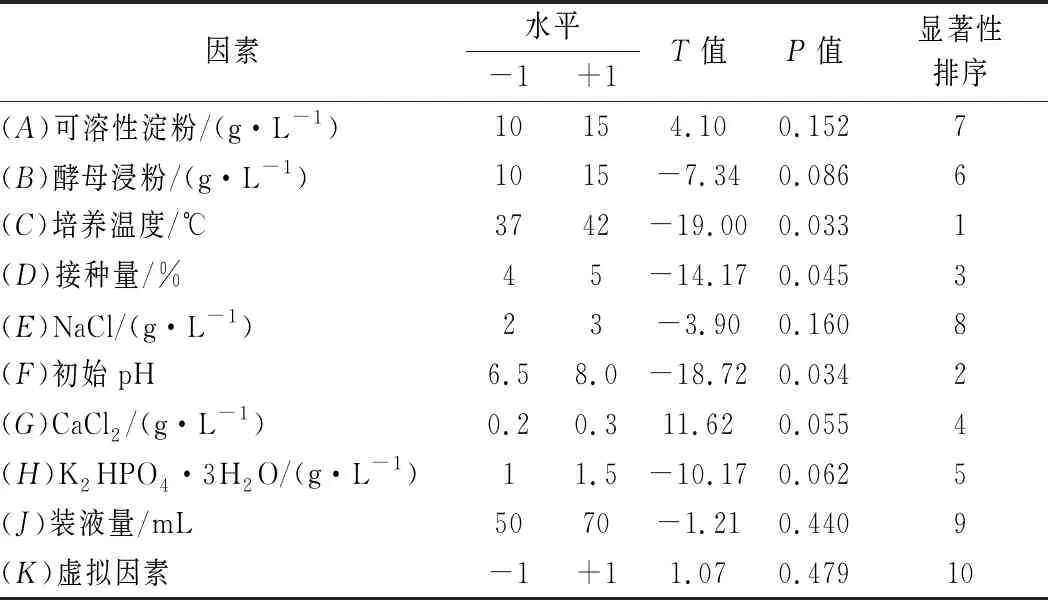
表6 Plackett-Burman设计的各因素水平及主效应分析Table 6 Factors,levels and significance analysis of Plackett-Burman design
2.4.2 响应面设计与结果分析
2.4.2.1 BBD试验设计结果与回归模型的方差分析
以培养温度(A)、初始pH(B)、接种量(C)为考察因素,响应值为酶活力(Y),设计响应面试验,并对试验结果的数据进行多元回归拟合,得到模型的二次回归方程:
Y=4.11+0.031A+0.31B-0.081C+0.015AB+0.027AC+0.040BC-0.45A2-0.22B2-0.84C2
式中:Y,α-CGTase的预测酶活力(U/mL);A、B、C,分别代表培养温度(℃)、初始pH、接种量(%)。

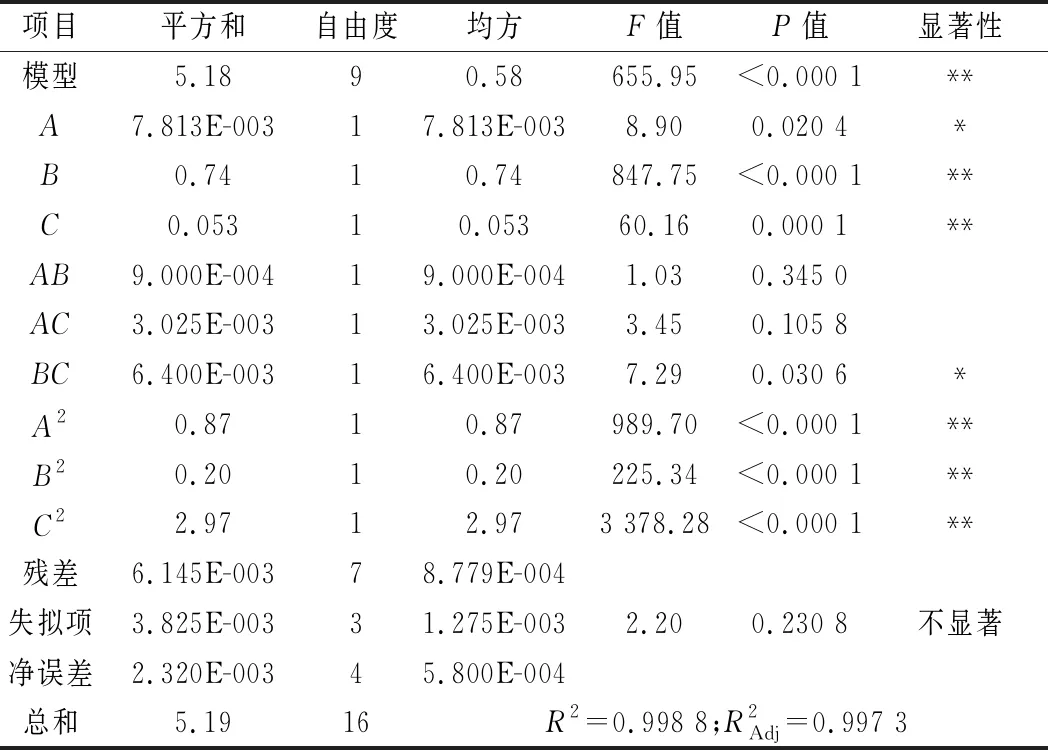
表7 回归模型的方差分析Table 7 Variance analysis of regression model
2.4.2.2 响应面曲线及等高线分析
图4为通过Design-Expert软件分析出3种显著性影响因素的响应面曲线和等高线。
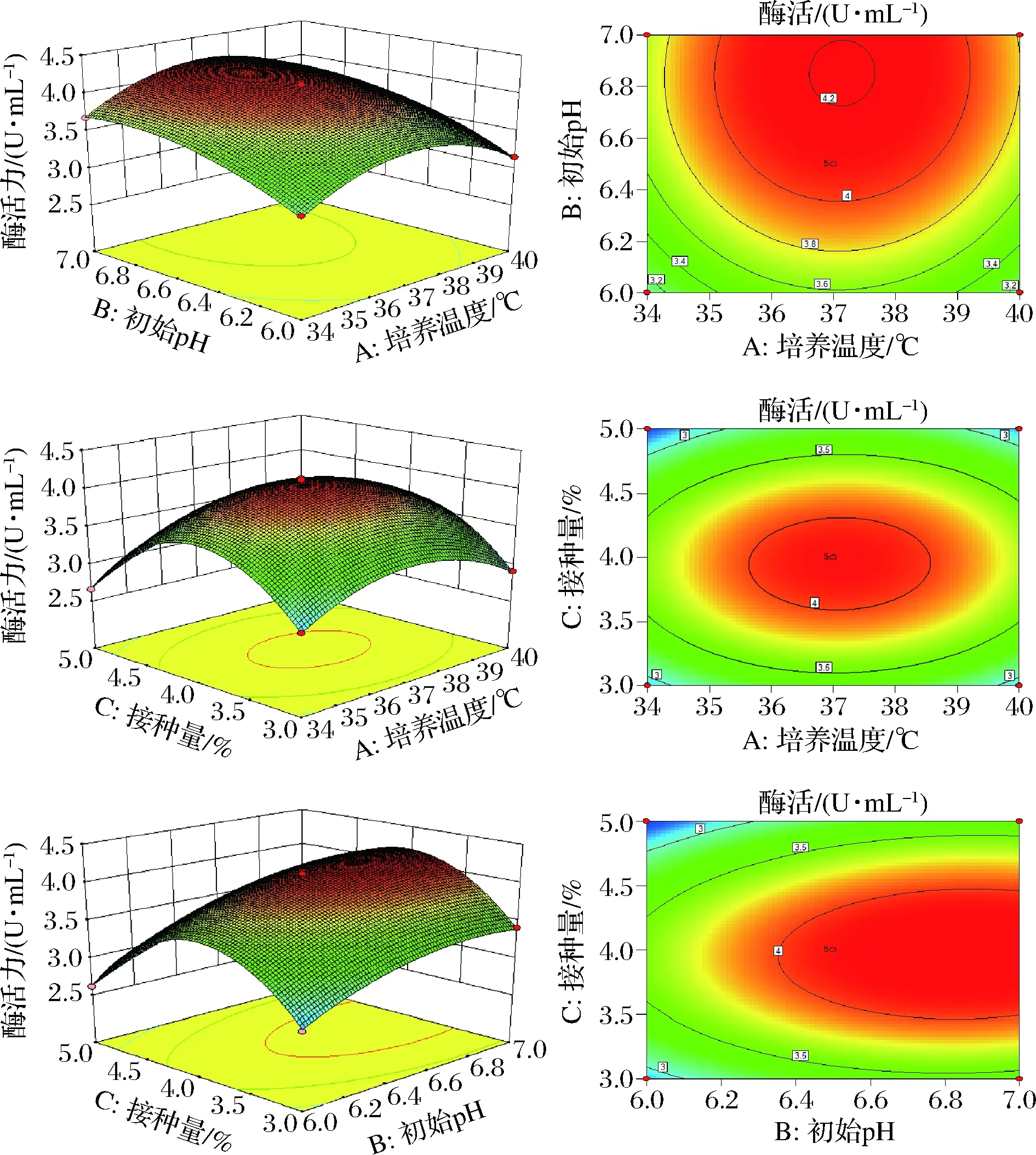
图4 培养温度、初始pH、接种量交互作用对酶活力影响的响应面曲线及等高线Fig.4 Response surface plots and contour line of effects of interaction between temperature,initial pH and inoculum on enzyme activity
各因素的响应面曲线皆呈抛物线形状,且开口向下,表明存在响应最大值。等高线的形状与响应面曲线的陡缓程度可反应因素交互作用的强弱,响应面曲线越陡,因素间的交互作用就越显著;响应面曲线越平滑,因素间的交互作用越小。若等高线呈椭圆形,表明因素间的交互作用较显著;等高线呈圆形,表明因素间交互作用不显著[25-26]。则根据图4的结果,说明B和C交互作用显著,A和B、A和C交互作用不显著。
2.4.3 验证实验
利用Design-Expert 8.0.6分析得到影响α-CGTase酶活力的最佳条件理论值为培养温度37.13 ℃,初始pH 6.85,接种量3.97%,理论最高酶活力为4.22 U/mL。考虑到实际操作,调整最佳条件为培养温度37.1 ℃,初始pH 6.9,接种量4.0%,测得α-CGTase酶活力为4.19 U/mL,证实了响应模型的有效性,说明经优化所得的最佳条件可信。优化前的发酵条件为:可溶性淀粉10 g/L、蛋白胨5 g/L、酵母浸粉5 g/L、NaCl 5 g/L、K2HPO4·3H2O 1 g/L、MgSO4·7H2O 0.5 g/L、初始pH 7.0、培养温度37 ℃、接种量4%、装液量50 mL/250 mL,突变菌株UM2-6产α-CGTase的酶活力为3.09 U/mL,优化之后的酶活力为优化之前的1.36倍,氮源、金属离子及其他条件的改变有效地提升了该菌株的产酶能力。
3 结论与讨论
本研究对α-环糊精葡萄糖基转移酶产生菌株P.maceransTLLY7进行了紫外-微波复合诱变,并对所得复合诱变菌株UM2-6的发酵条件进行优化,显著提高菌株产酶水平。确定了紫外、微波复合诱变的最佳诱变条件,其中紫外诱变的最佳诱变条件为:紫外线照射70 s,致死率为80.95%,此时菌株正突变率最高,为21.42%,经过筛选后得到酶活力最高的菌株UV2-10,酶活力为2.27 U/mL;微波诱变的最佳诱变条件为:低火档辐照60 s,致死率为77.36%,此时菌株正突变最高,为23.61%,将紫外诱变所得菌株UV2-10进行微波诱变处理,经过筛选后得到复合诱变菌株UM2-6,其酶活力为3.09 U/mL。在前期单因素试验的基础上,通过PB试验设计筛选出培养温度、初始pH、接种量3个显著因素,再用BBD试验确定最佳发酵条件。结果表明,最佳发酵培养基成分为可溶性淀粉10 g/L、酵母浸粉10 g/L、NaCl 2 g/L、CaCl20.2 g/L、K2HPO4·3H2O 1 g/L,最佳发酵条件为培养温度37.1 ℃、初始pH 6.9、接种量4%。在此优化条件下,突变菌株UM2-6产α-CGTase的酶活力为4.19 U/mL,为优化之前酶活力(3.09 U/mL)的1.36倍。
陈龙然[16]通过紫外-硫酸二乙酯复合诱变地衣芽孢杆菌(Bacilluslicheniformis),再通过单因素试验和正交试验优化诱变株产α-CGTase的发酵条件,其酶活力达2.28 U/mL,是出发菌株(0.95 U/mL)的2.4倍。雷新辉等[27]通过紫外-亚硝酸复合诱变产酸克雷伯氏菌(Klebsiellaoxytoca),诱变株产α-CGTase酶活力达3.76 U/mL,是出发菌株(0.62 U/mL)的5.06倍。上述研究中,发酵优化后的菌株酶活力均不及本研究中经复合诱变和产酶条件优化后所得菌株酶活力。陈龙军等[12]利用基因工程技术将嗜热芽胞杆菌(Gebacilliussp.)异源表达后,利用单因素试验优化发酵条件,其产α-CGTase酶活达5.3 U/mL,是野生菌(0.66 U/mL)的8倍。本研究的野生菌株的酶活力高于此研究中野生菌株的酶活,但是突变菌株低于其经产酶基因异源表达后基因工程菌的酶活力。为进一步提高酶活力,仍需要通过对菌株产酶基因进行克隆表达或对目的基因片段进行蛋白质工程改良等基因工程技术,而筛选出酶活力高、性质优良的出发菌株是这些方法的基础。本研究为实验室后期提高酶活力等试验奠定了基础,为工业生产α-CGTase及应用提供了参考。

