Hippo信号通路与心脏病
Hippo信号通路是一种信号级联反应,最初在果蝇中发现[1]。在哺乳动物中,Hippo信号通路由丝氨酸/苏氨酸激酶级联反应、转录共激活因子和转录因子构成。在激酶级联反应中,STE20样激酶1/2(MST1/2)与适配蛋白Salv相互作用后使Salv、大肿瘤抑制基因1/2(LATS1/2)和单极纺锤体(Mps1)相关粘合蛋白1(MOB1)等蛋白磷酸化,促进LATS1/2与MOB1结合,磷酸化的LATS1/2在多个位点上分别磷酸化转录共激活因子、Yes相关蛋白(YAP)、突触后致密蛋白95(PSD)、discs大蛋白(DLG)和闭合小带蛋白1(ZO-1)、结合基序转录共激活因子(TAZ),使YAP和TAZ结合物滞留于细胞质,随后泛素化降解。上游激酶失活则会导致YAP和TAZ的核易位,在细胞核中YAP和TAZ可与SV40增强子结合并能激活DNA结合基序(TEA)结构域家族成员1-4(TEAD1-4)等多个转录因子相互作用,活化下游靶基因,激活细胞增殖、存活和分化等功能[2]。研究表明,Hippo信号通路失调与肥胖、2型糖尿病、非酒精性脂肪肝、心血管疾病以及肿瘤相关[3]。
1 Hippo信号通路的调控
微环境氧变化可调控细胞Hippo信号通路。当组织处于低氧状态时,E3泛素连接酶SIAH2通过降解LATS2抑制Hippo信号通路,活化YAP[4]。Elosegui-Artola等[5]认为机械传导机制通过调节核孔对分子的传输,影响YAP的亚细胞定位。细胞内基质使细胞核与基质无接触,细胞核不承受压力时,核孔对YAP的转入和转出处于平衡状态。而细胞内坚硬的基质会增加细胞核与细胞骨架的接触面积,形成局部黏连和纤维张力。细胞核承受压力时可变形为扁平状,核膜表面的核孔拉伸,减少了对分子蛋白质酶传输的限制,促进YAP转运至核内。
研究表明纤连蛋白的粘附刺激作用可通过粘着斑激酶(FAK)-类固醇受体共激活因子(Src)-磷脂酰肌醇3-激酶(PI3K)信号通路负调控Hippo信号通路,促使YAP核内聚集,并抑制FAK、Src、PI3K或磷酸肌醇依赖蛋白激酶-1(PDK1)以阻断纤连蛋白粘附引起的YAP核内聚集[6]。Crumbs家族成员3(CRB3)通过不同机制调控Hippo信号通路,减少细胞增殖,促进细胞凋亡。CRB3作为Hippo信号通路的上游调控因子使MST1/2、LATS1和MOB1磷酸化,继而使YAP磷酸化停留于细胞质[7]。另一种调控机制需要血管动力蛋白家族成员Amot、Amotl1和Amotl2参与,它们作为连接蛋白可使CRB3与YAP/TAZ形成复合物,将YAP/TAZ定位于细胞质而抑制YAP/TAZ转录活性[8]。Amot、Amotl1和Amotl2还能使LATS1/2自身磷酸化,并作为一种骨架蛋白将上游Salv-MST1和下游YAP连接起来,最终使YAP/TAZ磷酸化停滞于细胞质[9]。
2 Hippo信号通路参与心肌细胞凋亡和再生
Hippo信号通路和肌营养不良糖蛋白复合物(DGC)通过协同抑制YAP核转位及转录活性,阻止心肌细胞增殖。DGC是一种跨膜复合物,其中营养不良聚糖蛋白1(Dag1)可直接与YAP结合抑制心肌细胞增殖。Hippo信号通路诱导YAP 磷酸化,进一步促进YAP与Dag1的结合。敲除Salv基因的新生小鼠在心尖切除术后,心肌细胞可有效再生;而Salv和dgc双敲除小鼠,心尖切除部位心肌细胞过度增殖,心尖部位再生[10]。细胞外基质在调节新生心肌细胞增殖和分化中也发挥了重要作用。Agrin是新生小鼠心脏完全再生的必要蛋白。体外实验中,重组Agrin蛋白以剂量依赖形式促进由人或小鼠多能干细胞诱导的心肌细胞分裂[11]。
配对同源结构域2蛋白(Pitx2)-YAP相互作用是维持成年小鼠心肌组织损伤后心肌细胞修复能力的关键[12]。缺乏Pitx2的新生小鼠在心尖切除术后心脏无法修复,而成年小鼠发生Pitx2过表达能使心肌梗死后的心肌细胞有效再生。Pitx2与YAP共同作用可诱导抗氧化基因表达,保护受损的心肌。即使细胞核中YAP低表达,Pitx2也能募集YAP促进靶基因的转录。Ragni等[13]研究表明当Hippo激酶缺陷,调控Fat4(一种非经典的钙粘蛋白Fat)通路可促进心肌细胞增殖。Fat4是YAP上游调节因子,可将Amotl1与YAP隔离在细胞连接处,防止心脏过度生长。缺乏Fat4时,Amotl1与YAP复合物释放并转移到细胞核。这一过程绕过了Hippo上游激酶,触发了非经典途径Hippo信号通路。
细胞骨架蛋白广泛表达神经纤维蛋白2 (NF2),参与缺血/再灌注(I/R)损伤后MST1和LATS2介导的心肌细胞凋亡。I/R损伤后,NF2通过活化MST1抑制YAP核转移增加心肌细胞凋亡。特异性敲除NF2的小鼠,在I/R损伤后心脏YAP表达水平上调,可促进心功能恢复。而NF2和YAP双敲除小鼠不能修复I/R引起的心肌受损[14-15],表明Hippo信号通路可能作为NF2的下游靶点,参与I/R损伤。视神经萎缩蛋白1(OPA1)是结合在线粒体内膜的融合蛋白,褪黑素通过活化YAP可促进与OPA1相关线粒体的融合,改善I/R引起的损伤[16]。I/R损伤可引起线粒体MST1活化,继而促进Bcl-xL磷酸化,使Bcl-xL与Bax解离,心肌细胞凋亡。抑制内源性MST1可以显著减轻I/R诱导的心肌细胞凋亡和心肌损伤[17]。因此,抑制Hippo信号通路活化以及通过非经典途径激活YAP可能是心肌损伤后促进心肌细胞增殖、再生,以及提高心功能的潜在治疗靶点。
在缺血性心力衰竭患者的心脏中,YAP和TAZmRNA表达水平均增高,且细胞核中YAP、TAZ和TEAD蛋白表达均显著高于正常心脏[18]。说明缺血性心力衰竭患者心脏组织中YAP和TAZ均处于过度活化状态,YAP可能是今后研究心脏再生和心肌受损后功能恢复的重点。
3 Hippo信号通路参与心肌肥厚
心脏急性压力超负荷可过度激活内源性YAP,YAP敲除小鼠在主动脉缩窄术(TAC)1周后表现出心肌肥厚减少、心肌细胞凋亡增加、心肌细胞纤维化加剧和心功能恶化[19]。因此,心脏急性压力超负荷急性期内源性YAP可能介导了心肌肥厚及心肌细胞存活。Ikeda等[20-21]研究表明YAP过表达对心肌细胞无保护作用。通过高脂饮食诱导肥胖、2型糖尿病和高血压等代谢综合征小鼠模型,采用TAC形成长期(12周)心脏急性压力超负荷,在心脏组织中可观察到YAP持续活化,但YAP通过YAP-TEAD1-抑瘤素M(OSM)正反馈机制可使心肌细胞去分化,促使心肌细胞收缩力减弱,导致心力衰竭。
心肌细胞的数量增加可导致核内YAP上调引起的心脏肥厚。Tian等[22]研究表明,微小RNA(miRNA)302-367长期过表达抑制了Hippo信号通路上游激酶MST1和LATS2激活,促进核内YAP表达,诱导心肌细胞去分化和功能障碍。Monroe等[23]通过基因重编程诱导成年小鼠心肌细胞中YAP过表达,使心肌细胞部分接近于胎儿的增殖状态,基因重编程小鼠较对照组左室室壁增厚,左室室腔减小,心肌细胞数量显著增加,心肌细胞形态减小。
4 Hippo信号通路参与心脏纤维化
Hippo信号通路参与心脏纤维化的病变。在成纤维细胞中细胞外基质促进YAP核转运,机械性压力可活化YAP,提高纤维介质和细胞外基质蛋白表达,形成纤维组织与YAP相互作用导致纤维化的正反馈回路[24]。Zhang等[25]研究表明,YAP与转录因子SMAD3结合促进心脏结缔组织生长因子表达,导致细胞外基质主要成分Ⅰ型和Ⅲ型胶原沉积,促进心脏纤维化。心血管系统存在内源性SO2生成系统,可以促进血管扩张,抑制炎性反应,改善心血管系统的胶原重构。给予糖尿病大鼠SO2,可减轻心肌纤维化,可能是通过抑制MST1改善细胞凋亡和内质网应激[26]。
5 Hippo信号通路参与心肌梗死
Hippo信号通路可通过调节心肌梗死后炎性反应和重构,促进心功能恢复。心肌梗死后心外膜中YAP与TEAD结合可促进IFN-γ表达,促进调节性T细胞(Treg)募集,在心肌受损后修复中起重要作用。成年小鼠心外膜如YAP/TAZ表达不足,受损心肌Treg及IFN-γ表达减少,心肌梗死后可出现严重心室纤维化和心包炎,而给予心肌梗死小鼠IFN-γ,可逆转YAP/TAZ缺陷引起的Treg表达减少以及心肌纤维化,表明心外膜Hippo信号通路在心肌梗死恢复期适应性免疫调节中起关键作用[27]。给予新生小鼠Toll样受体3(TLR3)配体可显著提高心肌细胞糖酵解代谢、YAP活化以及心肌细胞增殖,其机制是糖酵解促进LATS和腺苷酸激活蛋白激酶去磷酸化而失活,最终导致YAP核转位并与TEAD结合调控miR-152表达,而miR-152通过抑制细胞周期抑制p27kip1和DNA甲基转移酶的表达,促进细胞增殖[28]。通过心肌细胞缺氧建立心肌梗死模型,心肌梗死后MST1的转录和表达明显升高,MST1缺失能降低心肌细胞炎性反应,活化血红素氧合酶-1,减少缺氧介导的心肌细胞死亡率。心肌梗死时激活Hippo信号通路通过抑制血红素氧合酶-1促进心肌细胞炎性反应,提高心肌细胞活力,减少心肌梗死后炎性反应,可为心肌梗死治疗提供潜在靶点[29]。
6 小结
Hippo通路通过调控心肌细胞的增殖和凋亡,影响心肌损伤修复和心衰的发展。YAP作为Hippo通路的下游信号能介导心脏功能,可成为心脏疾病重要的潜在治疗靶点,见图1。心肌肥厚和心肌纤维化等心脏疾病目前尚无确切疗效的治疗药物,新药研发和miRNA干扰生物技术的发展可能是希望所在。
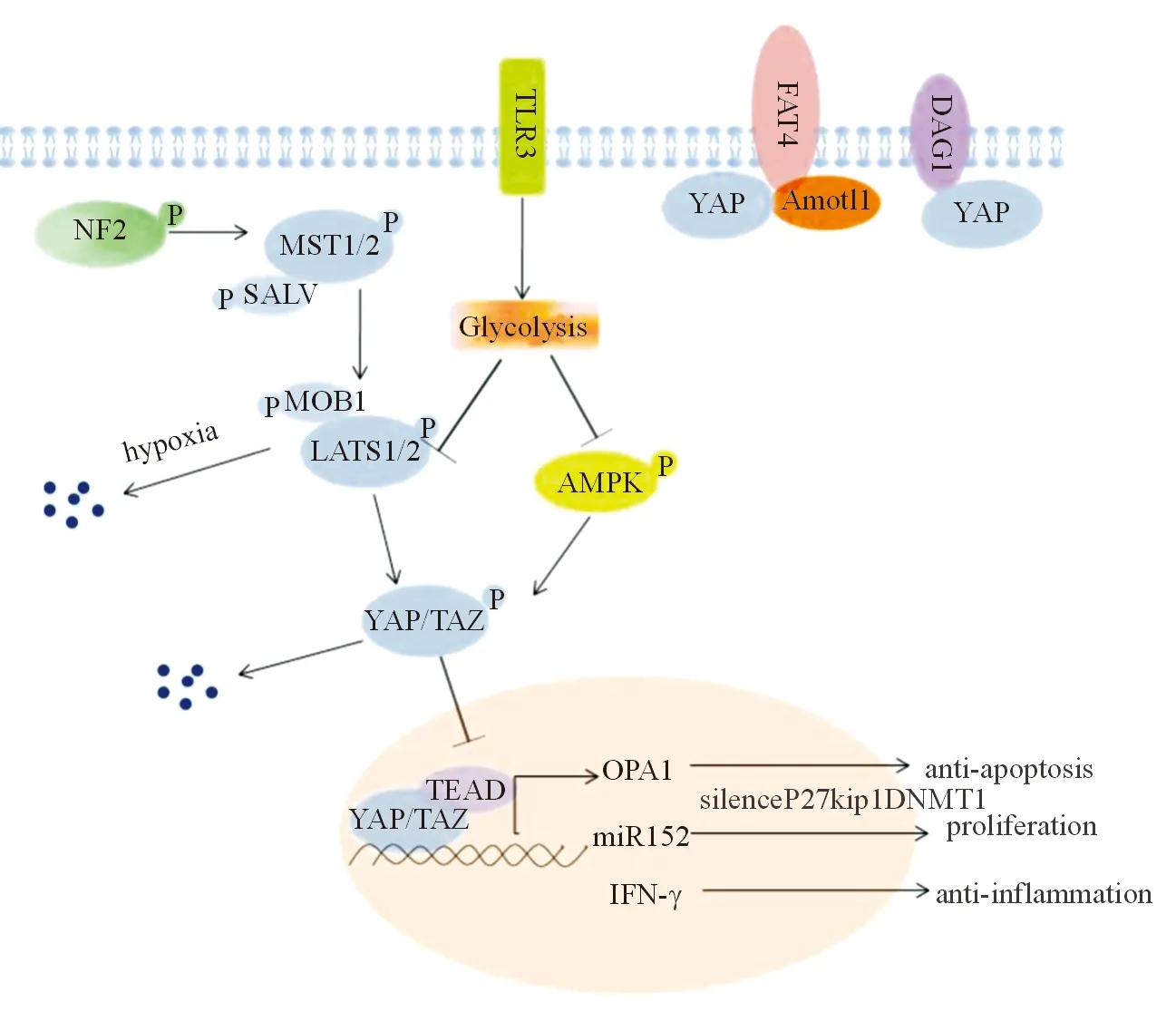
图1 哺乳动物Hippo信号通路

