扩张型心肌病大鼠心肌细胞亚细胞器超微结构分析
扩张型心肌病(DCM)患者主要以心腔扩大、心肌收缩功能减退为特征,临床常表现为进行性心力衰竭[1-2]。心肌细胞是心脏收缩和舒张的基本结构单元,由细胞膜结构、肌纤维、细胞核、线粒体等多种细胞器构成。多种原因导致心肌重构时,这些亚细胞器会出现一系列改变,使细胞出现功能紊乱[3]。了解心肌细胞亚细胞器的超微结构变化与细胞功能的关系及其在DCM发生、发展中的作用,对DCM的早期诊断和治疗具有重要意义。
1 材料与方法
1.1 材料与试剂
60只3周龄SPF级雄性Wistar大鼠,体质量(50±5)g,购自北京维通利华实验动物技术有限公司,质量合格证号为11400700277616,饲养于河南中医药大学细胞成像实验室动物中心,实验动物使用许可证号为SYXK(豫)2016-0009。本实验遵守国家有关实验动物保护和实验准则。
1.2 实验分组与模型制备
按随机编号方法在Wistar大鼠尾部标号,分为正常组(n=10)和DCM组(n=50)。正常组不进行干预,给予基础饮食;DCM组每日给予70%呋喃唑酮溶液诱导DCM模型,连续给药10周后进行超声心动仪检测。
1.3 超声心动图检测
采用小动物超声心动仪,将超声探头放在大鼠乳头肌水平处,获取大鼠胸骨左室长轴切面视野图,M超测量线放在乳头肌后缘,切换M超视野,测量和计算左室收缩末期内径(LVESD)、左室舒张末期内径(LVEDD)、左室缩短分数(LVFS)、左室射血分数(LVEF)。1位专业超声人员对所有大鼠进行检测,测量3个心动周期,每个指标取平均值。
1.4 透射电子显微镜观察亚细胞器超微结构
取出心脏,迅速剪取左心室心尖部位小块心肌组织,切成3~4个1 mm×1 mm×1 mm的组织标本,立即放入2.5%戊二醛固定液,固定4 h,换液,1%锇酸固定2 h,磷酸盐缓冲液(0.1 mol/L,pH=7.2)冲洗3次,15 min/次,用梯度浓度30%、50%、70%、80%、90%、100%的酒精脱水,15 min/次,常规树脂包埋,超薄切片,醋酸铀-枸橼酸铅双染色,透射电子显微镜下观察并拍照。
1.5 统计学分析
数据采用SPSS 21.0统计学软件进行分析,符合正态分布的数据以均数±标准差表示,多组间比较用单因素方差分析,方差齐时两组间比较采用LSD法检验,方差不齐时两组间比较采用Tamhane′s法检验。P<0.05为差异具有统计学意义。
2 结果
2.1 两组心脏超声结果比较
采用高分辨率的小动物超声探头测定各组大鼠心脏结构和功能的变化。与正常组比较,DCM组的LVESD和LVEDD明显增加,LVFS和LVEF显著降低(P均<0.05),见图1、表1。

图1 正常组和DCM组超声心动图结果

表1 两组大鼠超声心动图检测结果比较
2.2 正常组心肌细胞亚细胞器超微结构
正常组心肌细胞肌丝排列整齐,线粒体呈线状排列在肌丝束间,肌小节及其Z线清楚可见;闰盘弯曲走行,其近旁的肌浆有糖原颗粒及少量囊泡存在,嵌于闰盘网的肌丝清晰可见;肌原纤维呈规则的带状结构;核染质颗粒分布较均匀,脂滴适量,溶酶体小且少见,见图2。

图2 正常心肌细胞超微结构(×12 000)
2.3 DCM组心肌细胞核结构变化
DCM组心肌细胞核增大且较长,核周间隙明显增宽。见图3。
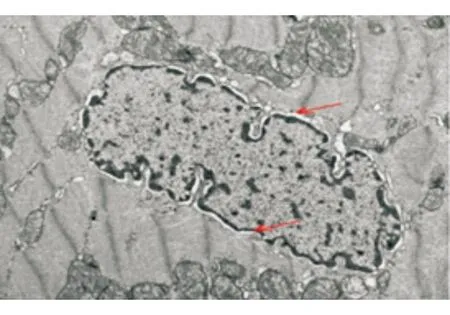
注:DCM大鼠心肌细胞核增大;红色箭头所指为核周间隙图3 DCM大鼠心肌细胞核超微结构(×12 000)
2.4 DCM组心肌细胞线粒体结构变化
DCM组心肌细胞线粒体数量异常增多,聚集成簇,线粒体基质内有钙盐样致密颗粒沉积;线粒体出现高度肿胀、嵴断裂或消失、空泡化。见图4。
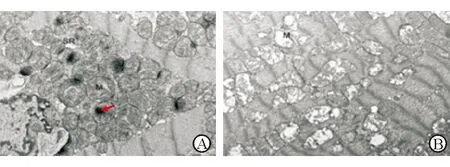
注:A示心肌细胞线粒体数量增多,聚集成簇,红色箭头所指为线粒体基质内钙盐样致密颗粒沉积;B示线粒体形态变化,M为线粒体图4 DCM大鼠心肌细胞线粒体超微结构(×12 000)
2.5 DCM组心肌细胞闰盘结构变化
DCM组闰盘的中间连接及桥粒结构模糊,间隙增宽,亦可见线粒体肿胀、空泡化。见图5。

注:红色箭头所指为闰盘中间连接;M为线粒体;ID为闰盘图5 DCM大鼠心肌细胞闰盘超微结构(×12 000)
2.6 DCM组内质网和溶酶体结构变化
内质网由片状和管状两种结构连接组成,如图6所示。DCM组片状内质网主要分布在细胞核周区域,向内与外核膜相连;管状内质网则通常连接形成网络结构。DCM组细胞中溶酶体异常增大,且附近有散在糖原颗粒。
2.7 DCM组横管和肌质网结构变化
DCM组心肌细胞膜深入肌细胞内形成的横管,横靠心肌纤维Z线,与心肌细胞肌质网分支互相吻合,网孔明显增大。DCM组横管结构发生破坏,肌原纤维和线粒体亦出现紊乱。见图7。

注:A为×12 000;B为×36 000,B是图A中红框放大所示,红色箭头所指为溶酶体,RER为粗面内质网图6 DCM大鼠心肌细胞内质网和溶酶体超微结构
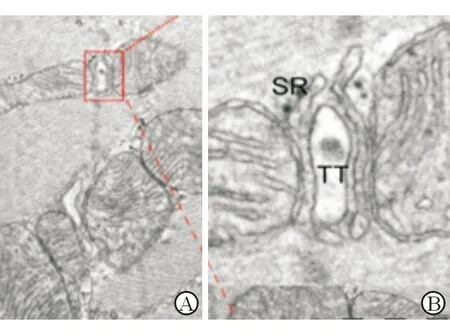
注:A为×30 000;B为×90 000,是图A中红框放大所示,SR为肌质网,TT为横管图7 DCM大鼠心肌细胞横管和肌质网超微结构
3 讨论
对充血性心力衰竭不同动物模型的研究发现,细胞内各种亚细胞器损伤及细胞器之间的联系失衡可引起细胞损伤,导致心脏结构和功能失代偿,引发心力衰竭[4]。
线粒体是心肌细胞内的产能细胞器。心肌肥大时,先出现线粒体肥大,它的改变早于肌原纤维的肥大[5-6]。随着疾病进一步发展,线粒体出现肿胀、空泡化,进而出现功能障碍,引起细胞能量代谢紊乱,最终导致DCM的发生。本研究观察到DCM大鼠心肌细胞线粒体增生,数量异常增多,聚集成簇,线粒体出现肿胀变形、嵴断裂消失及空泡化现象。线粒体的结构损伤使膜通透性增大,导致线粒体膜功能障碍。闰盘主要由桥粒、中间连接和缝隙连接组成,其在心肌细胞的电、机械和代谢耦联中发挥重要作用[7]。本研究发现DCM大鼠闰盘的中间连接及桥粒结构模糊。闰盘中间连接增宽,可使心肌细胞收缩减弱,破坏细胞间的机械-电耦合,促使心肌间质纤维化发生,导致DCM。内质网应激(ERS)的发生常早于基因转录水平的细胞核反应和代谢水平的线粒体反应,持续而严重的ERS可触发细胞凋亡,造成细胞损伤[8-9],引起DCM。溶酶体作为一种膜包裹的囊状细胞器,通过自噬降解受损的细胞器,调节底物供应以维持心肌能量,从而维持正常的心脏功能和心肌细胞稳态[10-11]。研究表明,心肌细胞横管重构在心肌肥大代偿期即已发生[12-13]。本研究观察到DCM大鼠横管结构发生破坏,溶酶体异常增大,肌原纤维出现排列紊乱,随着DCM发展,溶酶体和横管结构紊乱加重。
心肌细胞及其亚细胞器超微结构的改变早于心脏收缩功能障碍,深入了解心肌细胞超微结构变化和影响心肌细胞亚细胞器稳态的相关调控蛋白作用,可为DCM临床诊治提供新思路。

