血管紧张素Ⅱ受体1型-钙调神经磷酸酶信号通路对乳鼠肥大心室肌细胞L型钙离子流的调控作用
心肌异常肥大导致的心室重构是慢性充血性心力衰竭(CHF)发生、发展主要的病理生理机制[1]。恶性室性心律失常导致的心源性猝死是CHF患者的主要死亡原因[2]。后除极是恶性室性心律失常的主要促发机制,L型钙离子通道电流(ICa-L)的增强是诱发后除极,尤其是早期后除极的始动因素[3-4]。血管紧张素Ⅱ受体1型(AT1R)-钙调磷酸酶(CaN)信号通路在心肌细胞肥大及伴随的离子通道重构的调控中有重要作用[5-7]。但该信号通路对肥大心室肌细胞ICa-L的调控作用尚不清楚。
1 材料与方法
1.1 主要试剂和仪器
苯肾上腺素(PE)、胎牛血清(FBS)、高糖DMEM培养基和胰蛋白酶购自Gibco公司。5-溴脱氧尿嘧啶核苷(5-Brdu)、氯沙坦(Los)、环孢素A(CsA)、苯肾上腺素(PE)和Ⅱ型胶原酶购自Sigma公司。兔源钙CaN A亚基β亚单位(CaNAβ)抗体购自德国Merck Millipore公司,鼠源GAPDH抗体购自上海康成生物公司。BCA蛋白质定量试剂盒购自北京中杉金桥公司。其他试剂均为国产分析纯以上级别。Bio-Rad 550酶标仪、Bio-Rad化学发光仪购自Bio-Rad公司。PCR仪购自加拿大MJ Research公司。电极拉制仪(PP830型)购自日本Narishige公司。膜片钳放大器(Axopatch700B)及附件购自美国Axon公司。
1.2 实验动物
1 d龄SD大鼠乳鼠,雌雄不限,清洁级别,由斯贝福(北京)实验动物科技有限公司提供,许可证号SCXK(京)2016-0006。
1.3 乳鼠心室肌细胞分离培养及分组
分离乳鼠心室,剪碎,消化(胰蛋白酶终浓度0.1%、Ⅱ型胶原酶终浓度0.03%)细胞。采用差速贴壁分离技术,得到纯化的心室肌细胞[7]。于37 ℃、5%CO2培养箱中培养。
心室肌细胞培养24 h,更换含5%FBS的DMEM培养基,据干预方式不同分为4组:对照组细胞不予干预;PE组细胞常规培养1 h后予终浓度为0.1 mmol/L的PE干预24 h;Los+PE组先予1 μmol/L Los干预1 h,再予终浓度为0.1 mmol/L的PE干预24 h;CsA+PE组先予0.25 μg/ml CsA干预1 h,再予终浓度为0.1 mmol/L的PE干预24 h。
1.4 心室肌细胞肥大刺激有效性鉴定
实时荧光定量聚合酶链反应(qRT-PCR)测定心室肌细胞肌球蛋白重链(β-MHC)的mRNA表达水平。β-MHC引物序列:上游5′-CTCCCTCAAGCTCCTAAGTAATC-3′,下游5′-ACACGGTCTGAAAGGATGAG-3′。GAPDH引物序列:上游5′-GGGAAACCCATCACCATCTT-3′,下游5′-CCAGTAGACTCCACGACATACT-3′。反应条件:95 ℃预变性10 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环。以2-ΔΔCt计算各组样品间表达水平的相对差异。
1.5 Western blot检测心室肌细胞CaNAβ的蛋白表达水平
提取心室肌细胞总蛋白,测定蛋白浓度。取40 μg总蛋白上样,电泳后转移蛋白至NC膜上,5%脱脂牛奶封闭1 h。加兔抗大鼠GAPDH抗体(1∶1 000)、兔抗大鼠CaNAβ抗体(1∶500),4 ℃孵育过夜。充分漂洗后,加入辣根过氧化酶标记的二抗室温孵育1 h。充分漂洗后显影,Bio-Rad化学发光仪进行检测。利用ImageJ专业图像分析软件对发光条带半定量测定,以GAPDH为内参,计算蛋白的相对表达水平。
1.6 全细胞膜片钳检测心室肌细胞ICa-L和动作电位
玻璃微电极与细胞形成高阻抗封接、破膜,全细胞膜片钳记录ICa-L离子电流。ICa-L去极化阶跃方案:设置钳制电压为-80 mV,脉冲刺激波宽为500 ms,刺激频率为0.1 Hz,刺激电压从-40 mV开始,每次增加10 mV,直至最大刺激电压+50 mV。采用电流密度分析以避免细胞大小造成的误差。电流密度=电流强度/电容(pA/pF)。电流信号经特制银/氯化银(Ag/AgCl)电极引导,由膜片钳AXON 700B放大器放大,通过模-数转换/数-模转换(AD/DA转换)后存储于计算机中。实验过程由pCLAMP 10.0软件程序进行刺激发放和信号采集。
应用全细胞膜片钳技术中的电流钳模式,予1 nA电流脉冲,波宽5 ms,引发心房肌细胞动作电位。记录动作电位并分析动作电位时程(APD)的时程。
1.7 统计学分析
采用pCLAMP 10.0软件进行数据和图形转换;运用SigmaPlot软件绘制离子通道电流密度-电压曲线。用SPSS 19.0软件对数据进行统计分析。数据以均数±标准差表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组β-MHC的mRNA表达水平比较
4组间β-MHCmRNA表达水平的差异有统计学意义(F=82.932,P<0.001)。组间两两比较显示,PE组β-MHCmRNA表达水平较对照组明显升高;Los+PE组和CsA+PE组β-MHCmRNA表达水平较PE组均明显下降(P均<0.05),见表1。
2.2 各组CaNAβ的蛋白表达水平比较
4组间CaNAβ蛋白表达水平的差异有统计学意义(F=180.209,P<0.001)。组间两两比较显示,PE组CaNAβ蛋白表达水平较对照组明显升高;Los+PE组和CsA+PE组CaNAβ蛋白表达水平较PE组均明显下降(P均<0.001),见表1、图1。

表1 各组心室肌细胞β-MHC mRNA和CaNAβ蛋白表达水平比较
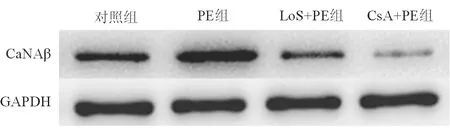
图1 各组乳鼠心室肌细胞CaNAβ蛋白表达水平
2.3 各组乳鼠心室肌细胞ICa-L比较
图2 为各组心室肌细胞ICa-L峰值电流原始图,图3为ICa-L电流密度-电压曲线图。ICa-L表现为内向电流,PE组电流密度-电压曲线较对照组下移,而Los+PE组和CsA+PE组电流密度-电压曲线较PE组上移,较对照组下移。统计分析发现,在-20 mV~+40 mV各级刺激电压水平,PE组ICa-L电流密度绝对值均大于对照组(P均<0.01),Los+PE组和CsA+PE组ICa-L电流密度绝对值均小于PE组(P均<0.05)。在钳制电压为0 mV时,各组内向ICa-L电流皆达峰值,各组间总体差异有统计学意义(F=48.547,P<0.001)。组间ICa-L峰值电流密度绝对值比较显示,PE组较对照组显著增大[(-18.23±1.44)pA/pF对(-10.78±1.87)pA/pF,P<0.001],Los+PE组[(-14.02±1.51)pA/pF]和CsA+PE组[(-12.19±1.09)pA/pF]较PE组均显著减小(P均<0.001)。

图2 各组心室肌细胞L型钙电流峰值电流原始图
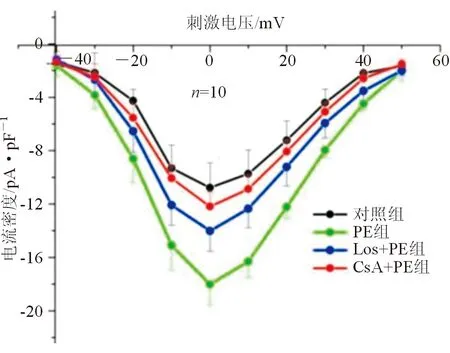
图3 各组心室肌细胞L型钙电流电流密度-电压曲线图
2.4 各组乳鼠心室肌细胞动作电位比较
无论是APD50还是ADP90,4组间差异均有统计学意义(F=28.976和70.437,P均<0.001)。组间两两比较显示,PE组APD50和APD90均大于对照组(P均<0.001);而Los+PE组、CsA+PE组的APD50和APD90均小于PE组(P均<0.05)。见表2、图4。

表2 各组心室肌细胞动作电位时程的比较

图4 各组心室肌单细胞动作电位代表图
3 讨论
ICa-L是动作电位2期的主要内向电流,其与以钾离子(K+)电流为主的外向电流相互平衡,形成动作电位的平台期,对细胞APD起重要作用。生理状态下,平台期内向钙离子(Ca2+)增加,对细胞质肌浆网Ca2+大量释放、启动心肌细胞兴奋-收缩耦联起着决定性作用。然而,在心肌疾病如心肌肥大、心肌炎、心力衰竭时,平台期内向Ca2+的增加是触发早期后除极的直接、主要因素[3-4]。同时,在动作电位复极晚期细胞内Ca2+超负荷可激活非特异性阳离子通道和Ca2+-钠离子(Na+)交换泵,增加细胞内阳离子浓度,诱发晚期后除极[4]。早期后除极和晚期后除极易诱发室性早搏和室性心动过速,是导致心源性猝死的主要心电学机制[8-9]。
研究发现,CaN参与心肌肥大和心肌细胞多种离子通道重构的调控,并受AT1R信号的上游调控[5-7,10],但未见AT1R-CaN信号通路对Ca2+通道重构调控的相关报道。仅有研究显示,激活培养的心肌细胞CaN,能够增强心肌细胞膜L型钙离子通道活性[11]。
本研究采用CaN的经典抑制剂CsA对心室肌细胞进行干预,评估充分抑制CaN活性对ICa-L的影响。结果显示CsA能抑制PE刺激的CaN主要功能结构CaNAβ蛋白的表达;同时,CsA干预能够明显抑制PE诱导的心室肌细胞肥大基因β-MHCmRNA表达和心室肌细胞膜ICa-L电流密度的增加,提示CaN信号参与PE对肥大心室肌细胞ICa-L的调控。本研究结果还显示,给予AT1R特异性阻滞剂Iso干预,也能明显抑制PE诱导的心室肌细胞CaNAβ蛋白表达和肥大基因β-MHCmRNA表达,并且抑制PE刺激导致的ICa-L电流密度增加效应,提示AT1R作为CaN的上游信号,可通过调控CaN的表达参与PE对肥大心室肌细胞ICa-L的调控。
单细胞动作电位分析显示,PE干预导致心室肌细胞APD50和APD90值显著延长;而Los和CsA干预明显抑制PE对APD的延长作用。PE干预激活CaN,增大ICa-L电流密度,使得细胞动作电位2期内向阳离子流增加,故而APD延长。CaN激活进而增大ICa-L电流密度的机制目前仍不完全清楚。有研究显示,活化的CaN能够与L型钙离子通道的α1.2亚基结合,激活该离子通道,增大ICa-L电流密度[11];此外,该现象尚可能与构成L型钙离子通道的功能亚基的表达上调有关[12]。
综上所述,本研究结果显示AT1R-CaN信号通路参与乳鼠肥大心室肌细胞ICa-L和APD的调控。

