Tip60 蛋白在子宫内膜腺癌组织中的表达及其临床意义
文爱平 ,罗 乐 ,孟志伟 ,金景姬 ,周洪贵 ,朱继红
(1.川北医学院附属医院妇产科,四川 南充 637000;2.医学影像四川省重点实验室,四川 南充 637000;3.西藏军区总医院妇产科,西藏 拉萨 850007;4.吉林大学生命科学院 艾滋病国家重点实验室,吉林 长春 130012;5.吉林大学第一医院生殖中心,吉林 长春 130021)
子宫内膜癌是发生于子宫内膜的一组上皮恶性肿瘤,为女性三大恶性肿瘤之一,占女性生殖道恶性肿瘤的20%~30%,其中以子宫内膜腺癌最为常见[1]。近年来国内外研究[2-3]显示:子宫内膜腺癌发病率和病死率明显上升,是严重危害女性健康的恶性肿瘤,且子宫内膜腺癌的发病机制尚不十分清楚。研究[1]显示:子宫内膜腺癌的发病可能与雌激素受体(estrogen receptor,ER),孕激素受体(progesterone receplor,PR),高血压,糖尿病,抑癌基因p53、p16 和E-钙黏素(E-cadherin)突变、失活和癌基因-人类表皮生长因子受体2(Her2/neu)过度表达有密切关联。Tip60 是一种经酵母双杂交筛选得到的低相对分子质量蛋白,又名KAT5 蛋白,是组蛋白(HAT)酶MSYT 超家族成员之一[4],其广泛参与DNA 转录、DNA 损伤修复以及细胞信号传导等细胞过程[5],与肿瘤和炎症等疾病的发生密切相关。研究[6]显示:Tip60 蛋白在前列腺癌组织中表达水平的高低与其发生密切相关。但是关于Tip60 蛋白在子宫内膜腺癌患者癌组织中的表达情况及其临床意义的研究尚未见报道。因此本研究采用免疫组织化学方法检测子宫内膜腺癌患者癌组织和正常子宫内膜组织中Tip60 蛋白的表达水平,分析其与患者临床病理特征的相关性,并进一步探讨其与患者预后的关系。
1 资料与方法
1.1 临床资料选取2012 年1 月—2015 年1 月川北医学院附属医院收治的行标准化手术后经病理确诊为子宫内膜腺癌患者84 例,患者术前均未接受任何治疗(放化疗、生物靶向治疗和免疫治疗等)。患者年龄34~72 岁,平均年龄(54.29±16.21)岁;WHO病理分化程度:G1 组(高分化)35 例,G2 组(中分化)27 例,G3 组(低分化)22 例;FIGO 分期标准(2009 年版):Ⅰ期39 例,Ⅱ期20 例,Ⅲ-Ⅳ期25 例;36 例对照子宫内膜组织来源于因子宫肌瘤切除子宫后的正常子宫内膜组织。本研究经患者知情同意并经川北医学院附属医院伦理委员会批准,伦理批号:2012ER(A)066。
1.2 细胞株和主要试剂人子宫内膜癌细胞株ISHIKAWA(高表达ER)和HEC-1A(低表达ER)均购于上海生命科学院细胞库。兔抗人Tip60单克隆抗体购自英国Abcam 公司,免疫组织化学SP 法试剂盒、DAB 显色试剂盒和苏木素均购自北京中杉金桥生物技术有限公司,高糖DMEM 培养基和胎牛血清均购自美国Gibco 公司,RIPA 细胞裂解液购自杭州四季青公司。
1.3 免疫组织化学SP 法检测人子宫内膜腺癌组织中Tip60 蛋白表达水平将子宫内膜腺癌患者癌组织蜡块和正常子宫内膜组织连续切片,厚度约为4 μm,拷片2 h,修复抗原,经过脱蜡水化,采用免疫组织化学SP 法,严格按照试剂盒说明书操作。加入稀释后一抗Tip60 蛋白4 ℃过夜(稀释比例1∶300),加入二抗37 ℃、1 h,DAB 显色,苏木素复染。用PBS 缓冲液代替一抗作为阴性对照,参照说明书提供前列腺癌阳性作为阳性对照。免疫组织化学SP 法是以高倍镜(×400)下细胞核中出现棕黄色染色作为阳性结果判定(Tip60 蛋白阳性表达位于细胞核)。高倍镜下随机选取3~6 个视野,依据阳性细胞百分比和着色强度双重判定评分,再将两者乘积作为最终评分进行分析统计。①按细胞着色深浅评分:阴性记为0 分,浅黄色记为1 分,棕黄色记为2 分,棕褐色记为3 分。②阳性细胞率<30% 为1 分,30%~70% 为2 分,>70%为3 分。两项评分乘积≥3 分记为阳性表达,<3 分为阴性表达。
1.4 细胞培养人子宫内膜癌ISHIKAWA 和HEC-1A 细胞株使用含10%血清的高糖DMEM 培养基,37 ℃、5%CO2、95%相对湿度条件下培养。2~3 d 更换一次培养基,取对数生长期的细胞,采用RIPA 细胞裂解液提取细胞中的蛋白备用。
1.5 Western blotting 法检测人子宫内膜细胞株中Tip60 蛋白表达水平接种对数生长期的ISHIKAWA 和HEC-1A 细胞于培养皿中,按照RIPA 细胞裂解液说明书提取细胞中的总蛋白,采用考马斯亮蓝法定量细胞总蛋白,取60 μg 总蛋白点样,采用10% SDS-PAGE 电泳分离蛋白,电泳1.5 h 后转移至PVDF 膜上。5%脱脂奶粉室温封闭1 h,4 ℃孵育一抗过夜,以β-actin 作为内参,PBS缓冲液冲洗后加入二抗,37 ℃孵育2 h,电化学发光显影后采集条带图像,采用Image J 软件对蛋白条带进行定量分析。实验重复3 次。
1.6 统计学分析采用SPSS 20.0 统计软件进行统计学分析。各组细胞中Tip60 蛋白表达水平均呈正态分布,以表示,2 组间样本均数比较采用两独立样本t检验。不同组织中Tip60 蛋白阳性表达率组间比较采用χ2检验。采用Kaplan-Meier 绘制生存曲线,采用Log-rank 检验分析Tip60 蛋白表达水平与子宫内膜癌的总生存率的关系。所有均为双侧检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 子宫内膜腺癌患者癌组织和正常子宫内膜组织中Tip60 蛋白阳性表达率显微镜下观察可见Tip60 蛋白在子宫内膜腺癌患者癌组织中的阳性表达定位于细胞核,呈现棕褐色或黄色颗粒。免疫组织化学SP 法检测结果显示:84 例子宫内膜腺癌组织标本中有46 例Tip60 蛋白呈阳性表达,阳性表达率为54.76%(46/84),明显低于正常子宫内膜组织中Tip60 蛋白阳性表达率[83.33%(30/36)](χ2=8.859,P<0.05)。见图1。

图1 子宫内膜腺癌组织和正常子宫内膜组织中的Tip60蛋白表达情况(免疫组织化学法,×200)Fig.1 Expressions of Tip60 protein in endometrial adenocarcinoma tissue and normal endometrial tissue(Immunohistochemistry,×200)
2.2 子宫内膜腺癌患者癌组织中Tip60 蛋白阳性表达率与临床病理特征的关系子宫内膜腺癌患者癌组织中Tip60 蛋白阳性表达率与患者的年龄无关(年龄≥50 岁Tip60 蛋白阳性表达率为60.00%,年龄<50 岁Tip60 蛋白阳性表达率为55.26%)(χ2=1.073,P=0.300);不同分化程度的癌组织中Tip60 蛋白阳性表达率比较差异有统计学意义(χ2=8.692,P=0.013),两两比较不同临床病理分期子宫内膜癌组阳性表达有统计学意义(χ2=13.481,P=0.001)。见表1。

表1 Tip60 蛋白阳性表达率与子宫内膜腺癌患者临床病理特征的关系Tab.1 Relationships between positive expression rates of Tip60 protein and clinicopathological features of endometrial adenocarcinoma patients
2.3 Tip60 蛋白表达与子宫内膜癌患者预后的关系84 例子宫内膜腺癌患者的中位随访时间为58 个 月,Kaplan-Meier 生存分析及Log-rank 检验结果显示:Tip60 蛋白高表达患者生存率明显高于Tip60 蛋白低表达患者(χ2=64.391,P=0.002)。见图2。

图2 Tip60 蛋白表达与子宫内膜癌患者预后的关系Fig.2 Relationship between expression of Tip60 protein and prognosis of endometrial adenocarcinoma patients
2.4 Western blotting 法检测人子宫内膜癌细胞中Tip60 蛋白表达水平人子宫内膜癌ISHIKAWA细胞中Tip60 蛋白表达水平明显高于HEC-1A 细胞(t=6.736,P<0.05)。见图3。
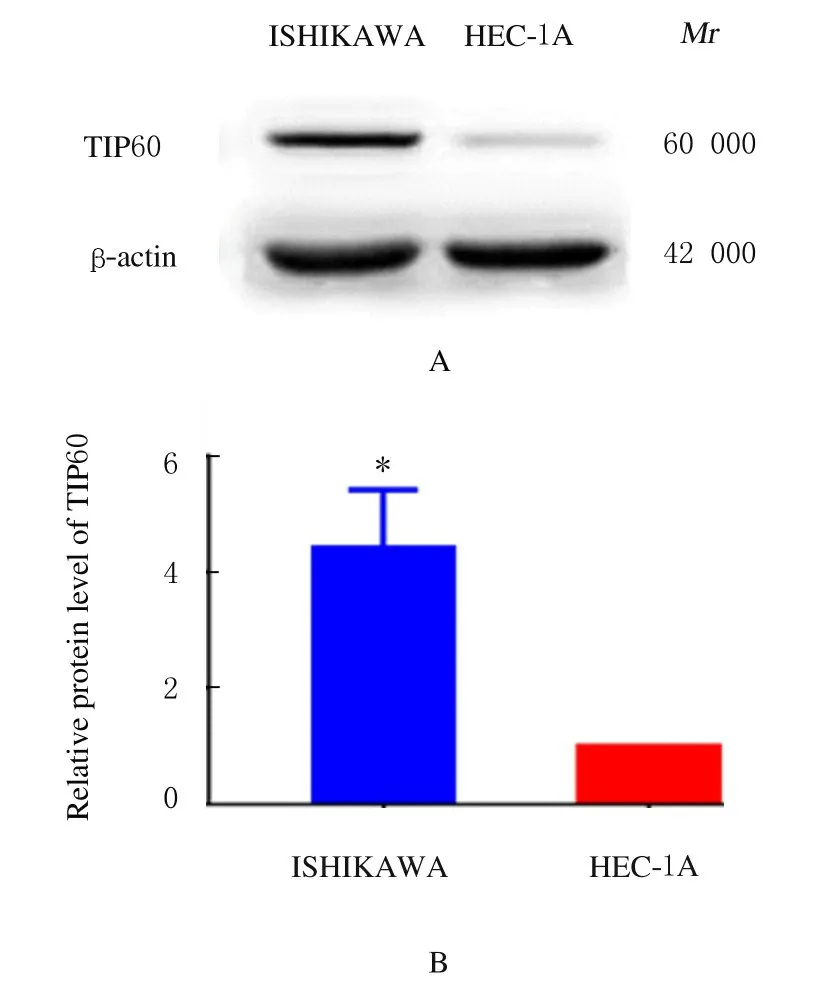
图3 Western blotting 法检测ISHIKAWA 和HEC-1A细胞中Tip60 蛋白表达电泳图(A)和直条图(B)Fig.3 Electrophoregram(A) and histogram(B) of expressions of Tip 60 proteininISHIKAWA and HEC-1A cells detected by Western blotting method
3 讨论
子宫内膜癌是女性常见生殖道恶性肿瘤,虽然多数子宫内膜癌患者因早期具有相关症状而就诊,但由于世界范围内目前其发病率明显上升,导致其病死率呈上升趋势[2-3]。组蛋白乙酰基转移酶Tip60 蛋白在染色体重塑和转录过程中具有重要意义[6],Tip60 蛋白通过调节转录因子E2F 和c-Myc蛋白的活性,从而调控DNA 的转录[7-8];Tip60 蛋白也参与DNA 修复过程,当其作为转录域结构蛋白(TRRAP)的一个辅助因子,通过结合受损的双 链DNA 序列,进而维持DNA 的重塑[9],Tip60蛋白可以通过乙酰化P53 蛋白诱导损伤DNA 的凋亡[10]。目前关于Tip60 蛋白在恶性肿瘤,如黑色素细胞瘤、膀胱癌、食管癌、乳腺癌、胆管癌和卵巢癌组织中低表达的研究均有报道,且与患者的临床分期、淋巴结转移及预后呈负相关关系[11-18]。关于子宫内膜腺癌与Tip60 蛋白表达是否具有相关性目前鲜有报道。
雌激素能够通过作用于ER,调节细胞内钙离子浓度,从而发挥着不同的生物学功能。在长时间雌激素作用下的子宫内膜癌患者,组织中TRPV1等多种蛋白的表达会有一定的变化。子宫内膜癌细胞株ISHIKAWA 是一种经典的高表达ER 的细胞,而HEC-1A 则是一种与低表达ER 的细胞。子宫内膜癌根据其发病机制,分为2 型,Ⅰ型为激素依赖型,最为常见,多为子宫内膜腺癌,预后较好;而Ⅱ型为非激素依赖型,较为少见,多为浆液性乳头癌、未分化癌和透明细胞癌等,预后差。本研究采用Western blotting 法分析显示:高表达ER 的ISHIKAWA 细胞中Tip60 蛋白的表达水平明显高于低表达ER 的HEC-1A 细胞。Tip60 蛋白在高表达ER 的细胞株(Ⅰ型子宫内膜腺癌)中明显上调,提示其与患者预后呈正相关关系。
本研究选取84 例子宫内膜腺癌组织,采用免疫组织化学染色SP 法检测癌组织中Tip60 蛋白的表达,并以正常子宫内膜组织作为对照进行研究,结果显示:癌组织中Tip60 蛋白表达水平较正常内膜组织下调,两者呈负相关关系。本研究结果与CHEN等[11]报道的恶性黑色细胞瘤、MCGUIRE等[14]报道的乳腺癌、ZHANG 等[15]报道的胆管癌和罗乐等[18]报道的卵巢癌组织的研究结果相似,说明Tip60 蛋白可能扮演抑癌基因的角色,并参与调控子宫内膜腺癌的发生发展。ZHANG等[15]研究结果表明:Tip60 蛋白在肝胆管癌(cholangiocarcinoma,CCA)的整个过程中抑制生长和转移。进一步确定PI3K/AKT 通路是Tip60 的主要信号通路,提示Tip60 蛋白通过PT3K-AKT 途径调控CCA 细胞增殖和转移,Tip60 蛋白可能参与调控子宫内膜癌的发生及发展。
本实验研究了Tip60 蛋白与子宫内膜腺癌患者临床特征关系,结果显示:Tip60 蛋白表达与子宫内膜腺癌的分化、FIGO 分期(临床病理分期)及预后具有明显的相关性,即分化程度愈差、临床病理分期愈晚的患者组织中,其阳性表达率愈低。本研究采用Kaplan-Meier 生存分析及Log-rank 检验Tip60 蛋白与患者预后的关系,结果显示:Tip60蛋白高表达患者5 年生存率明显高于Tip60 蛋白低表达患者。本研究结果与有关研究结果[12-14,18]具有相同趋势。即Tip60 蛋白的表达水平与黑色素瘤、膀胱癌、食管癌、乳腺癌和卵巢癌的肿瘤分化程度、TNM 分期和(或)卵巢癌的FIGO 分期有关,且影响患者的预后。同时Tip60 蛋白表达水平下调患者的预后不佳,提示其在肿瘤发生发展过程中起到了重要的作用。也与本课题组前期关于乙酰基转移酶-hMOF 蛋白在子宫内膜癌作用的研究结果类似[19]。
综上所述,本研究结果显示:Tip60 蛋白在子宫内膜腺癌组织中低表达,且在临床病理分期越晚及分化程度越差的患者组织中表达越低,Tip60 蛋白的表达水平与子宫内膜癌总生存率呈明显负相关关系,提示Tip60 蛋白与子宫内膜腺癌的发生、发展及预后有密切关联,有望为子宫内膜癌发病机制的研究提供新的思路,用以判断子宫内膜癌的生物学指标和存在潜在可能的靶向治疗点,但其具体的调控机制仍不完全清楚,有待进一步在mRNA 水平和信号传导通路等方面深入研究,同时需要多中心、大数据分析得以进一步完善及验证。

