橘皮苷对百草枯诱导小鼠肺纤维化的干预作用及可能机制▲
陈 宏 赵建云 张 伟 陈 群 王 兵
(1 黑龙江中医药大学附属第一医院儿一科,哈尔滨市 150040,电子邮箱:chenrongsheng1977@163.com;2 黑龙江省哈尔滨市阿城区人民医院检验科,哈尔滨市 150300; 3 黑龙江中医药大学基础医学院,哈尔滨市 150400)
肺纤维化是间质性肺疾病常见的临床病理改变。多种因素如空气污染、病毒感染等,均可诱导肺纤维化[1]。肺纤维化患者的中位生存时间仅为2~3年,5年病死率达到40%[2]。目前治疗肺纤维化的药物存在着不同程度的副作用,临床上亟须开发有效的治疗肺纤维化的药物[3-4]。中药单体结构多样,从中药单体中寻找有效的先导化合物是新药开发的重要策略。为了寻找具有治疗肺纤维化潜力的药物,我们课题组前期筛选了大量中药单体,发现橘皮苷对肺纤维化有较好的治疗效果[5]。本文拟进一步利用肺纤维化动物模型对橘皮苷抗肺纤维化的药效进行评价,为其临床应用提供数据支持。
1 材料与方法
1.1 实验动物 选取同批饲养的雄性C57小鼠60只,体重(24.3±3.6)g,8~10周龄,购于青龙山动物繁殖中心[许可证号:SCXK(苏)2017-0001]。小鼠饲养于本院动物实验中心,环境温度保持(23.0±1.5)℃,相对湿度保持(50.0±3.5)%,均给予相同的常规自由饮食。本研究通过动物实验伦理审查委员会审查批准。实验开始前,小鼠在洁净级动物房适应性喂养1周,实验期间小鼠自由饮水和进食。
1.2 药品及试剂 橘皮苷购自上海贤鼎生物科技有限公司,百草枯水溶液(浓度>98%)购自百灵威科技有限公司,地塞米松(广东华南药业集团有限公司,国药准字H44024469)。苏木精-伊红(hematoxylin-eosin,HE)染色试剂、Masson 染色试剂、转化生长因子β1(transforming growth factor β1,TGF-β1)、肿瘤坏死因子(tumor necrosis factor,TNF)-α、γ-干扰素、丙二醛和髓过氧化物酶(myeloperoxidase,MPO)检测试剂盒由北京方程生物科技有限公司提供(生产批号分别为bs-41734G,bs-38265G,bs-0129R,bs-30192R,bs-15934R,bs-28046R,bs-31428R)。磷酸化蛋白激酶 B(phosphorylated protein kinase B,p-Akt)、磷酸化细胞外信号调节激酶(phosphorylated extracellular signal-regulated kinase, p-ERK)抗体购于Cell Signaling Technology公司(批号:K162711C、K155922D),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH,内参),兔源多克隆抗体(一抗,美国 ImmunoWay公司,批号B4501),一抗稀释液购自碧云天公司,山羊抗兔二抗购自Cell Signaling Technology公司(批号:AS016)。
1.3 实验仪器 TS100型倒置显微镜及其配套图像采集系统购自尼康公司,5417R高速低温离心机和移液器购自Eppendorf公司,UV9600分光光度计购自北京瑞丽分析仪器公司。美国Biofuge Stratos全能台式高速冷冻离心机(上海凌仪生物科技有限公司),日本SANYO公司MDF-382E(N)型超低温冰箱,美国Bio-Rad 公司MP4000型凝胶成像分析系统,瑞士Tecan公司Infinite M200型多功能酶标仪,日本Olympus公司荧光显微镜。
1.4 实验方法
1.4.1 分组、建模及给药方法:将60只小鼠按照随机数字表法分为正常组、模型组、橘皮苷高剂量组、橘皮苷中剂量组、橘皮苷低剂量组和地塞米松组,每组10只。正常组给予生理盐水(2 mL/kg)一次性灌胃,其余组利用百草枯水溶液(剂量为100 mg/kg)一次性灌胃建模。在建模1周后,地塞米松组采用腹腔注射方式按2 mg/(kg·d)剂量给予地塞米松,橘皮苷高剂量组、橘皮苷中剂量组、橘皮苷低剂量组分别按照体重给予0.10 mL/10 g、0.06 mL/10 g、0.03 mL/10 g的橘皮苷灌胃,正常组及模型组均给予等容量的生理盐水。均给药1次/d。给药期间观察小鼠的生活状态及体重,连续给药3周后进行相关指标的检测。
1.4.2 外周血指标检测:给药3周后,称重各组小鼠,然后进行眼球静脉丛取血1 mL, 3 500 r/min离心30 min,分离血清后将其放置在-80℃冰箱中备用。按照试剂盒说明书,用免疫组织化学法测定血清TNF-α、 γ-干扰素、TGF-β1水平。
1.4.3 肺组织丙二醛、MPO水平的测定:取血后断颈处死小鼠,解剖小鼠后分离其新鲜肺组织并称重。将小鼠右肺组织分装于冻存管,迅速置入液氮罐后转移至-80℃冰箱保存。根据试剂盒说明书,应用酶联免疫吸附法检测肺脏组织丙二醛及MPO水平。
1.4.4 HE染色及Masson 染色:取小鼠左肺组织,固定处理后,行石蜡包埋、切片处理,然后根据试剂盒说明书进行HE染色及Masson染色操作,并于显微镜下观察记录染色结果。
1.4.5 蛋白免疫印迹法检测p-Akt、p-ERK 蛋白的表达:取肺组织,应用二喹啉甲酸法提取肺组织蛋白。制备10%~15%聚丙烯酰胺凝胶后将蛋白上样,进行电泳,浓缩胶电压80 V,分离胶电压120 V。将聚偏二氟乙烯膜在甲醇中孵育1 min,转入转膜液中平衡,电泳结束后采用恒流150 mA,将蛋白转至聚偏二氟乙烯膜,转膜时间1.5 h,将聚偏二氟乙烯膜置于水平摇床上,5%脱脂奶粉室温封闭 1 h,TBST漂洗膜5次,5 min/次。根据抗体说明书,用TBST按1 ∶1 000稀释一抗(p-Akt、p-ERK)和GAPDH抗体。于4℃下孵育一抗过夜,用洗膜液漂洗膜5次,5 min/次,选择合适的二抗(辣根过氧化物酶标记的羊抗兔 IgG),用TBST按1 ∶5 000稀释,将膜置于二抗稀释液中,室温孵育1 h,清洗后加上电化学发光剂显色,应用美国Bio-Rad 公司 MP4000型凝胶成像分析系统上机检测。以GAPDH为内参。用Quality One软件,运用Image J图像分析系统测定条带灰度值,采用目的蛋白与内参条带灰度值的比值作为结果进行统计分析。
1.5 统计学分析 使用SPSS 25.0软件进行统计分析。计量资料采用(x±s)表示,符合正态分布且方差齐的数据采用方差分析,两两比较采用LSD-t检验方法。以P<0.05为差异具有统计学意义。
2 结 果
2.1 各组小鼠肺组织病理学变化 正常组小鼠肺组织形态结构正常,肺部支气管以及肺泡结构完整;模型组小鼠的肺组织严重破坏,肺泡结构消失,大量纤维组织增生;与模型组相比,地塞米松组小鼠肺组织炎性细胞浸润缓解,肺泡结构相对比较完整;不同剂量橘皮苷组小鼠的肺组织肺纤维化程度明显减轻,肺泡结构相对更加完整。见图1、图2。

图1 6组小鼠肺组织HE染色结果(×400)
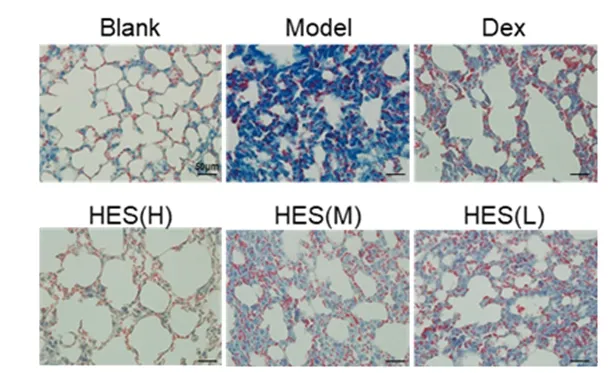
图2 6组小鼠肺组织Masson染色结果(×400)
2.2 各组血清炎症因子水平的比较 与正常组相比,模型组血清TGF-β1、TNF-α水平升高,血清γ-干扰素水平下降(均P<0.05);与模型组比较,不同剂量橘皮苷和地塞米松组血清TGF-β1、TNF-α水平降低,橘皮苷中、高剂量组血清γ-干扰素水平升高(均P<0.05);与地塞米松组相比,仅橘皮苷高剂量组的血清TNF-α水平降低,血清γ-干扰素水平升高(均P<0.05);橘皮苷低剂量组、橘皮苷中剂量组、橘皮苷高剂量组的血清TNF-α和TGF-β1水平依次降低,血清γ-干扰素水平依次升高,且橘皮苷高剂量组血清TGF-β1水平低于其他剂量组(均P<0.05)。见表1。

表1 6组血清炎症因子水平的比较(x±s,pg/mL)
2.3 各组肺组织丙二醛和MPO水平的比较 与正常组相比,模型组肺组织中丙二醛、MPO水平升高(均P<0.05);橘皮苷不同剂量组和地塞米松组肺组织中的丙二醛、MPO水平均低于模型组(均P<0.05);橘皮苷不同剂量组丙二醛、MPO水平均低于地塞米松组(均P<0.05);橘皮苷低剂量组、橘皮苷中剂量组、橘皮苷高剂量组的肺组织中丙二醛水平依次降低,且橘皮苷高剂量组MPO水平低于其他剂量组(均P<0.05)。见表2。

表2 6组肺脏组织丙二醛和MPO 水平的比较(x±s)
2.4 各组肺组织中p-Akt、p-ERK 蛋白表达水平的比较 与正常组相比,模型组肺组织中p-Akt、p-ERK蛋白相对表达水平升高(均P<0.05);与模型组相比,地塞米松组肺组织中p-Akt、p-ERK蛋白相对表达水平差异无统计学意义(P>0.05),橘皮苷不同剂量组肺组织中p-Akt、p-ERK蛋白相对表达水平降低(均P<0.05);与地塞米松组相比,橘皮苷不同剂量组肺组织中p-Akt蛋白相对表达水平、橘皮苷高剂量组和橘皮苷中剂量组肺组织中p-ERK蛋白相对表达水平均降低(均P<0.05);橘皮苷高剂量组肺组织中p-Akt蛋白相对表达水平低于其他剂量组,且p-ERK蛋白相对表达水平低于橘皮苷低剂量组(均P<0.05)。见图3、表3。

图3 各组小鼠p-Akt、p-ERK蛋白的表达

表3 6组肺组织中p-Akt、p-ERK蛋白相对表达水平的比较(x±s)
3 讨 论
肺纤维化是间质性肺疾病的主要病理改变[6],其以大量成纤维细胞增殖及细胞外基质聚集为主要特征。肺纤维化患者的中位生存时间为2~3年,5年病死率达到40%[7],但其治愈率低[8]。目前,治疗该疾病的药物较为匮乏[9],且治疗效果不甚理想。中药单体化学结构多样,从中药单体中寻找有效的先导化合物可为治疗肺纤维化的新药开发提供指导[10-12]。此外,中药单体的化学结构新颖多样,从中寻找先导化合物是新药开发的重要手段,可以为后期进行化学结构修饰,提供多种结构基础,加快药物的发现过程[13]。
为了寻找具有治疗肺纤维化作用的新药物,课题组前期筛选了多个中药单体,初步研究结果发现橘皮苷对肺纤维化具有较好的治疗效果[14]。橘皮苷是从陈皮中提取出来的黄酮类有效成分[15]。研究表明,橘皮苷具有抗炎、抑制急性肺损伤、治疗非酒精性脂肪肝和代谢综合征等功效,其对肺纤维化干预作用的相关研究报告较少[16]。
本研究采用百草枯一次性灌胃建立肺纤维化小鼠模型,发现模型组小鼠的肺组织严重破坏,肺泡结构消失,大量纤维组织增生,提示成功建立肺纤维化小鼠模型。给予临床常用抗纤维化药物地塞米松以及中药单体橘皮苷分别进行干预发现,与模型组相比,地塞米松组肺组织炎性细胞浸润缓解,肺泡结构相对比较完整,而不同剂量橘皮苷组小鼠的肺组织肺纤维化程度明显减轻,肺泡结构相对更加完整。这提示橘皮苷也具有抗肺纤维化的作用,且效果优于临床常用药物地塞米松。
肺纤维化是由于肺脏受到伤害后,在修复的过程中成纤维细胞过度增生及胶原蛋白生成,使肺部间质形成大量纤维结缔组织。引起肺部间质组织发生炎症反应的原因包括空气污染物、过敏原、细菌或病毒、吸入有毒气体、空气微粒以及香烟等。肺部组织受到刺激后引起免疫反应的发生,大量白细胞自肺部微血管浸润至肺组织中,分泌许多炎症介质,如TNF-α、白细胞介素(interleukin,IL)-6、IL-8,而这些炎症介质又募集更多的白细胞浸润,使得炎症反应加剧。有研究显示,橘皮苷可抑制丝裂原活化蛋白激酶及核因子κB蛋白的表达,从而减少炎症介质TNF-α、IL-1、IL-6生成;橘皮苷可通过发挥抗炎作用,提高败血症小鼠的生存率;同时,橘皮苷还可以减轻急性肺损伤小鼠模型的炎症反应,以及抑制卵白蛋白引起的呼吸道炎症反应,改善气喘症状;另外,橘皮苷也被证实可减缓氧化反应造成的神经细胞死亡[17]。本研究结果显示,肺纤维化小鼠的血清炎症因子TGF-β1、TNF-α以及氧化应激指标丙二醛、MPO水平均升高,而具有抗纤维化作用的血清γ-干扰素水平下降(均P<0.05),提示肺纤维化小鼠体内炎症、氧化应激反应明显。接受地塞米松或橘皮苷干预后,小鼠的炎症因子和氧化应激指标水平均下降,而γ-干扰素水平升高(均P<0.05),且高剂量橘皮苷的干预效果最为明显(均P<0.05)。这表明橘皮苷可减轻肺纤维化引起的炎症和氧化应激反应。
我们进一步分析了各组小鼠肺组织中p-Akt、p-ERK蛋白的表达情况。结果显示,与正常组相比,模型组肺组织中p-Akt、p-ERK蛋白相对表达水平升高(均P<0.05),这提示肺纤维化的发生可能与AKT、ERK等通路失调有关。我们进一步研究发现,与模型组比较,地塞米松组小鼠肺组织中p-Akt、p-ERK蛋白相对表达水平差异并无统计学意义(P>0.05),但橘皮苷不同剂量组小鼠肺组织中p-Akt、p-ERK蛋白相对表达水平均降低(均P<0.05),且橘皮苷高剂量组的干预效果相对显著。由此推测,橘皮苷可能通过调控蛋白激酶B、细胞外信号调节激酶等介导抗炎、抗氧化及抗凋亡的信号通路,发挥减轻肺损伤、抗肺纤维化的作用。
综上所述,橘皮苷对于百草枯导致的小鼠肺纤维化具有改善作用,这可能与其抗氧化应激作用以及通过调控蛋白激酶B/细胞外信号调节激酶信号通路发挥抗炎症有关。因此,从中药单体中寻找抗肺纤维化的有效成分,并且阐明其药理机制,对于其临床应用及新药开发具有重要的意义。

