基于微小RNA-mRNA-信号通路调控网络探讨肝细胞癌的潜在生物学标志物▲
王挺帅 王 娜 张荣臻 王明刚 黄少东 吴 聪 毛德文,4
(1 广西中医药大学第一附属医院肝病科,南宁市 530023,电子邮箱:603085856@qq.com;2 广西骨伤医院脾胃呼吸科,南宁市 530023;3 广西中医药大学研究生学院,南宁市 530023;4 广西壮瑶药技术研究中心,南宁市 530023)
在全球范围内,肝癌是最常见的恶性肿瘤之一,发病后患者生存时间仅有6个月左右,被称为“癌中之王”[1]。过去的几十年里疾病诊断、防治等方面的研究显著进步,全球大多数国家的肝癌发病率和死亡率均显著下降[2]。然而,亚洲地区每年仍有58万多例新发肝癌病例,肝癌仍然是一个有待解决的挑战,需要深入研究[3]。与其他癌症一样,基因变异、细胞环境和机体内环境被认为是肝癌发生、发展和转移的重要机制。
微小RNA(mircoRNA,miRNA)是一类非编码RNA,已被证实与多种疾病特别是恶性肿瘤相关。研究表明,miRNA与肝癌的发生、发展、预后有着密切的关系[4]。例如,miRNA-519、miRNA-106b、miRNA-301、miRNA-423、miRNA-33a、miRNA-24等表达上调,可促进肝癌细胞增殖、迁移[5];miRNA-122、miRNA-124、miRNA-203、miRNA-199a-5p等表达下调,可促进肝癌细胞凋亡、抑制肝癌细胞增殖[6-7]。因此,miRNA具有肿瘤抑制因子或癌基因的作用,可作为肝癌诊断、治疗和预后的特异性标志物。
了解肝癌的发生过程及患者预后状况是有效治疗肝癌的前提之一。虽然在过去的几十年中,很多学者对肝癌的差异表达基因(differentially expressed genes,DEGs)和差异表达miRNA(differentially expressed miRNAs,DEmiRNAs)进行了研究,并报告了它们的一些功能,但由于对基因和miRNA的比较分析受到限制,它们如何通过分子途径相互作用尚不明确。近年来,微阵列技术已被广泛应用于肿瘤相关遗传变异的鉴定。目前,通过生物信息学的方法,可以对微阵列技术产生的数据进行处理,从而了解DEGs和miRNA之间的相互作用,特别是相互作用网络中的通路,最终分析它们在肝癌发生、发展过程中的潜在机制[8-10]。本文通过GEO数据库获取肝癌相关的miRNA表达谱,分析肝癌组织和正常组织之间的DEGs和DEmiRNAs,随后筛选肝癌的潜在靶基因,对其可能的分子机制进行描述,旨在寻找最特异、最敏感的肝癌分子标志物,进而提高诊治水平以改善患者预后。
1 资料与方法
1.1 筛选miRNA和mRNA信息 (1)提取miRNA信息。从GEO数据库(http://www.ncbi.nlm.nih.gov/geo)中检索肝癌,设置关键词为hepatocellular carcinoma(或HCC、liver cancer)、miRNA,得到miRNA相关信息。选择组织为人(Homo sapiens),研究类型为非编码RNA微阵列分析(non-coding RNA profiling by array),进一步筛选。再根据以下标准进行了第2次筛选:① 研究样本量≥10个;② 研究对象为组织样本而不是细胞样本;③ 仅研究肝组织样本;④ 应提供正常对照样本或正常邻近组织。(2)提取mRNA信息。从GEO数据库中检索肝癌,设置关键词为hepatocellular carcinoma(或HCC、liver cancer)、mRNA,得到mRNA相关信息。选择组织为人(Homo sapiens),研究类型为Expression profiling by array,进一步筛选。第2次筛选标准同miRNA。
1.2 DEmiRNAs和DEGs的筛选 采用R语言中limma包进行异DEmiRNAs和DEGs的筛选,设置阈值=2,矫正后的P值阈值为0.05。并用pheatmap包绘制DEGs和DEmiRNAs热图。
1.3 筛选肝癌的潜在靶基因 通过miRDB(http://mirdb.org/)、miRTarBase(http://mirtarbase.mbc.nctu.edu.tw/php/index.php)和TargetScan(http://www.targetscan.org/mamm_31/)3个数据库进行DEmiRNAs靶基因的筛选。再将筛选出来的靶基因与DEGs取交集,最终得到肝癌的潜在靶基因。采用Venny 2.1工具(http://bioinfogp.cnb.csic.es/tools/venny/index.html)进行对比分析。
1.4 功能和通路富集分析 利用David数据库(https://david.ncifcrf.gov/)上传1.3中获取的交集靶基因,进行基因本体(Gene Ontology,GO)功能富集分析,包括生物学过程、细胞组成、分子功能,同时进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路分析(P<0.05)。
1.5 miRNA-mRNA-通路调控网络的建立 采用Cytoscape软件构建miRNA-mRNA-通路的调控网络,并用Network Analyzer进行拓扑学分析,计算其拓扑学参数,从中得到重要miRNA、mRNA及信号通路,基于构建的调控网络探讨原发性肝癌的生物学过程及相关作用机制。
2 结 果
2.1 miRNA、mRNA、DEmiRNAs和DEGs的筛选结果 通过GEO数据库获得符合筛选标准的肝癌相关miRNA表达谱 (GSE112264)和mRNA表达谱(GSE118916),前者包括正常组样本41例、肝癌组样本50例,后者包括正常组样本8例、肝癌组样本24例。采用limma包筛选得到213个DEmiRNAs和256个DEGs,热图见图1。
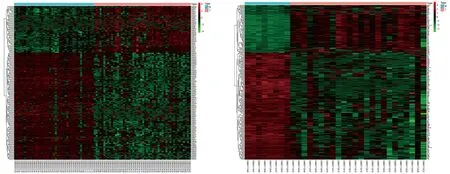
DEmiRNAs DEGs
2.2 miRNA-mRNA交集 从miRDB、miRTarBase和TargetScan数据库中共识别出4 010个DEmiRNAs靶基因。再将DEmiRNAs靶基因与DEGs取交集,获得肝癌潜在靶基因34个(见图2)。选择潜在靶基因及与其对应且存在负调控关系的miRNA作为miRNA-mRNA靶点对,最终共获得55对miRNA-mRNA基因对,包括23个潜在靶基因和17个miRNA,其中miRNA均为表达上调,而危险基因均为表达下调,见表1。

图2 肝癌潜在靶基因的韦恩图

表1 miRNA-mRNA基因对
2.2 GO富集分析和KEGG信号通路分析 GO富集分析结果显示,肝癌潜在靶点基因涉及22个生物学过程、8种分子功能、8个细胞组分。见图3。其中生物学过程主要包括调节细胞死亡、多细胞生物过程的正向调节、生物学过程的正向调节、调节细胞凋亡、组织发育、内源性刺激的应答、调节细胞连接、调节程序性细胞死亡等。
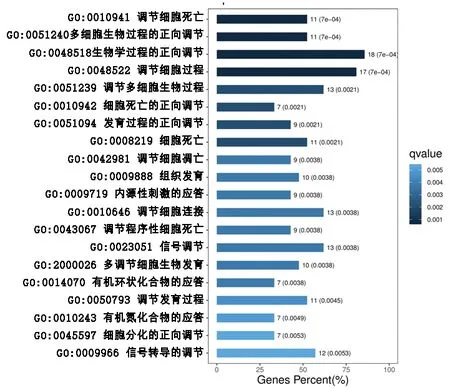
图3 生物学过程的GO富集分析(前20个生物学过程)
KEGG信号通路分析结果显示,共得到88条信号通路,剔除与肝癌无关的31条信号通路,按其功能分类,主要富集在7个类型的通路上,包括细胞增殖与死亡、免疫系统、信号转导、运输和分解代谢、癌症、消化系统及氨基酸代谢,涉及p53 信号通路、细胞凋亡、Th17分化、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、转化生长因子β(transforming growth factor β,TGF-β)信号通路、核因子κB信号通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、FoxO信号通路、Hippo信号通路、Janus激酶/信号转导与转录激活子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)信号通路等,见图4(图4只显示前20个信号通路,未显示完全)。

图4 KEGG信号通路分析(前20个信号通路)
2.3 miRNA-mRNA-通路调控网络 采用Cytoscape构建miRNA-mRNA-通路调控网络,并用Network Analyzer进行拓扑学分析。根据连接度(Degree值)大小,得到排名靠前的危险miRNA为hsa-miRNA-195-5p、hsa-miRNA-16-5p、hsa-miRNA-124-3p、hsa-miRNA-107、hsa-miRNA-103a-3p等,危险基因有转录因子FOS、生长停滞和DNA损伤可诱导蛋白45γ(growth arrest and DNA-damage-inducible 45 gamma,GADD45G)、环指蛋白125(ring finger protein 125,RNF125)、含锌指和BTB结构域蛋白质16(zinc finger and BTB domain containing 16,ZBTB16)、C-X-C基序趋化因子配体12(C-X-C motif chemokine ligand 12,CXCL12)、生长激素受体(growth hormone receptor,GHR)、R-海绵蛋白-3(R-spondin 3,RSPO3)、碳酸酐酶2(carbonic anhydrase 2,CA2)、DNA结合抑制因子1(inhibitor of DNA binding 1,ID1)、肌肽二肽酶1(carnosine dipeptidase 1,CNDP1)、磷脂磷酸酶3(phospholipid phosphatase 3,PLPP3)、早期生长应答因子1(early growth response 1,EGR1)等,信号通路为癌症通路、癌症中的转录失调、细胞凋亡、MAPK信号通路、肝细胞癌、p53 信号通路、胆汁分泌等。见图5、表2。
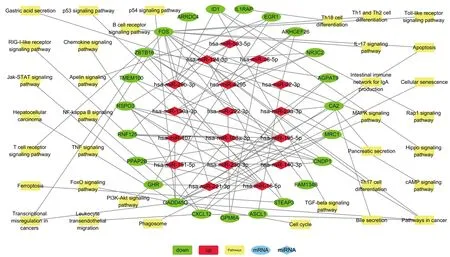
图5 miRNA-mRNA-通路的调控网络图
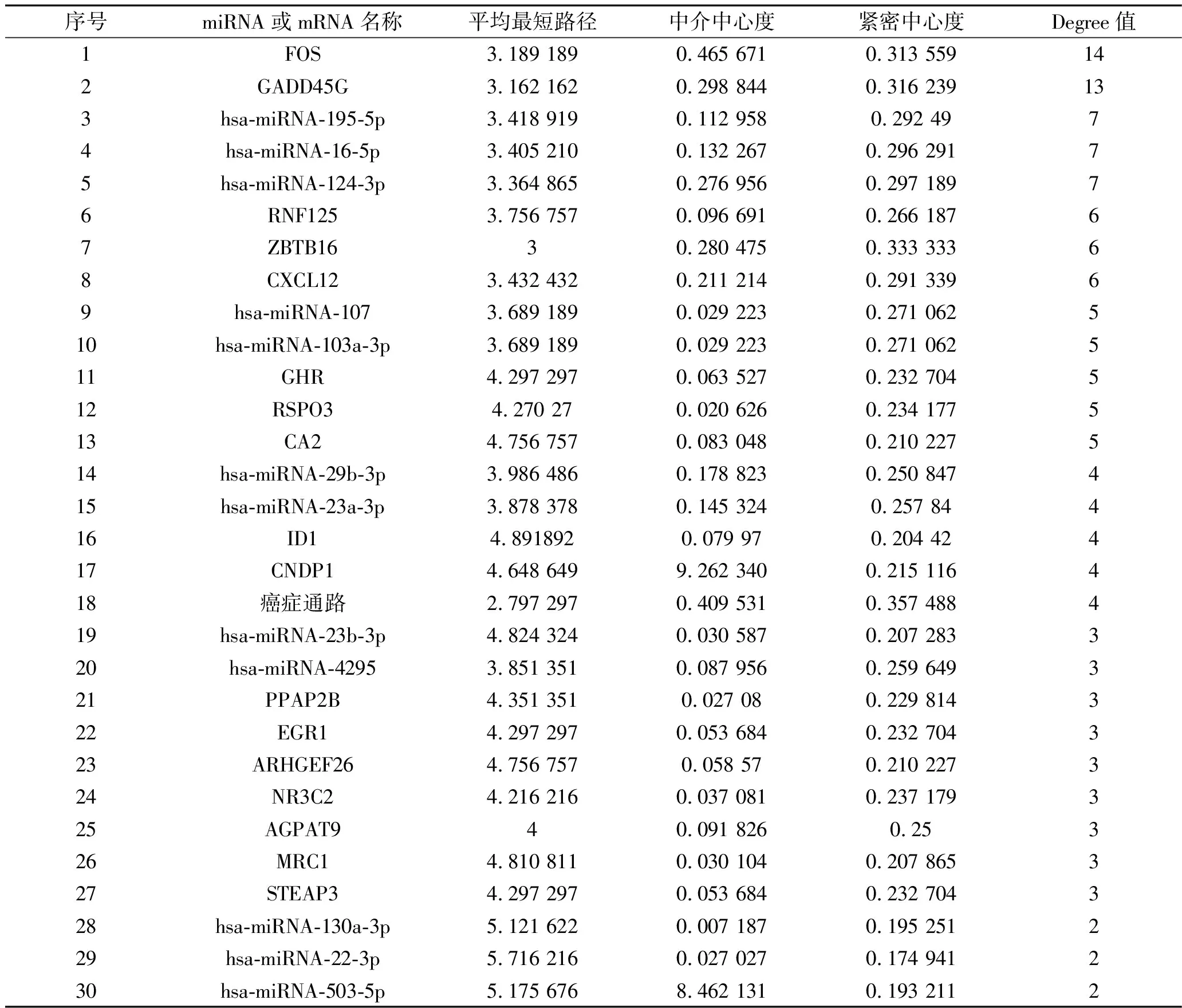
表2 miRNA-mRNA-通路调控网络拓扑学特征
3 讨 论
miRNA是一类由内源性基因编码的长度为20~25个核苷酸的非编码RNA,主要与3′-非翻译区的靶向mRNA结合,miRNA能促进靶向mRNA的降解或抑制其翻译,最终调节靶基因的生物学功能[11]。同一miRNA可以调控不同的基因,而同一基因可由不同的miRNA调控。在过去的几十年里,已有研究充分证实了miRNA参与多种生理和病理事件的发生,特别是在肿瘤方面[12]。miRNA与肿瘤的关系可概括为以下几个方面:(1)miRNA作为癌基因或抑癌基因,参与了肿瘤发生和发展相关基因的表达调控,在肿瘤的增殖、迁移、侵袭、转移以及血管生成、细胞周期进展、凋亡、自噬等过程中发挥着重要作用[13-14]。(2)miRNA在人肿瘤中具有组织和疾病特异性,提示miRNA可作为肿瘤早期诊断和预后预测的新生物学标志物[15]。(3)miRNA在肿瘤治疗中的应用,主要包括抑制miRNA和替换miRNA两种策略。在中国,肝癌是发病率排名第4位的恶性肿瘤,也是癌症相关死亡的第2大原因[1]。然而,肝癌的发生、发展机制仍有待阐明,这严重阻碍了对肝癌的早期发现和有效治疗。因此,从miRNA深入研究miRNA-mRNA-通路调控网络,有助于进一步探明肝癌的发生和进展过程,建立早期筛查和预后评估的危险模型,以及研发抗肝癌的药物。
通过生物信息学分析,我们共筛选出与肝癌相关的213个DEmiRNAs以及256个DEGs,取交集后获得34个肝癌潜在靶基因,这些基因参与调节细胞死亡、多细胞生物过程的正向调节、生物学过程的正向调节、调节细胞凋亡、组织发育、内源性刺激的应答、调节细胞连接、调节程序性细胞死亡等生物学过程。最终获得55对miRNA-mRNA基因对,包括23个潜在靶基因和17个miRNA;通过构建miRNA-mRNA-通路调控网络,筛选出肝癌的危险miRNA为hsa-miRNA-195-5p、hsa-miRNA-16-5p、hsa-miRNA-124-3p、hsa-miRNA-107、hsa-miRNA-103a-3p等,危险基因有FOS、GADD45G、RNF125、ZBTB16、CXCL12、EGR1等,涉及信号通路包括癌症通路、癌症中的转录失调、细胞凋亡、MAPK信号通路、肝细胞癌、p53 信号通路、胆汁分泌等。在miRNA-mRNA-通路调控网络中,FOS的连接度最高,与hsa-miRNA-221-3p、hsa-miRNA-29b-3p、hsa-miRNA-222-3p 3个miRNA相关,涉及癌症通路、细胞凋亡、MAPK信号通路等11条信号通路。
Fos蛋白是原癌基因c-Fos的表达产物,由碱性氨基酸组成,Fos家族为细胞核内重要的转录因子,其编码的蛋白质为细胞核内重要的癌蛋白[16]。Fos蛋白可与Jun蛋白结合形成具有转录激活活性的异二聚体,即转录因子激活子蛋白1(activator protein 1,AP-1),调控细胞存活、增殖和分化,参与癌症的形成及其上皮间质转化[17]。Bakiri等[18]构建肝癌小鼠模型,发现肝细胞特异性c-Fos缺失可防止肝癌的发生,而c-Fos表达增加有利于肝细胞转化和癌变。有研究显示,AP-1的活化可通过MAPK信号通路介导Fos、Jun蛋白的活化和磷酸化,从而促进癌症的进展[19]。除此之外,AP-1在调控细胞死亡和存活方面起重要作用,也是细胞转化的重要标志。GADD45G又称为CR6,属于GADD45蛋白家族。GADD45G可影响细胞周期,调控G/M细胞周期点、维持基因组稳定性,在细胞信号转导过程中起重要作用,也与DNA损伤修复密切相关[20]。此外,GADD45G可负调控细胞生长,抑制肿瘤细胞生长并促进其凋亡。RNF125是一种泛素连接酶,是RIG-I的负调控因子,可通过介导视黄醇诱导基因-I的k48连接多泛素化从而导致视黄醇诱导基因-I蛋白被蛋白酶体降解。泛素化几乎参与所有细胞过程,其功能包括内化和溶酶体靶向、蛋白质相互作用的调节、亚细胞分布的改变、转录的调节、DNA修复和跨膜信号的传播[21]。有学者发现,RNF125可通过激活TGF-β1-SMAD3-ID1信号通路促进胆囊肿瘤的浸润和转移[22]。基质衍生因子1α,也称为CXCL12,是CXCR4和CXCR7的特异性配体,三者共同推动了胚胎发育过程中的祖细胞迁移。有研究表明,CXCL12可能在肝癌的转移中发挥重要作用,促进肿瘤细胞的迁移[23]。ESR1可以编码转录因子,增强对不同组织类型的雌激素和生长因子等的刺激反应[24]。有学者发现,ESR1可能在肝癌中发挥潜在的抑癌作用,并与某些肿瘤抑制因子(例如HNF4A和PPAR)存在关联[25]。此外,也有研究显示,ESR1可以抑制白细胞介素6介导的炎症过程,减轻肝损伤和肝细胞代偿性增殖[26]。
越来越多的证据表明,miRNA表达失调是肝癌发病机制的重要组成部分。本研究最后筛选出来的17个miRNA中,根据拓扑学分析结果可知hsa-miRNA-195-5p是最显著的miRNA之一,以ZBTB16、RNF125、GHR、PPAP2B等为靶点。hsa-miRNA-195-5p在多种癌症中都有表达,包括肝癌、胃癌、乳腺癌和肾上腺皮质癌。hsa-miRNA-195-5p在肝癌细胞中的过度表达可降低PHF19的水平,导致肝癌细胞在体外的侵袭、迁移和增殖受到抑制[27]。miRNA-221是人类肿瘤中最常见且持续表达上调的miRNA之一,被认为是肿瘤的启动子。最近的一项研究表明,miRNA-221的过度表达可以加速肝细胞的增殖,并可能促进肝肿瘤的发生[28]。本研究中,has-miRNA-221和has-miRNA-222是显著上调的关键miRNA, 都与ESR1、FOS等DEGs关联。有学者发现, has-miRNA-221可与ESR1、CXCL12、FOS等DEGs相互作用[14];而has-miRNA-222是研究中表达上调最显著的miRNA,与ZBTB41相关联并可通过激活蛋白激酶B途径增强肝癌细胞的侵袭性和运动性[14]。
综上所述,FOS、GADD45G、RNF125、ZBTB16、CXCL12、EGR1等DEGs,以及hsa-miRNA-195-5p、hsa-miRNA-16-5p、hsa-miRNA-124-3p、hsa-miRNA-107、hsa-miRNA-103a-3p等DEmiRNAs,或可为肝癌的诊断和治疗提供新的线索。然而,缺乏实验验证是本研究的局限之一,在今后的研究中,将通过实时定量PCR和蛋白免疫印迹等实验对这些生物信息学分析的预测结果进一步加以验证。

