重组地衣芽胞杆菌全细胞催化合成淫羊藿次苷D2
肖 源,张 同,杨之帆,陈守文,占杨扬,陈 俊
(1.武汉科技大学化学与化工学院,湖北 武汉,430081;2.湖北大学生命科学学院,湖北 武汉,430062)
淫羊藿次苷D2(icariside D2)是一种植物源天然糖苷,对血管紧张素转换酶具有协同抑制作用[1-2],并能有效杀灭白血病细胞HL-60[3],在临床治疗及医疗保健领域表现出较大的潜在应用价值。当前制备淫羊藿次苷D2的方法主要有植物提取法、组织培养提取法、化学合成法以及酶催化法等,其中植物提取法是一种传统的制备方法,主要从野生淫羊藿、红景天等植物中直接提取淫羊藿次苷D2[4-6],该法生产效率低、成本高,加之植物资源有限,严重限制了其开发应用;组织培养提取法主要借助植物组织培养技术,利用组培材料来提取淫羊藿次苷D2,不过该法仍存在生产周期较长、产量较低等问题[7];化学合成法则受立体选择性的限制[8],并且前体UDP(尿苷二磷酸)-葡萄糖的合成工艺复杂、效率较低,因此无法应用于工业化生产;而利用粗酶液催化法合成酪醇糖苷时,同样由于前体UDP-葡萄糖的限制,导致催化合成淫羊藿次苷D2成本较高[9-12]。近年来,随着合成生物学理论与技术的不断发展,微生物全细胞催化合成法被认为是最有希望实现淫羊藿次苷D2规模化生产的方法。
酪醇和UDP-葡萄糖在糖基转移酶UGT催化下生成淫羊藿次苷D2是生物合成淫羊藿次苷D2的主要途径,通过筛选、分子改造和过表达来提高糖基转移酶的催化能力是合成酪醇糖苷的限速步骤[13-15],研究者已在大肠杆菌、枯草芽胞杆菌等中借助异源表达红景天、淫羊藿等植物来源的糖基转移酶实现了酪醇糖苷的微生物合成,但相应产量较低[13-14],这可能是因植物来源的蛋白无法在原核生物中正确折叠所致。针对真核来源蛋白表达效果不佳的问题,可以在蛋白质前添加合适的前导肽来帮助其正确折叠[16],或者通过酶谱分析和同源性比对,从不同来源的生物中筛选出功能性质相似的酶,获取更合适且高效的酶,如Fan等[15]在大肠杆菌中过表达芽胞杆菌糖基转移酶UGTBL1,通过全细胞催化,将淫羊藿次苷的产量提高至0.99 g/L。
与大肠杆菌相比,地衣芽胞杆菌(Bacilluslicheniformis)对合成淫羊藿次苷D2的底物酪醇的耐受能力更强。因此,本文以地衣芽胞杆菌DW2为出发菌株,通过筛选并过表达其内源的糖基转移酶,构建能够高效催化酪醇生成淫羊藿次苷D2的重组菌株,并考察了强化UDP-葡萄糖合成途径、发酵培养基优化对淫羊藿次苷D2产量的影响,以期为淫羊藿次苷D2的规模化生产提供参考。
1 材料与方法
1.1 材料及重组菌株的构建
1.1.1 培养基
(1)大肠杆菌培养基
LB液体培养基中胰蛋白胨、酵母粉、氯化钠的质量浓度分别为10.0、5.0、10.0 g/L,pH为7.2~7.4,在此基础上按16.0 g/L添加琼脂粉制得LB固体培养基。
(2)地衣芽胞杆菌感受态细胞制备培养基
生长培养基中胰蛋白胨、酵母粉、氯化钠、山梨醇的质量浓度分别为10.0、5.0、10.0、91.1 g/L;洗涤培养基中山梨醇、甘露醇、甘油的质量浓度分别为91.1、91.1、126.0 g/L;电转后培养液中胰蛋白胨、酵母粉、氯化钠、山梨醇、甘露醇的质量浓度分别为10.0、5.0、10.0、 91.1、69.2 g/L。
(3)淫羊藿次苷发酵培养基
MM培养基中葡萄糖、Na2HPO4·12H2O、KH2PO4、NH4Cl、MgSO4·7H2O、NaCl、柠檬酸钠的质量浓度分别为60、17.1、3、1、0.246、0.5、1 g/L,其中磷酸缓冲盐浓度折合为100 mmol/L,另有Trace Metal Mix A5母液1 mL,母液中H3BO3、MnCl2·4H2O、ZnSO4·7H2O、NaMoO4·2H2O、CuSO4·5H2O的质量浓度分别为2.86、1.81、0.222、0.39、0.079 g/L,Co(NO3)2·6H2O的质量浓度为49.4 mg/L。
1.1.2 主要试剂
质粒DNA提取试剂盒和琼脂糖凝胶DNA回收试剂盒均为美国Omega公司产品;DNA高保真 PCR 聚合酶购自北京擎科生物科技有限公司;ClonExpressTMOne Step Cloning Kit购自南京诺唯赞生物科技有限公司;抗生素降解酶Tet购于阿拉丁试剂(上海)有限公司;甲醇、甲酸均为色谱纯,购自国药集团化学试剂有限公司。
1.1.3 重组菌株的构建
通过酶谱分析,筛选出3个同属于GT1家族的糖基转移酶YjiC、YdhE和YojK。以地衣芽胞杆菌DW2菌株基因组DNA为模板,分别扩增PbacA启动子、目的基因YjiC、YdhE、YojK的ORF序列和淀粉酶终止子ter,片段回收后进行SOE-PCR,获得PbacA-YjiC/YdhE/YojK-ter融合片段,将融合片段与线性化的pHY300PLK载体骨架按照一步克隆法构建重组质粒pHY-yjiC、pHY-ydhE及pHY-yojK,转化大肠杆菌DH5α,通过菌落PCR鉴定阳性转化子,测序并进行验证后获得含目的基因表达盒的表达载体,具体操作参照文献[17]。在构建重组菌株之前,首先利用不包含其它基因的原始质粒电转化地衣芽胞杆菌以获取对照菌株ID01,再分别利用糖基转移酶表达载体pHY-yjiC、pHY-ydhE、pHY-yojK电转化地衣芽胞杆菌,经过筛选相应获得重组菌株ID02、ID03及ID04。此外,因UDP-葡萄糖是糖苷类化合物合成的重要前体,微生物细胞内低水平的UDP-葡萄糖往往会成为酪醇糖苷合成的限速步骤,为了考察过表达UDP-葡萄糖合成关键基因pgcA(葡萄糖磷酸变位酶)和gtaB(葡萄糖焦磷酸化酶)对淫羊藿次苷D2合成的影响,在过表达了糖基转移酶基因yjiC获得菌株ID02后,又利用pgcA和gtaB替换其过表达载体上的Amp抗性基因,得到重组菌株ID05。地衣芽胞杆菌感受态细胞制备和转化操作参照文献[18]。本研究中所用菌株和质粒列于表1,所用引物如表2所示。

表1 菌株和质粒

续表1

表2 引物
1.2 发酵产物检测
取 0.2 mL 发酵液,利用去离子水将其稀释一定的倍数,使用725N型紫外可见分光光度计检测细胞生长量,检测波长为600 nm。
使用Agilent 1260型高效液相色谱仪测定酪醇和淫羊藿次苷D2的浓度,分析条件如下:色谱柱为AcclaimTM120 C18(4.6 mm×250 mm,5 μm)柱;流动相由甲醇及浓度为0.1%的甲酸水溶液按体积比1∶4混合而成,流速为0.7 mL/min,柱温为30 ℃,进样量为10.0 μL,停留时间为25 min,检测波长为224 nm。相关定量计算按照相应的标准曲线进行。
2 结果与讨论
2.1 菌株的鉴定及淫羊藿次苷D2产量测定
对照菌株ID01及重组菌株ID02、ID03、ID04的PCR鉴定结果如图1所示。由图1可见,作为对照的菌株ID01(泳道1)没有扩增出特异条带,菌株ID02(泳道2)、菌株ID03(泳道3)及菌株ID04(泳道4)扩增条带大小分别与PbacA-YjiC-ter(2362 bp)、PbacA-YdhE-ter(2365 bp)、Pba-cA-YojK-ter(2486 bp)等片段的理论大小[17]接近,表明上述重组菌株的鉴定结果均与预期相符。
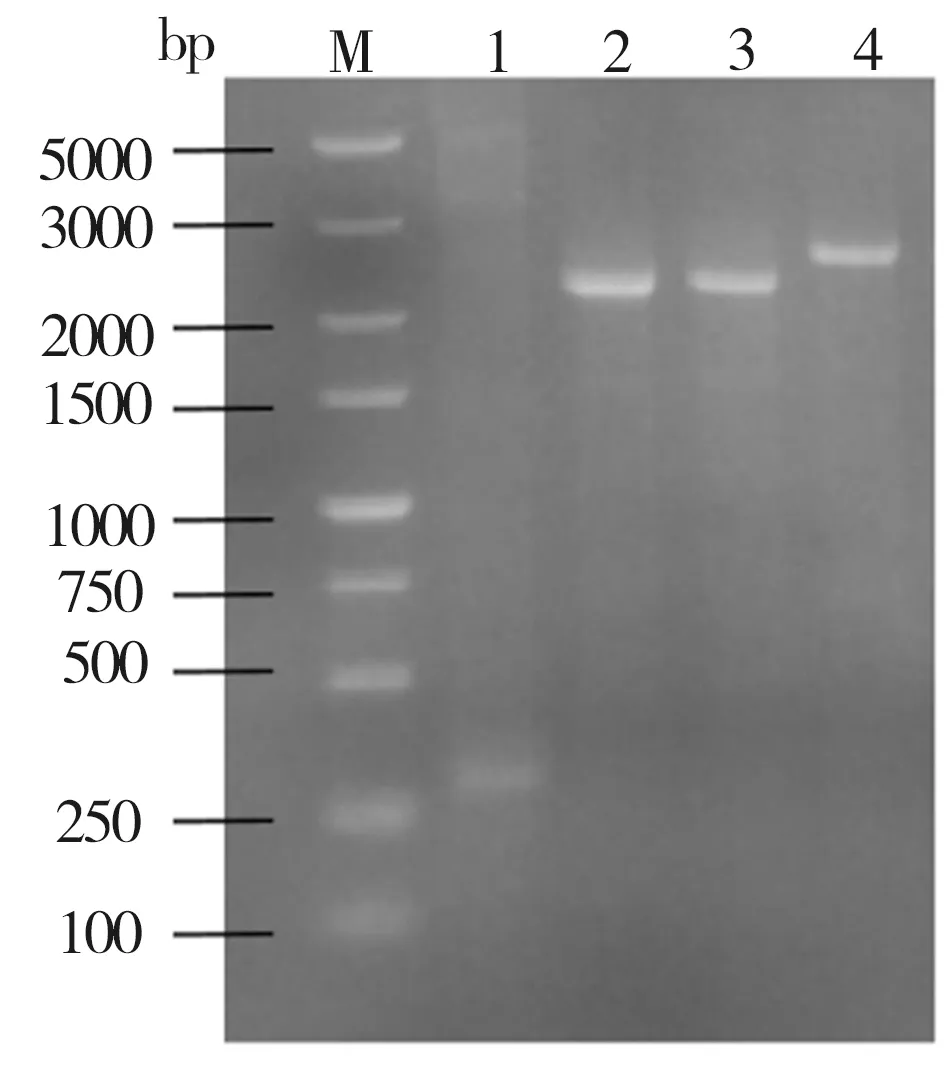
图1 菌株的PCR鉴定
将菌株ID01~ID04分别置于MM培养基中进行摇瓶发酵,并在发酵初期向培养基中按2 g/L添加酪醇,发酵24 h时取出发酵液,经高效液相色谱仪检测所得发酵液HPLC图谱及淫羊藿次苷D2浓度测试结果如图2所示。从图2(a)中可见,与对照组相比,重组菌株ID02、ID03、ID04的发酵液HPLC图谱中在6.7 min时均出现一个与淫羊藿次苷D2标准品对应的峰,表明所筛选的3种糖基转移酶均能催化酪醇合成淫羊藿次苷D2,并且通过比较菌株ID02~ID04所对应的峰值可以推断,YjiC的催化能力最强,YdhE次之,YojK的催化能力最弱。由图2(b)可知,经地衣芽胞杆菌本底催化酪醇所合成的淫羊藿次苷D2产量为183 mg/L(ID01),而与重组菌株ID02~ID04相对应的淫羊藿次苷D2浓度均有不同程度提高,这表明过表达糖基转移酶可促进淫羊藿次苷D2的合成。3组重组菌株中以ID02所对应的淫羊藿次苷D2产量为最高,达到1694 mg/L,是对照组相应值的9.3倍。
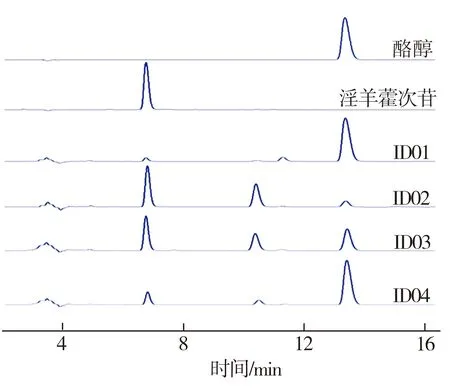
(a)HPLC图谱
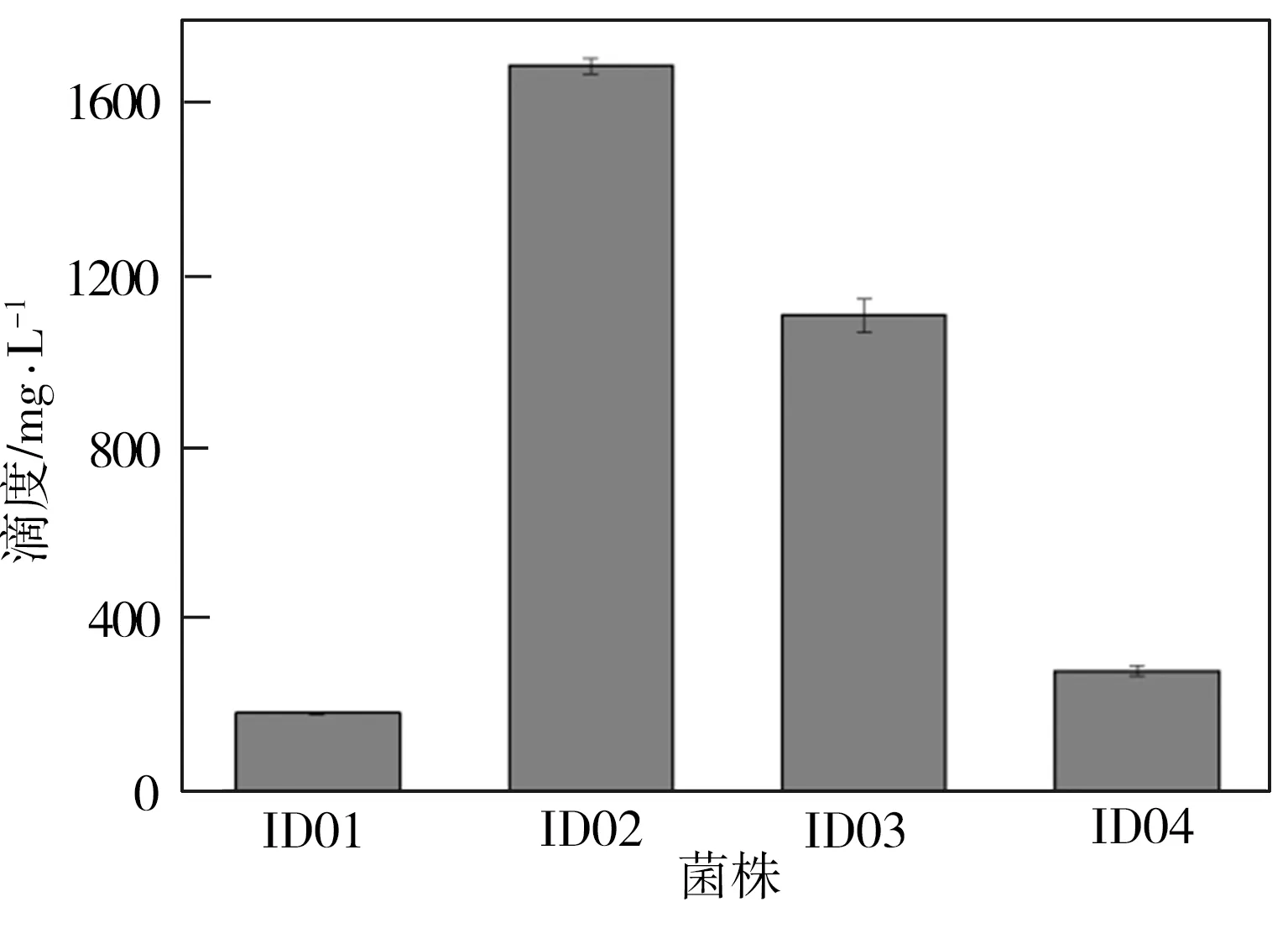
(b)淫羊藿次苷D2产量
2.2 pgcA和gtaB对淫羊藿次苷D2合成的影响
重组菌株ID05是利用pgcA和gtaB替换菌株ID02过表达载体上的Amp抗性基因所得,相关PCR鉴定结果如图3所示。在图3中泳道1为菌株ID02,其扩增片段为PAmp-Amp-ter,泳道2为菌株ID05,其扩增片段为P43-pgcA-gtaB-ter,该鉴定结果与预期相符。在酪醇初始添加量为0.5 g/L的条件下对菌株ID02和ID05进行发酵培养24 h,二者发酵液的生物量及相应的淫羊藿次苷D2产量检测结果如图4所示。由图4可知,过表达UDP-葡萄糖合成关键酶基因pgcA和gtaB即强化内源的UDP-葡萄糖合成途径不仅未对重组菌株ID05合成淫羊藿次苷D2产生促进作用,反而其淫羊藿次苷D2产量较菌株ID02相应值还降低了6%,并且菌株ID05的生长量相比ID02也有一定程度的减少。推测可能是因为地衣芽胞杆菌DW2内源UDP-葡萄糖合成途径较强,足以支持糖基化反应中的消耗,也可能是因为过量生产UDP-葡萄糖反而给菌体造成代谢负担,其具体机制有待进一步研究。
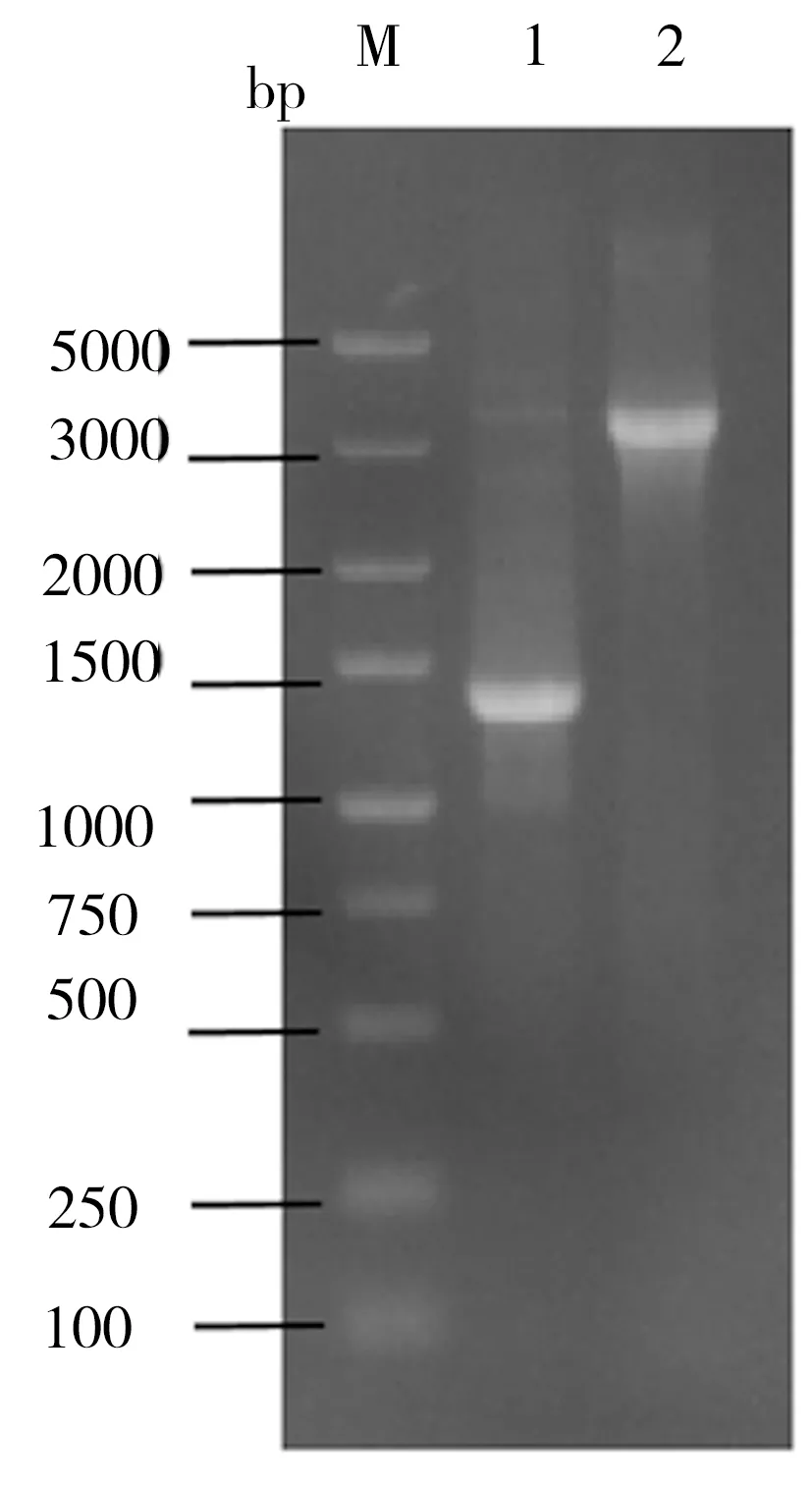
图3 ID05的PCR鉴定
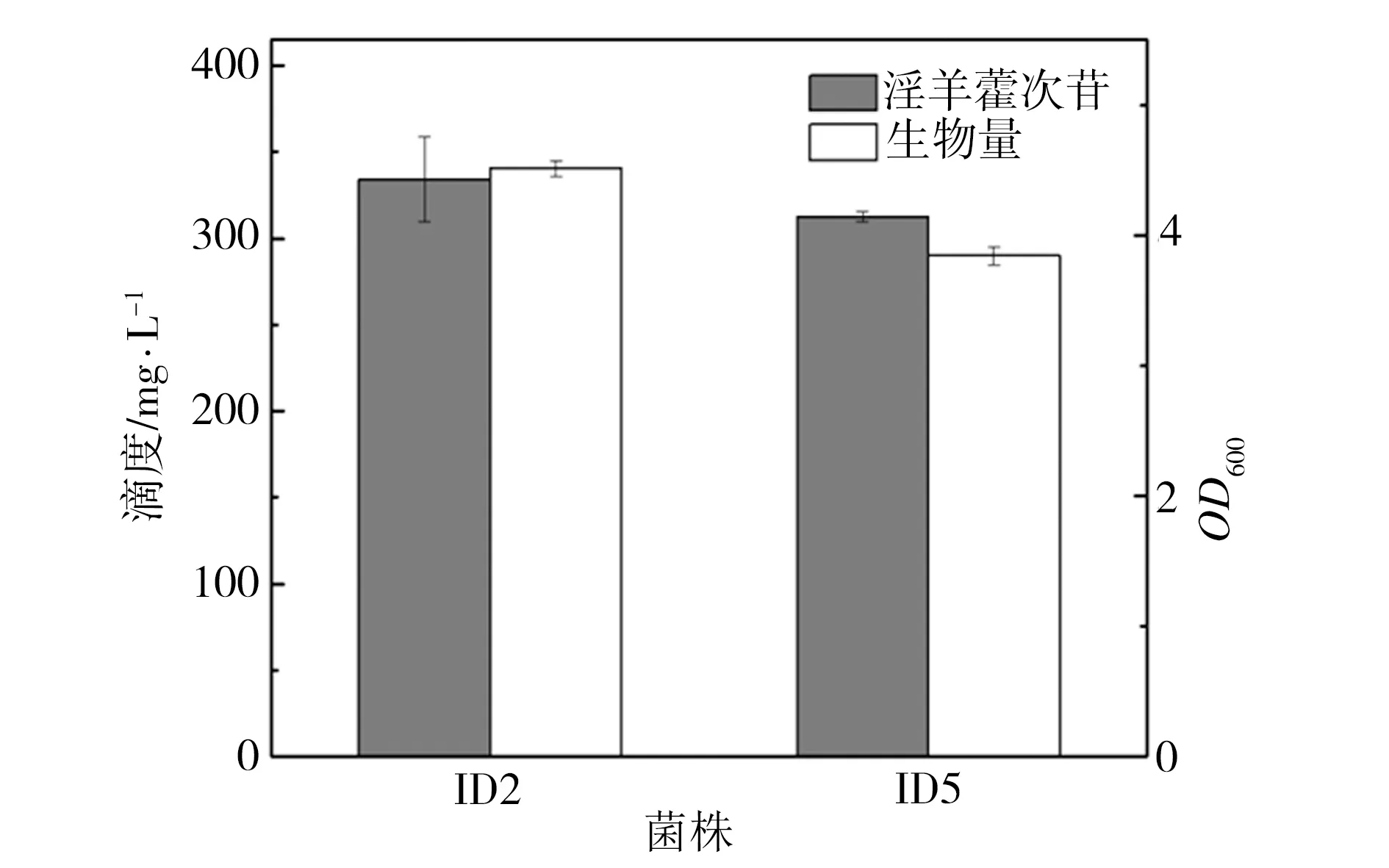
图4 过表达基因pgcA和gtaB对淫羊藿次苷D2合成的影响
2.3 发酵培养基单因素调整对淫羊藿次苷D2产量的影响
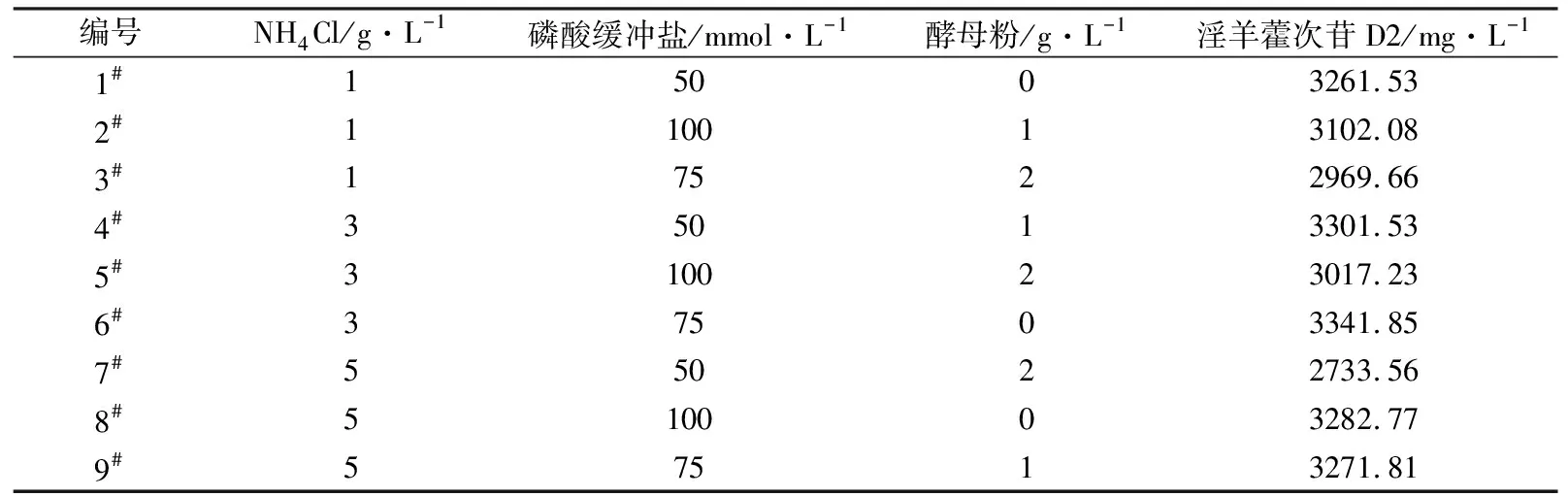
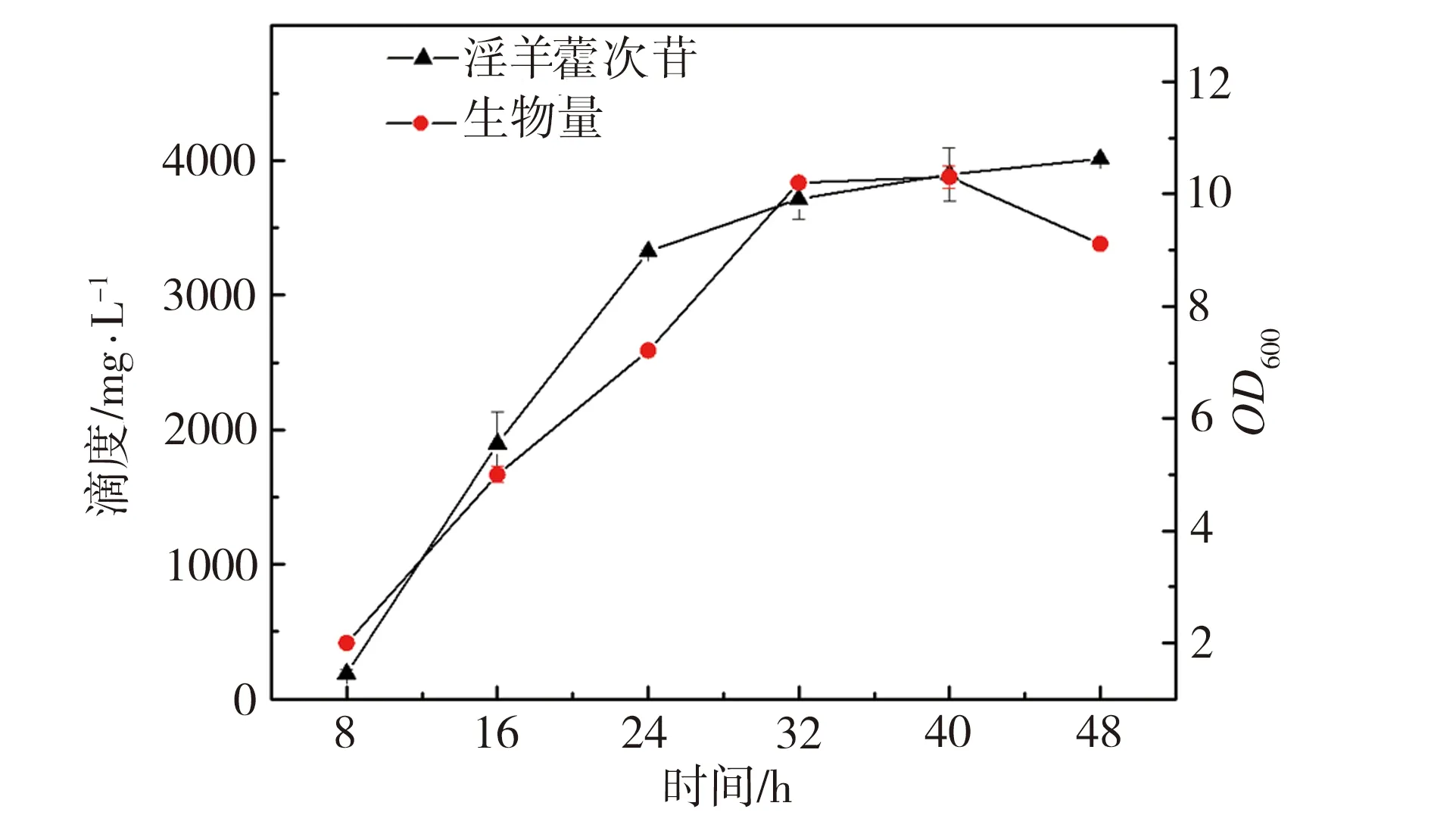
为了研究发酵培养基成分对淫羊藿次苷D2产量的影响,以重组菌株ID02为研究对象,将初始酪醇添加量提升至3 g/L,并以原始MM培养基(NH4Cl为1 g/L,磷酸缓冲盐为100 mmol/L)为基础对照组,对其中NH4Cl添加量、磷酸缓冲盐浓度分别进行调整,又因MM培养基的营养成分相对匮乏,虽有利于目标产物积累,但不利于菌株的生长,故尝试在MM初始培养基中添加酵母粉考察其对淫羊藿次苷D2积累情况的影响。在单独改变NH4Cl、磷酸缓冲盐或酵母粉添加量的条件下对相应的淫羊藿次苷D2的合成情况进行考察,并将测试结果分别与基础对照组测试结果进行显著性差异分析,结果如图5所示,图5中“*”表示0.01 (a) NH4Cl (b)磷酸缓冲盐 (c)酵母粉 为了排除发酵培养基各种组分之间的干扰,获取最适合淫羊藿次苷D2生产的培养基,采用正交试验对NH4Cl、磷酸缓冲盐和酵母粉的添加量进行优化,正交试验方案及所测相应的淫羊藿次苷D2产量如表3所示。 根据表3所示的正交试验数据求出各因素水平的均差Ki(i=1,2,3)和极差r,得到极差分析结果如表4所示。由表4可以看出,酵母粉是影响淫羊藿次苷D2产量的主要因素,NH4Cl和磷酸缓冲盐为次要因素,由此得到一个最优的发酵培养基组分:NH4Cl为3 g/L (K2)、磷酸缓冲盐75 mmol/L(K3)、无酵母粉添加(K1),对应表3中的6号培养基,其相应的淫羊藿次苷D2产量最高为3341.85 mg/L。 表3 正交试验方案及结果 表4 极差分析结果 利用优化后的培养基对重组菌株ID02进行重复发酵,并将发酵时间由24 h延长至48 h,测定发酵过程曲线如图6所示。由图6可见,在发酵过程中,菌株基本正常生长,当发酵24 h时,淫羊藿次苷D2的产量为3322 mg/L,将发酵时间延长至48 h时,淫羊藿次苷D2产量提升至4010 mg/L。 图6 菌株ID02发酵过程 上述试验结果表明,通过强化表达糖基转移酶YjiC能够大幅提高菌株催化酪醇合成淫羊藿次苷D2的能力,证实了通过缩短代谢途径,可强化糖基转移酶的表达,催化酪醇直接合成目标产物淫羊藿次苷D2。同时,这也意味着除了过表达相关基因,还可以通过增加糖基转移酶在基因组中的拷贝数来增加酶的表达量[19],进而提高胞内糖基转移酶的水平。此外,由于糖基转移酶YjiC底物谱较广,可以催化多种底物进行糖基化反应[20],为了减少支路代谢对关键酶的消耗,可以从酶工程的角度,对糖基转移酶的结构进行改造,增强其酶活力和底物选择性[21],进而促进淫羊藿次苷D2的合成。除了缩短代谢途径达到目标产物的积累之外,另一个有效的方式是改造合成目标产物的限速步骤,但在本研究中,强化淫羊藿次苷D2合成的限速步骤即强化UDP-葡萄糖合成途径并没有促进淫羊藿次苷D2的合成,反而抑制了菌株的生长,推测在地衣芽胞杆菌中,UDP-葡萄糖水平足以支持产物的合成。由于本研究中底物酪醇用量最大为3 g/L,进一步提高酪醇的用量,地衣芽胞杆菌内源的UDP-葡萄糖是否仍能满足合成需求,还有待进一步试验验证。 本研究通过对地衣芽胞杆菌DW2内源的糖基转移酶进行筛选,获得3个能够催化酪醇合成淫羊藿次苷的糖基转移酶YjiC、YdhE、YojK,分别在地衣芽胞杆菌DW2中过表达这3种糖基转移酶,发现3者催化酪醇合成淫羊藿次苷D2的能力由强到弱依次为YjiC、YdhE、YojK,其中过表达YjiC的重组菌株ID02,其淫羊藿次苷D2产量达到1694 mg/L。此外,对UDP-葡萄糖合成关键基因pgcA和gtaB进行了共表达,发现强化UDP-葡萄糖合成途径对合成高淫羊藿次苷D2没有帮助,且菌体生长受到了一定的抑制,表明地衣芽胞杆菌DW2中,内源UDP-葡萄糖代谢途径足以支持糖基化反应的消耗,而过量生产UDP-葡萄糖反而会给菌体造成代谢负担。通过优化发酵培养基MM,确定了最佳培养条件为NH4Cl 3 g/L、磷酸缓冲盐75 mmol/L、无酵母粉添加,在此培养条件下,重组菌株ID02发酵48 h时转化酪醇合成淫羊藿次苷D2的产量达到4010 mg/L。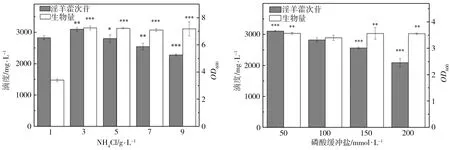
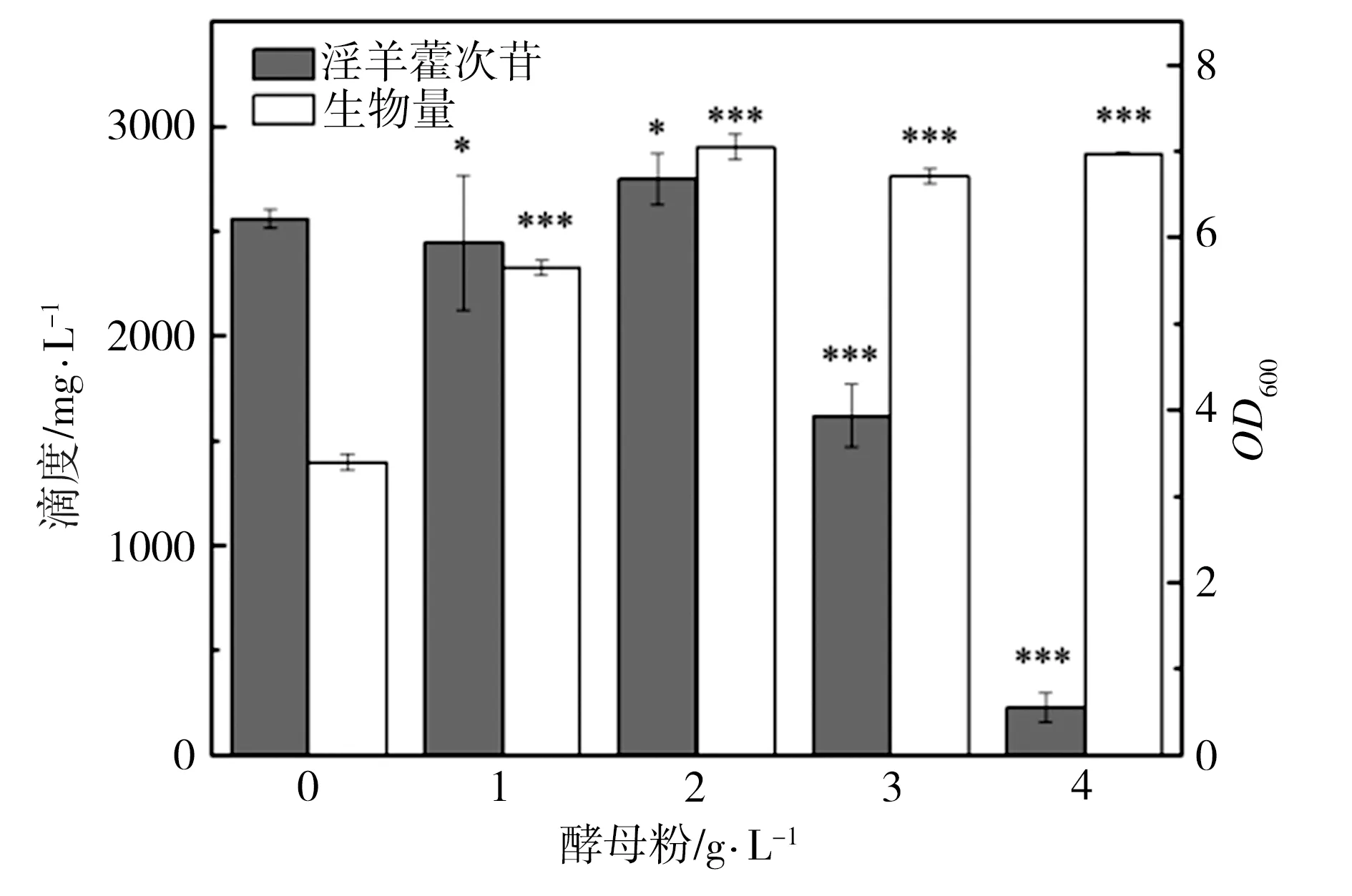
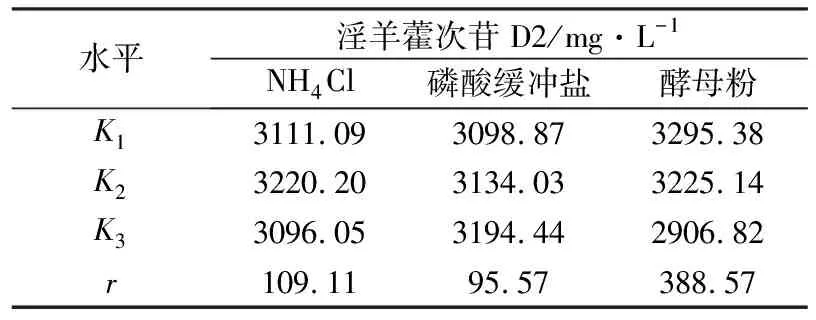
2.4 发酵培养基正交优化对淫羊藿次苷D2产量的影响
2.5 讨论
3 结语

