金属负载型分子筛催化剂的NH3-SCR机理研究进展
张文博 ,陈佳玲,* ,郭 立 ,郑 伟 ,王光华 ,郑申棵 ,吴晓琴,*
(1.武汉科技大学 化学与化工学院 煤转化与新型炭材料湖北省重点实验室,湖北 武汉 430081;2.黄冈师范学院 化学化工学院 催化材料制备与应用湖北省重点实验室,湖北 黄冈 438000)
氮氧化物(NOx)是常见的五种氮的氧化物(N2O、NO、N2O3、NO2和N2O5)的统称,其中,NO和NO2在大气环境中的比例最高,是现今大气的主要污染物。NOx会导致严重的环境问题,如酸雨、光化学烟雾、臭氧消耗和烟雾等,并危害人类健康[1]。大气中约90%的NOx排放来自化石燃料的燃烧,如燃煤发电厂(固定源)和机动车辆(移动源)中的煤和燃料油的燃烧[2]。由于对环境和人体健康的负面影响,世界范围内各国对大气中NOx的排放控制标准越来越严格。根据美国清洁空气法案,工业锅炉的排放烟气中NOx不能超过553.5 mg/m3。而中国的NOx排放标准更为严格,根据中国GB 13223—2011国标要求,新建发电厂和天然气锅炉中的烟气排放中NOx不能超过100 mg/m3,天然气透平装置中不能超过 50 mg/m3。此外,针对机动车的尾气排放,根据国标GB 18352.6—2016,中国将于2023实施更为严格的机动车尾气排放标准(从 2020 年的 60 mg/km 调整到 35 mg/km)[3]。因此,针对工业污染源尾气中NOx的治理具有重要的现实意义。
目前,NOx的脱除主要有三种技术研究方向:催化分解技术、储存还原技术和选择性催化还原技术(Selective Catalytic Reduction,简称 SCR 技术)[1]。NOx催化分解技术是指利用催化反应将NOx直接分解为N2和O2。NOx储存还原技术是指在稀燃条件下储存NOx,在富燃条件下将NOx还原的技术。由于这两种技术的催化剂容易中毒、活性和稳定性有待提高,目前,还无法进行大规模的应用。而SCR技术,是指在催化剂的作用下,利用还原剂选择性地将烟气中的NOx还原,得到N2和H2O。根据还原剂的不同,SCR技术可以分为碳氢化合物选择性催化还原技术(HC-SCR)和氨选择性催化还原技术(NH3-SCR)。HC-SCR技术的设计理念是以车载燃油作为还原剂(如丙烷、烃类)的来源,通过催化剂作用使碳氢组分与NOx发生选择性氧化还原反应,主要采用Ag/Al2O3等作为催化剂,但存在NOx净化效率偏低、活性温度窗口窄和催化剂容易积炭等缺点,尚未达到大规模实际应用的要求[4, 5]。氨选择性催化还原(NH3-SCR,主要反应为:4 NO + 4 NH3+ O2→ 4 N2+ 6 H2O)是目前广泛应用的脱硝技术,可以使用液氨或者尿素作为NH3源;由于其高效率、低成本的特征已成为主要的固定源和移动源脱硝技术[6, 7]。
钒钛基催化剂是应用最广泛的固定源脱硝NH3-SCR催化剂之一。目前,中国科研工作者已制备出具有宽活性温度窗口的铈改性钒钛基催化剂 CeO2-V2O5/TiO2-ZrO2,其在 150−475 ℃ 表现出80%以上的脱硝活性[8],但此类催化剂容易被烟气中的SO2毒化;此外,钒类催化剂具有生物毒性,因此该类催化剂无法适应越来越严格的环保要求[9],欧美等一些发达国家已陆续禁止在移动源脱硝体系中使用钒钛基催化剂[10]。为此,研究者们开发了新型钒酸盐催化剂[11],以及其他过渡金属催化剂如 Cu 基、Fe 基、Mn 基氧化物催化剂[12, 13],然而上述问题仍未得到有效解决。
自1986年Iwamoto等[14]发现Cu/ZSM-5在NH3-SCR反应中具有良好的催化活性以来,由于具有较宽的活性温度窗口(200−600 ℃)、较高的催化活性和水热稳定性,金属负载型分子筛催化剂受到广泛关注[15]。此类催化剂上,分子筛载体规则、稳定的骨架结构和较高的比表面积,赋予了其较高的热和水热稳定性,并确保了活性金属的高度分散,以及反应物和产物的高效扩散,促进反应的迅速进行。此外,分子筛上往往具有丰富的表面酸性位点,在NH3-SCR反应中,不仅能起到吸附和活化NH3的作用,还能通过静电平衡作用铆定活性金属正离子,从而提高活性金属离子的稳定性。同时,由于静电稳定作用,分子筛上活性金属的负载量和分布,还可以通过高效匹配分子筛载体的硅铝比(硅铝分子筛中)或Si含量(硅铝磷分子筛中),以及金属物种的负载量来进行调控[16 − 18],从而进一步改善催化剂的活性和水热稳定性。因此,金属负载型分子筛催化剂成为NH3-SCR脱硝领域的重要研究内容。
大量研究表明[19 − 21],由于能高效活化 NO、催化氧化还原循环,并具有较宽的氧化还原活性温度窗口,Cu和Fe负载的分子筛催化剂是NH3-SCR领域的研究热点。由于氧化还原性能的差异,Cu基分子筛催化剂的最佳NH3-SCR温度窗口为150−300 ℃,超过 300 ℃,容易导致氨氧化副反应的发生,使得NH3-SCR催化活性下降;与Cu基分子筛相比,Fe基分子筛具有更高的还原温度,此外Fe物种能促进N2O副产物的分解,因此,后者具有明显的中高温NH3-SCR催化优势,其最佳温度窗口为 250−500 ℃。
目前,研究者们已发现多种高效的Cu或Fe改性NH3-SCR分子筛催化剂,如Cu/SSZ-13、Fe/SSZ-13、Fe/Beta、Cu/SAPO-34、Cu/LTA 等。通过详细调变催化剂上金属物种的含量[22]、分布[23],分子筛载体的种类[24]等,研究者们相继开发出了具有工业潜力的Cu/ZSM-5、Fe/Beta、Cu/SSZ-13催化剂。目前,小孔型Cu/SSZ-13由于具有宽温度窗口、高NH3-SCR活性和水热稳定性,已在欧美成功应用于柴油车尾气脱除中,但其仍存在高温活性差、水热稳定性差和耐硫性能不佳等问题[25]。因此,开发具有宽温度窗口、高水热稳定性的金属负载型分子筛催化剂是NH3-SCR催化剂研发函待解决的首要问题。
NH3-SCR体系中的化学反应是相当复杂的,根据反应气中不同的NO/NOx比值,NH3-SCR反应一般分为标准NH3-SCR、快速NH3-SCR和NO2-SCR(慢速NH3-SCR)。当反应温度低于400 ℃时,式(1)是主要反应,NO与注入的还原剂NH3发生反应且化学计量比为1∶1[26]。Antonio等[27]通过研究不同反应温度下原料气组成的影响,探究了Fe/Beta分子筛上的NH3-SCR反应途径,他们发现,在140−160 ℃,当 NO 与NO2的摩尔进料比为 1∶1 时,主要发生快速NH3-SCR。

这三种途径中,NO2-SCR报道的最少,Antonio等[27, 28]利用瞬态反应实验,研究了NO2-SCR在Fe/ZSM-5分子筛上的反应历程,通过在恒温状态(190 ℃)下,向含1% H2O 的He原料气中阶跃性的加入0.1%的NH3或NO2,实时检测出口气体种类及浓度的变化情况,提出了NO2歧化生成亚硝酸盐和硝酸盐的NO2-SCR反应机理(式(4)−(8))。此外,他们还发现同一分子筛催化剂上,NO2-SCR反应的反应速率明显低于标准NH3-SCR和快速NH3-SCR。

当反应温度高于300 ℃,NH3-SCR反应过程中会发生明显的副反应:NO和NH3的氧化反应。其中,NO 主要被氧化为 NO2(> 300 ℃)(式 (9)),NH3则被氧化为 N2、NO、NO2、N2O(> 400 ℃)(式(10)−(13)),在金属负载 NH3-SCR 反应中,氨氧化副反应的主要产物是 N2(> 90%),其余产物很少[29]。此外,NH3-SCR体系中,高温下的氧化副反应,会随反应温度的升高而增强,最终导致标准NH3-SCR反应无法正常发生,NOx转化率迅速下降。

在NH3-SCR反应体系中,当温度低于250 ℃时,还会有硝酸铵的生成和分解发生。当反应体系中 NO2含量较高(NO2/NOx> 50%)时,NH3在低于200 ℃温度下,会生成硝酸铵(式(14)),部分硝酸铵会分解生成N2O(式(15))。此外,低温下生成的部分NH4NO3物种还会覆盖在催化剂表面,且不易分解,最终导致催化剂活性位点被覆盖,失去脱硝活性。

综上,一般认为NOx的转化速率按快速NH3-SCR > 标准 NH3-SCR > NO2-SCR 的顺序依次降低,且只有快速NH3-SCR完成后,标准NH3-SCR和NO2-SCR才能进行[4];每种NH3-SCR反应均伴随着吸附态硝酸铵、亚硝酸铵物种的形成和分解;在众多副反应中,不仅有NO、NO2、N2O、N2等副产物的生成,NH3也被大量消耗从而限制了NOx转化率的提高。因此,在研究催化剂反应机理的基础上,通过对催化剂进行定向设计,可以减少副反应的发生,从而提高催化剂的NH3-SCR反应活性。
研究金属负载型分子筛催化剂在NH3-SCR反应中的反应机理,如活性金属物种的种类与分布[30]、活性金属物种在分子筛骨架中的最佳催化位点[31],能为催化剂上活性位点的定向设计提供指导。此外,对特定催化剂体系上具体催化路径,和动力学反应机制的探究[32, 33],有助于针对性的开发具有特定反应路径的催化剂,并从调控反应条件的角度,优化反应动力学,加快NH3-SCR反应速率,从而提高催化剂的反应性能。
目前,研究者对金属负载型分子筛催化剂的NH3-SCR反应机制的研究并没有达成统一共识[34],其原因在于:(1)由于金属活性物种物理化学性质的差异,不同催化剂体系(如Cu基和Fe基分子筛催化剂)催化NH3-SCR反应时的具体活性物种、氧化还原途径等存在较大的差异,这导致其氧化还原反应机理的复杂性。(2)NH3-SCR反应机理的研究,需要建立在对金属活性物种有准确的认识基础上,因此依赖于多种表征手段,甚至原位表征。而金属负载型分子筛催化剂上,金属物种的存在状态往往较多,且随分子筛载体的拓扑结构、硅铝比、负载量而变化,这使得对活性物种的定性、定量表征存在一定的难度。此外,当采用离线表征手段时,获得的金属物种存在状态往往不能准确反映其在真实NH3-SCR气氛中的化学环境,这也增加了金属活性物种状态分析的复杂性。(3)反应机理的本征动力学研究的复杂性:由于标准 NH3-SCR 反应温度范围较宽(150−600 ℃),且反应气氛中存在多种气体(NH3、NO、O2、H2O、N2O、N2等),反应条件的复杂性导致反应速率加快、副反应增多,从而影响动力学参数的测定。因此,对标准NH3-SCR的本征动力学研究,需要建立在排除内外扩散和副反应的基础上,通常在较低的反应温度下进行,但这会导致反应速率的下降,影响测定结果的准确性。此外,即使在同一金属负载型分子筛催化剂体系中,由于制备方法的差异,各催化剂上活性金属的种类和分布也会存在差异,从而影响其在NH3-SCR反应中的主要反应途径[35, 36]。除此之外,分子筛载体也是影响催化剂上反应动力学的重要因素,不同分子筛载体具有不同的孔道结构和物理化学性质,会影响催化剂的扩散性能[24]、活性金属落位和反应途径[37]。这些因素,都会导致研究者们获得的NH3-SCR反应中表观动力学参数的差异,从而使得对本征动力学的研究存在分歧。
为了正确认识以上问题,本文详细调研了文献,对铁和铜负载型分子筛催化剂在NH3-SCR领域的研究进展、活性位点和反应路径进行了总结,重点阐述了反应过程中活性物种及反应物分子的行为,反应中间产物的种类、结构及作用。此外,还介绍了采用密度泛函理论研究NH3-SCR反应机理的相关进展,以及NH3-SCR反应动力学的研究方法,并对比了不同催化剂体系下的动力学参数,为金属改性分子筛催化剂的NH3-SCR反应机理研究提供方法与思路。
1 Fe 基分子筛催化剂
1.1 催化剂研究
20世纪90年代,Fe/ZSM-5分子筛被首次开发为NH3-SCR催化剂[38],该催化剂在较宽的温度窗口(350−550 ℃)表现出 100% 的 NOx转化率[22],明显优于常规 V2O5-WO3/TiO2催化剂(320−450 ℃);但由于铁物种的氧化还原起活温度高,催化剂在250 ℃以下活性较低[39],此外,催化剂在高温水热条件下容易水热失活[40],这两个关键因素限制了其大规模的应用。此后,Qi等[41]发现,在催化剂的制备过程中,提高活性铁物种的分散性能,可以明显提高Fe/ZSM-5的低温活性,并使NOx转化率提升到 70% 左右(< 300 ℃)。
之后,研究者把注意集中在具有大孔结构的Fe/Beta分子筛上,发现使用不同制备方法制备的Fe/Beta在NH3-SCR催化活性和热稳定性上均优于 Fe/ZSM-5[42 − 44]。然而,Fe-Beta 分子筛的水热稳定性仍不能满足实际NH3-SCR的工业应用要求,如经历较长时间的水热处理后催化剂明显失活,无法满足所规定的催化剂高温催化耐久性要求[45];此外,由于具有较大的孔径和较高的比表面积原因,分子筛内易吸附大量碳氢化合物,因此BEA拓扑结构很容易被燃料的不完全燃烧所产生的高热量碳氢化合物所毒化、抑制[45],形成碳质沉积物而阻断反应活性位点与分子筛内氧化还原位点相互作用,造成催化剂失活。
2009年,Bull等[46]在专利中首次报道了具有高NH3-SCR活性的Cu/SSZ-13分子筛[46]。随后,Kwak等[47]对比了Cu/ZSM-5、Cu/Beta和Cu/SSZ-13分子筛的NH3-SCR活性,发现小孔型的Cu/SSZ-13表现出更高的反应活性。此外,研究者发现,由于SSZ-13具有八元环的CHA小孔结构,能抑制骨架脱铝(骨架脱铝形成的铝氧化物无法从孔口脱出)从而稳定活性铜物种,同时减少分子筛对碳氢化合物和水的吸附,避免其对活性中心的毒化,在NH3-SCR反应中具有高水热稳定性和抗碳氢化合物毒化性能[48, 49]。Gao 等[50]也对含铁的Fe/SSZ-13进行了大量研究,发现新鲜样品中铁物种多以骨架外阳离子存在(其中单体和二聚态分别为[Fe(OH)2]+和 [HO-Fe-O-Fe-OH]2+),经过苛刻条件下的水热老化后分子筛结构仍保持完整且在400 ℃以上保持了较高脱硝活性,但300 ℃下NH3-SCR活性下降明显;最后他们提出,将Fe/SSZ-13与Cu/SSZ-13混合使用应用于NH3-SCR反应中,以进一步拓宽Fe/SSZ-13的活性温度窗口。
此外,与Fe/SSZ-13具有相同CHA结构、但不同元素组成的Fe/SAPO-34分子筛,也是一种优良的NH3-SCR催化剂。Andonova等[51]发现,Fe/SAPO-34在300−600 ℃的条件下,具有超过80%的NOx转化率,且由于水热老化过程中出现铁物种的迁移、形成更稳定的NH3-SCR活性铁位点的原因,水热老化后其NH3-SCR催化活性进一步提高。其特殊的小孔径结构也保证了体积较大的烃类物质无法毒害催化剂,从而提高催化剂的稳定性[52]。由于Fe/SAPO-34在高温下的优异活性和水热稳定性,研究者提出,将Fe/SAPO-34与商用Cu/CHA混合作为催化剂使用,从而同时拓宽活性温度窗口和提高NH3-SCR反应活性[53]。但有研究指出Fe/SAPO-34在70 ℃下会因大量金属位点转化为非活跃状态而失去脱硝活性[54],因此该类催化剂仍需进一步改良,如引入第二种阳离子(Cu或Mn)以提高其抗H2O和碳氢化合物的性能[55]。
除上述分子筛外,研究者还开发了其他小孔型NH3-SCR分子筛。由于AEI型Fe-SSZ-39分子筛与CHA类分子筛[56]具有相似的双六环(D6R)结构,其在NH3-SCR反应中同样表现出优异的低温活性和高水热稳定性。此外,一锅法能显著改善铁物种在分子筛内的分布情况,该方法合成的Fe-SSZ-39催化剂在300−550 ℃具有90%以上的转化率;且小孔径的拓扑结构也导致了其在600 ℃中水热老化后仍具有较高的脱硝活性[57]。Ryu等[58]发现,铁离子和铁氧化物团簇在高硅铝比的Fe/LTA内的热力学稳定性明显高于Fe/SSZ-13,因此Fe/LTA分子筛在各个温度都表现出优于Fe/SSZ-13的性能,甚至在水热老化温度达到900 ℃时仍保持较高活性。高硅铝比的LTA分子筛作为稳定的NH3-SCR载体,有希望代替CHA类分子筛。
然而,用于NH3-SCR的高效催化剂并没有完全依赖于小孔径的分子筛,采用特殊方法制备的中孔分子筛也被证明具有较高的NH3-SCR催化潜力。近期,本课题组报道了一锅法制备的具有十元环孔道结构MWW结构的Fe-MCM-22分子筛,由于一锅法能确保活性铁物种的更好分散,其在190−490 ℃具有约80%的NOx转化率和100%的N2选择性,使铁基分子筛低温活性差的问题得到一定的解决[23]。此外,Ryu等[56]采用液态离子交换法,制备了具有三维十二元环孔道结构的Fe/UZM-35催化剂,发现由于能更好地铆定独立Fe3+物种,Fe/UZM-35上活性Fe3+物种高度富集,其低温下(<300 ℃)脱硝活性明显高于Fe/SSZ-13和Fe/Beta催化剂。以上研究表明,催化剂的制备方式和分子筛载体的物理化学性质,能显著影响催化剂在NH3-SCR反应中的催化性能。
表1中总结了具有不同孔道拓扑结构的铁基分子筛催化剂及其NH3-SCR性能指标。一般来说,与机械混合法相比,使用一锅法制备铁基分子筛催化剂的脱硝活性往往较高,这是由于一锅法能确保活性铁物种更好的分散。此外,与大孔径分子筛(如ZSM-5、Beta)相比,由于小孔径分子筛(如CHA)能抑制碳氢化合物进入孔道,并阻碍水热老化过程中分子筛脱铝,具有更高的水热稳定性及抗碳氢化合物性能。
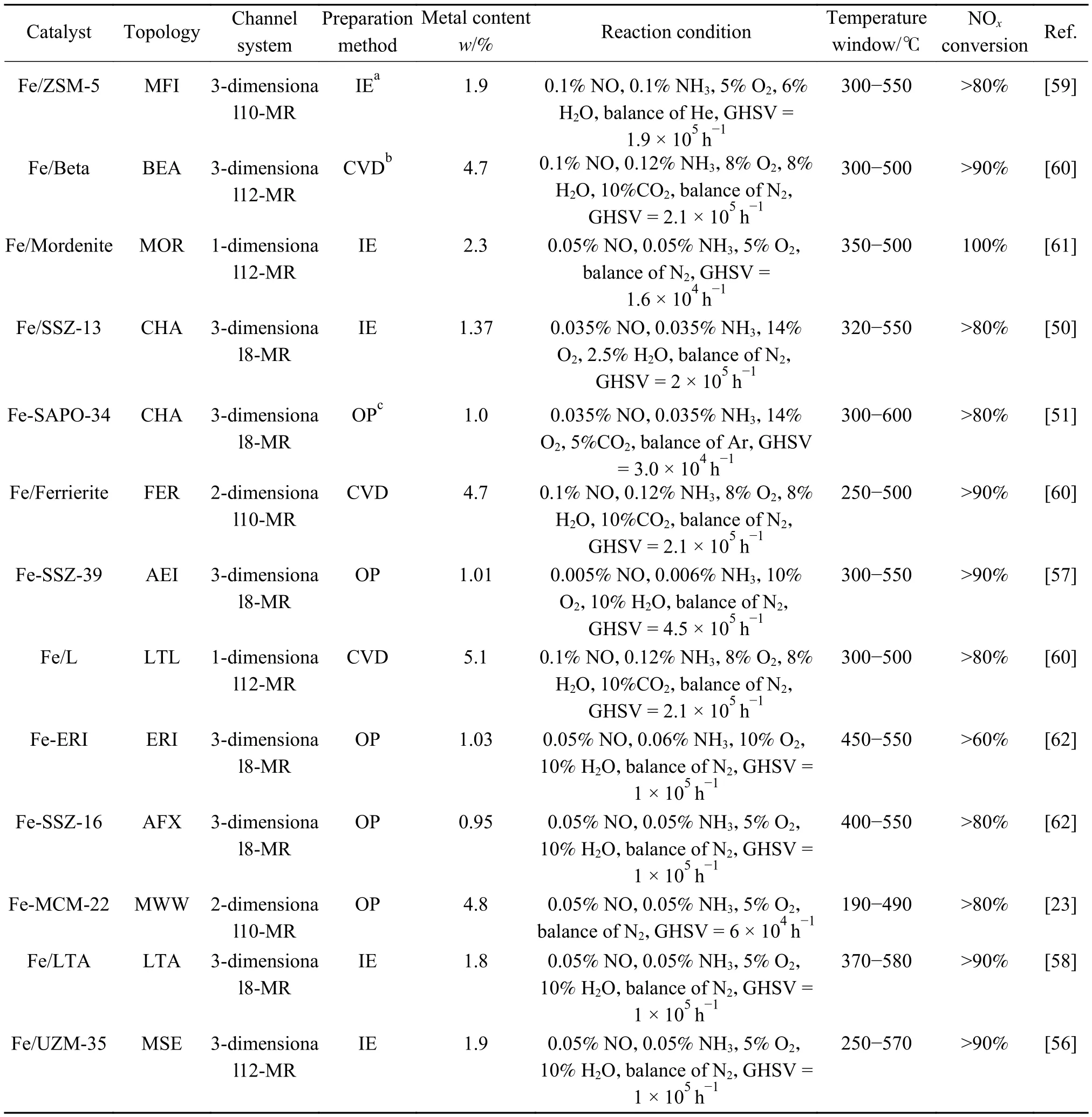
表1 代表性的铁基NH3-SCR分子筛催化剂Table 1 Summary of representative Fe-based NH3-SCR zeolites catalysts
结合以上分析,铁基分子筛催化剂研发方向为:(1)选择具有合适拓扑结构的分子筛载体,从而优化活性金属物种的分布,并增加其稳定性,进而拓宽催化剂的NH3-SCR温度窗口和水热稳定性;(2)改进催化剂的制备方法,如采用一锅法等方法优化活性铁物种的分布;(3)改良现有催化剂,如引入第二种阳离子(Cu或Mn),以提高其低温活性和水热稳定性等。
1.2 活性位点
铁基分子筛催化剂上的NH3-SCR反应主要发生在活性铁位点上,因此,研究活性物种的种类、含量及分布,对于理解NH3-SCR反应机制至关重要。Javier等[63]在探究Fe/ZSM-5催化剂上,各类铁物种的含量与NH3-SCR催化性能间的构效关系时,结合EPR、UV-vis表征结果发现,铁基分子筛上的Fe物种种类有:独立铁离子、低聚的FexOy物种、高度聚集的铁氧化物种如Fe2O3等[63, 64]。进一步,Yuan等[65]采用一锅法制备了具有不同铁含量的Fe-ZSM-5分子筛,并通过EPR、UV-vis、H2-TPR等手段对样品中的铁物种及含量进行定性和定量分析,他们发现,Fe/ZSM-5的NH3-SCR催化活性,与EPR谱图中归属于具有高对称性的八配位态Fe3+的特征信号峰强度呈正相关,认为这种铁物种是Fe/ZSM-5上的主要NH3-SCR活性中心。Gao等[22]制备了一系列具有不同铁含量的Fe/SSZ-13分子筛,对其进行低温(8 K)下穆斯堡尔谱研究,可探测到催化剂上的三类铁物种:水合状态的独立 Fe2+物种(Fe(Ⅱ)-P);双核 Fe3+物种,即 [HO-Fe-O-Fe-OH]2+物种(Fe(Ⅲ)-P);Fe(Ⅲ)-M 铁物种,包括独立Fe3+和多核FexOy铁物种(三核及更高度聚集的FexOy物种或纳米颗粒)。基于此,结合动力学催化实验,他们发现:标准NH3-SCR反应中,独立Fe3+为低温下(< 300 ℃)的主要活性中心,[HO-Fe-O-Fe-OH]2+物种为高温下(≥ 300 ℃)的主要活性中心;NO氧化反应中,双核Fe3+物种为主要活性中心,NH3氧化反应中的主要活性中心为高聚态FexOy物种。
长期以来,铁基分子筛低温下(< 250 ℃)的低NH3-SCR活性,是制约其商业化进程的关键因素之一[39],研究者认为有两个原因:(1)低温下,NH3会与活性铁位点强烈结合,从而阻止NOx与铁物种进行配位并活化NOx;(2)由于NH3的强还原性,铁物种“被滞留”在二价,使得低温下无法进行NO氧化从而完成氧化还原循环[40]。大量研究表明[28, 66],向增加原料气中添加 NO2,能显著提高含铁分子筛催化剂在250 ℃以下的NH3-SCR活性,因此原因(2)更有可能[67]。
除活性铁物种的种类外,铁物种在分子筛孔道内的空间分布,也显著影响其催化性能。Velez等[31]探讨了活性铁离子在ZSM-5沸石孔道中的位置,他们发现:位于α位点(十元环中的单体铁位点)的Fe3+是标准NH3-SCR的主要活性位点,而位于β位点(六元环中)和γ位点(五元环中)的Fe3+物种主要催化快速NH3-SCR反应。这与之前研究中[50, 64, 68, 69],Fe3+是 NH3-SCR 反应中唯一的活性位点是一致的,但由于孔道不同位置的空间约束不同,导致不同位点的铁物种的氧化还原活性存在差异,因此改善铁活性位点的空间分布也能增强其催化性能。
分子筛中活性铁位点的配位环境也是研究重点。科研人员普遍认为,NH3-SCR反应中铁基分子筛上活性铁物种的配位数为4[68];在反应过程中,NO吸附到铁位点后配位数增加到4到5之间[70]。配位数的增加说明铁位点除了与沸石结合外,还直接与一种反应物成键。如图1所示,Boubnov等[70]通过原位红外研究了不同反应条件下,Fe/ZSM-5分子筛在NH3-SCR反应中的配位变化情况;他们发现,NO与活性铁位点的配位是通过羟基氧原子形成配合物 [Fe2+−Oδ+H−N=O]实现的。Jiang 等[71]认为,相对于不是很稳定的铁胺配合物,稳定的[Fe(CN)5NO]−更有可能是生成的活性铁硝基配合物。综上,目前对活性铁物种与反应物NO的活化方式,研究者还没有达成共识。
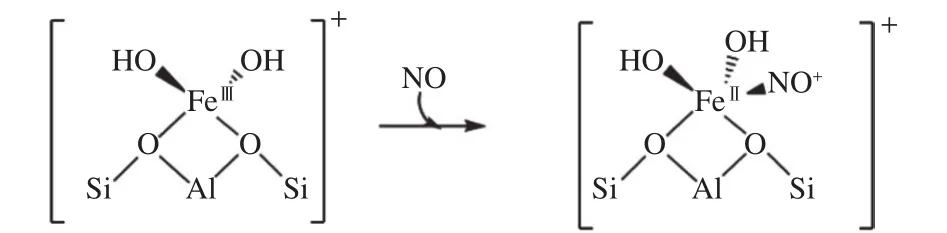
图1 铁基分子筛中 FeII 与 NO 的配位研究[70]Figure 1 Coordination of FeII with NO in Fe-based zeolite[70](with permissions from ACS publications)
总体来说,铁基分子筛催化剂在NH3-SCR反应中主要活性位点为独立的Fe3+物种,但由于反应条件的差异,不同温度下具体的活性铁物种存在形式不一样:当进行低温NH3-SCR反应时以[Fe(OH)]+为主,但在高温条件下以独立Fe3+为主。此外,分子筛载体的孔道结构的差异,也导致活性铁物种的空间结构的细微差别:由于位于不同分子筛孔道内对活性铁物种的空间约束作用不同,不同位点的Fe3+物种的氧化还原活性存在差异,这导致其在NH3-SCR反应中的活性也不一样。
1.3 反应路径
关于铁基分子筛的NH3-SCR反应活性位点的研究已逐渐形成共识[3, 27, 28, 72, 73],但对于不同催化剂上的具体反应路径,仍有很多不同报道[22, 72]。一般来说[72],低温下的NH3-SCR反应主要遵循Langmuir-Hinshelwood机理(L-H机理),即NO和NH3同时吸附在催化剂上,并相互作用生成过渡态中间体后分解为N2和H2O。如图2所示,L-H机理中,NH3吸附在酸位点上形成,NO被高价金属氧化位点氧化形成活性双齿硝酸盐、桥连硝酸盐或单齿亚硝酸盐,它们与反应形成NH4NO2或NH4NO3后,分解为N2和H2O[3],同时高价的氧化还原位点被还原为低价后,可被O2再氧化,从而完成氧化还原循环。
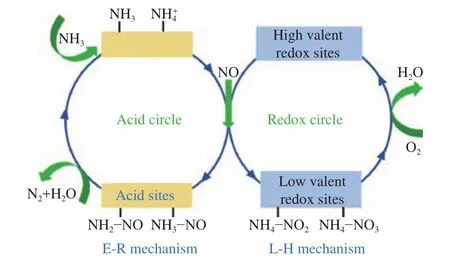
图2 金属负载型分子筛催化剂上 NH3-SCR 的反应路径[3]Figure 2 NH3-SCR reaction pathway over metal-based zeolite catalysts[3](with permissions from ACS publications)
与L-H机理不同,研究者认为,高温下的NH3-SCR更多地遵循Eley-Rideal机理(E-R机理)[3]。ER机理中,仅NH3分子吸附在催化剂上,气相NO分子与吸附、活化后的NH3反应,生成过渡态中间体后分解为N2和H2O。在此途径中,NH3首先被吸附在酸性位点上形成NH3和/或,然后被NO和O2氧化形成活性中间体NH2NO和/或NH3NO,最后分解形成N2和H2O。
从图2中可知,L-H与E-R路径形成的反应活性中间体存在差异,因此,通过中间体的捕捉可以判断具体反应路径。Antonio等[27, 28]在研究Fe/ZSM-5催化剂上快速NH3-SCR反应机理时,使用质谱及紫外分析技术,对反应出口气体组成进行在线检测,发现NH4NO3和NH4NO2是反应中的关键中间体;他们发现,在没有通入NO2存在的情况下,表面硝酸盐能明显增加低温(< 250 ℃)下的脱硝反应速率,表明NO与硝酸盐之间的氧化还原反应是速控步骤。但Jiang等[71]提出了Fe基分子筛上的NH3-SCR反应的E-R机制:在标准NH3-SCR反应中,NO首先与活性[FeIIIO]+铁位点发生氧化还原反应,生成由两个亚硝酸基联接的二聚体铁配合物 [FeⅡO(NO+)-(NO+)OFeⅡ]2+(如图3(a)所示),然后与NH3亲核加成形成[FeⅡO(N(OH))-NH2]+配合物(如图3(b)所示),该配物内很容易形成分子内氢键[74, 75],从而生成 [FeII(OH)]+和 NH2NO,后者迅速分解为N2和H2O。Kovarik等[76]通过原位红外光谱研究了Fe/SSZ-13上NH3-SCR反应过程中的活性物种及反应机制,发现不同活性铁物种的反应途径不一样:[Fe(OH)2]+可以活化NO生成HONO,[HO-Fe-O-Fe-OH]2+二聚体和较大的含铁团簇可以活化NO生成NO2,活化后的NO物种与NH3通过反应(16)和(17)生成 N2和 H2O。
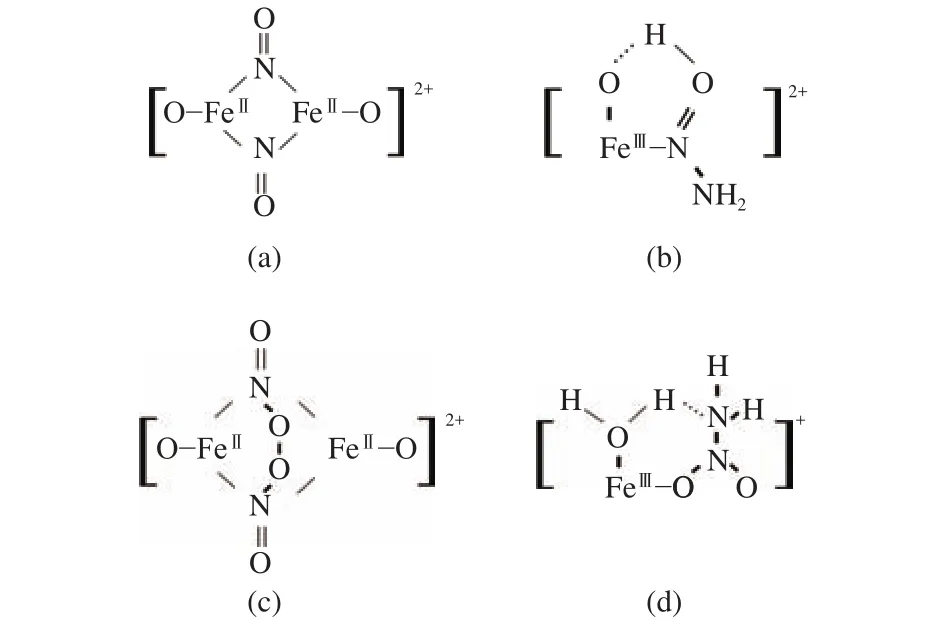
图3 铁基分子筛在 NH3-SCR 反应中可能形成的中间态过渡配合物Figure 3 Possible intermediate complexes formed on Fe-based zeolites in NH3-SCR

以上研究表明,对Fe负载型分子筛催化剂上的NH3-SCR反应,具体反应机制较为复杂,与反应体系、活性铁物种种类、反应条件等因素有关。
此外,由于二价铁物种的氧化能垒较高,铁基分子筛上的活性铁位点的氧化半循环是NH3-SCR中的关键步骤[19]。Kovarik等[76]通过Mössbauer谱,结合ICP-AES的手段,对Fe/SSZ-13上各种铁物进行了定量测定,研究发现,NH3-SCR反应中,独立Fe2+无法被O2直接氧化为独立Fe3+,从而不能完成氧化半循环;而[HO-Fe-O-Fe-OH]2+二聚体和较大的含铁团簇,容易被O2氧化为三价铁物种,从而完成氧化半循环。Jiang等[71]发现,在标准NH3-SCR 反应中,[FeⅡ(OH)]+物种可直接被O2氧化,再生为[FeIIIO]+物种,该四电子的氧化还原过程在高温下很容易发生,但在低温下(< 250 ℃)难以发生[71]。在低温下,活性三价铁物种的再生主要通过O2氧化二聚体铁配合物实现:O2可将二聚体铁物种 [FeⅡO(NO+)-(NO+)OFeⅡ]2+(如图3(a)所示)氧化为活泼的过氧亚硝酸盐二聚体([FeⅡON(O)OON(O) FeⅡ]2+) (如图3(c)所示),后者的过氧键不稳定,断裂后生成NO2,并将二价铁氧化形成[FeIIIO]+,从而恢复催化活性[77, 78],但这一过程速率很慢,导致反应活性较低。然而,当反应气氛中存在NO2时,能提供新的途径促进活性位点的氧化还原循环,从而加速 NH3-SCR 过程发生:低温下 (< 250 ℃),NO 和 NO2可与 [FeⅡ(OH)]+作用生成 [FeⅡO(NO+)-(NO+)OFeⅡ]2+(如图3(a)所示),之后其继续与 NH3亲核加成,通过形成[FeⅡO(N(OH))-NH2]+配合物(如图3(b)所示),最终生成N2和H2O,即通过快速NH3-SCR反应途径来避开FeII的氧化半循环;高 温 下 (≥ 250 ℃),NH3和 NO2可 与 [FeII(OH)]+形成络合物(如图3(d)所示),该络合物不稳定,氢转移后分解为[FeIIIO]+、H2O和NH2NO,后者最终生成N2和H2O,从而实现二价铁物种的氧化再生。因此,二价铁物种的氧化半循环的难易,与铁物种的种类,以及反应气氛有关。与独立Fe2+物种相比,由于二聚的Fe2+物种更容易被O2氧化,选择性的提高催化剂中二聚铁物种的浓度,有利于NH3-SCR的氧化半循环发生,从而提高催化剂的反应活性。此外,向反应气氛中添加适量的NO2,也有利于二价铁物种的氧化,并提供新的反应途径,从而加速NH3-SCR反应的发生。
综上,铁基分子筛上NH3-SCR反应过程中,二聚体Fe3+物种含量较高或形成此类物种难度较低的铁基分子筛可能拥有更高的反应速率,这与前文中提到的较大孔径的 Fe-UZM-35[56]、Fe-Beta[42, 44]分子筛拥有更好低温活性相符,较大的孔径可以有效降低反应阻力,形成更多的二聚体Fe3+位点,增加NH3-SCR反应速率。温度不同会导致反应路径的差异,低于250 ℃下NO2能提供新的途径来加快反应速率,但低温下不同铁物种氧化活性不同,其氧化半循环是活性铁物种再生的关键部分[19]。在反应过程中,中间产物大多为硝酸盐或亚硝酸盐类物质(NH3-SCR反应的速控步骤),此类物质能有效脱出N2和H2O使反应高效进行,不同中间产物可能代表反应路径的不同,反应机理也存在差异。对反应中间体的研究利于优化反应速控步骤,改善铁基分子筛的脱硝性能。
2 Cu 基分子筛催化剂
2.1 催化剂研究
铜基和铁基分子筛在NH3-SCR反应中都有很高的选择性与活性,但化学性质与催化性能却有很大不同[71, 79, 80]:(1)Fe 与 NO 形成强配合物且与氨形成弱配合物,而Cu与NO、NH3的的配位强弱顺序相反;(2)Fe具有亲氧性,与含铁分子筛中的骨架氧原子配位且可以牢固的结合在骨架上,而Cu则被分子筛上吸附的NH3“溶剂化”[71],在分子筛孔道内容易流动和迁移。这些化学性质的差异导致了两者在催化活性方面的差异[27, 40, 67]:(1)低温下(< 250 ℃),铜基分子筛具有较高的 NH3-SCR 活性,而铁基分子筛存在较强的NH3抑制现象,导致其较低的NOx转化率;(2)铜基分子筛对反应气氛中NO2/NOx比例不敏感,即标准NH3-SCR与快速NH3-SCR之间的NOx转化率差异非常小,而由于铁物种更亲氧,铁基分子筛对NO2更敏感,NO2/NOx= 0.5 为低温下最佳进料比;(3)铁基分子筛水热老化过程中会形成的高度聚集铁氧化物种不易迁移和流动,对催化剂的破坏性较小;而由于铜物种容易被水溶剂化,且具有很高的迁移速率和流动性,因此铜基相比铁基分子筛的水热稳定性一般较差。
由于铜基分子筛较宽的NH3-SCR活性温度窗口与较高的低温活性,其相关研究比同类的铁基分子筛提前3−5年。由于宽活性温度窗口(200−550 ℃)、高催化活性、高水热稳定性,具有八元环的小孔CHA结构的Cu/SSZ-13和Cu/SAPO-34分子筛是目前最有应用前景的NH3-SCR催化剂。尽管由于形成的金属氧化物种的迁移性和流动性的差异,铜基分子筛的水热稳定性无法与铁基分子筛相匹敌,但采用Fe/SSZ-13分子筛充当助催化剂的Cu/SSZ-13催化剂已经成功进行商业化使用[81];这是由于Fe基分子筛催化剂具有更高的高温脱硝活性,并能催化N2O的分解,因此,与Cu/SSZ-13催化剂相比,复合催化剂能大幅拓宽催化剂的活性温度窗口,提高产物中氮气的选择性[40]。
目前,商用铜基分子筛催化剂的重要缺点是高温下的低活性及低水热稳定性,为此科研人员相继开发出了多种铜基分子筛催化剂。Martinez-Franco等[82]发现,与CHA类分子筛拥有相似双六元环结构的AEI类分子筛Cu/SAPO-18、Cu/SSZ-39在NH3-SCR反应中也表现出优异的低温活性及水热稳定性,如Cu/SAPO-18分子筛在240−460 ℃具有90%以上的转化率,经750 ℃下水蒸气气氛老化13 h后,该分子筛晶体形貌保持良好且NH3-SCR活性变化不大。Xin等[83]发现,Cu/SAPO-44分子筛用于此反应时,在180−550 ℃都具有90%以上的脱硝活性和100%的N2选择性。Picone等[84]使用共模板法合成了具有SAV拓扑结构的Cu/SAPO STA-7分子筛,它具有与Cu/SAPO-34相似的骨架结构,因此,在NH3-SCR中也表现出优异的催化性能。
2017 年,Ryu 等[85]采用具有高硅铝比(Si/Al =16−23)的LTA分子筛为载体,通过离子交换法制备了一系列具有不同铜含量(0−0.65%)的Cu/LTA催化剂,研究发现,铜含量适中的(0.32%和0.48%)样品上,Cu/LTA具有与相似铜含量和硅铝比的Cu/SSZ-13相匹敌的NH3-SCR催化活性,但具有明显更优异的水热稳定性。即使在900 ℃、10%水蒸气的水热气氛下老化12 h后,Cu/LTA仍然具有良好的NH3-SCR活性,而Cu/SSZ-13迅速失活。表征发现,Cu/LTA催化剂中Cu2+离子仅位于分子筛单个六元环中心的离子交换位置,是NH3-SCR反应的活性中心;此外,六元环的小孔结构还能有效抑制水热老化中的脱铝现象,提高催化剂的水热稳定性。同时,LTA中较高的硅铝比,也能有效减少分子筛骨架脱铝现象,因此,高硅Cu/LTA具有比常规Cu/SSZ-13更高的抗水热老化能力,是一种极具潜力的高水热稳定性催化剂。后续研究表明[58, 86, 87], 高 硅 铝 比 LTA 分 子 筛 是 一 种 高 稳 定的NH3-SCR催化剂载体,这使其具备了替代商用CHA类NH3-SCR催化剂的潜力。
表2总结了具有不同孔道拓扑结构的铜基分子筛及其NH3-SCR性能指标。由于小孔分子筛具有更大的骨架原子密度,且小孔口能抑制分子筛脱铝和活性Cu物种的迁移,目前大量的研究集中在小孔分子筛催化剂的制备上。但Lee等[88]对比了具有大孔结构的Cu/UZM-35、Cu/ZSM-5、Cu/Beta和小孔型Cu/SSZ-13分子筛在NH3-SCR反应中的催化活性,发现具有十元环和十二元环大孔结构的Cu/UZM-35上独立Cu2+物种含量较高,其脱硝性能与Cu/SSZ-13接近。进一步研究发现,由于Cu/UZM-35分子筛上铜物种与分子筛骨架作用更强,其在750 ℃水热老化后仍保留了较高的脱硝活性和较宽的温度窗口,是一种具有应用潜力的大孔型分子筛催化剂。此研究表明,拥有十二元环的大孔分子筛Cu/UZM-35具有与小孔型Cu/SSZ-13相匹敌的脱硝活性与水热稳定性,因此开发高效脱硝催化剂并不严格局限于小孔径分子筛催化剂。

表2 代表性的铜基NH3-SCR分子筛催化剂总结 (续表2)
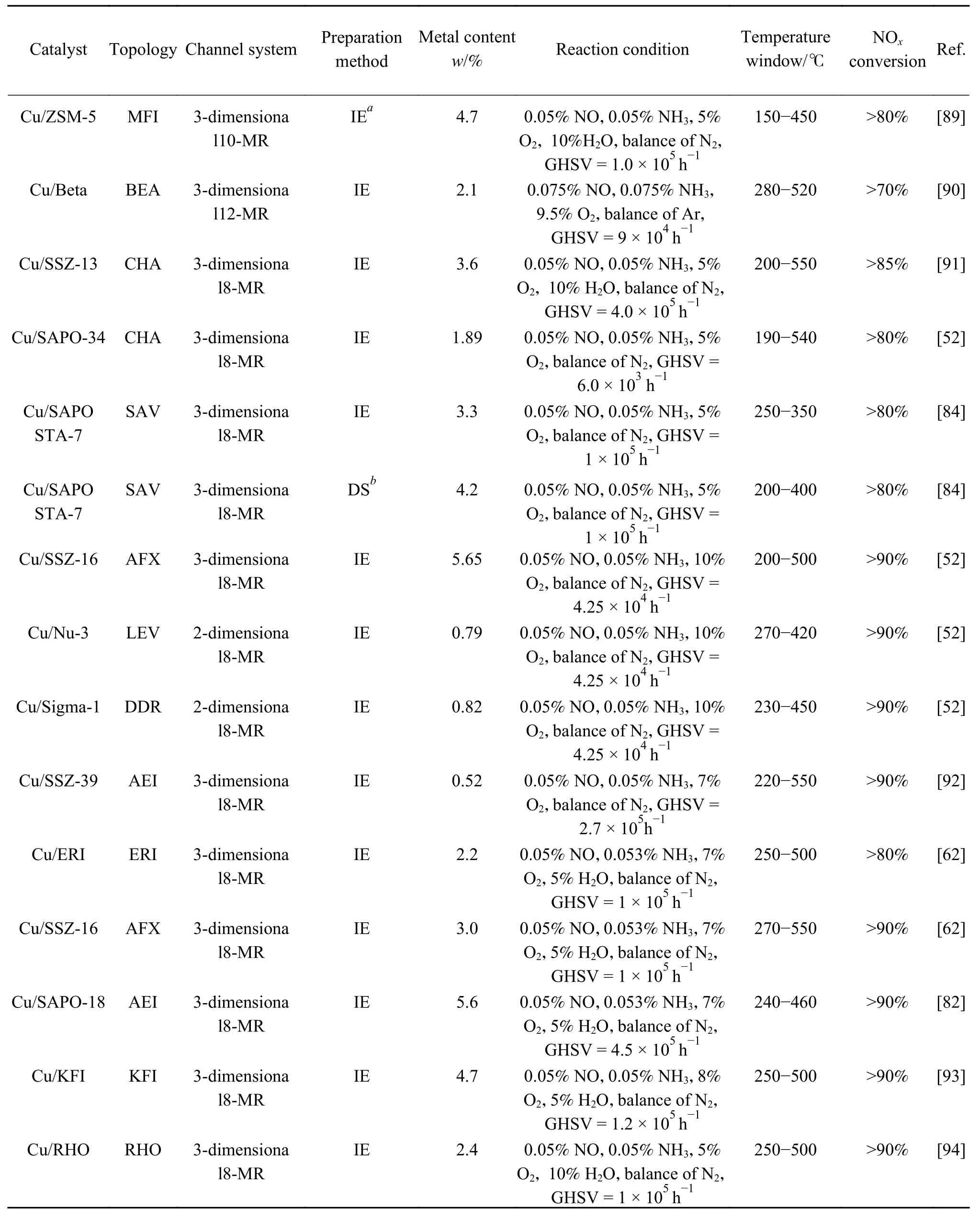
表2 代表性的铜基NH3-SCR分子筛催化剂总结Table 2 Summary of representative Cu-based NH3-SCR zeolites catalysts
2.2 活性位点
在铜基分子筛催化剂上,NH3-SCR的机理仍存在较大争议。出现分歧的关键问题如下:(1)活性催化位点是独立铜还是二聚态铜物种,或其他铜离子团簇;(2)由于NO2能催化快速NH3-SCR反应的发生,提高NOx的转化率,一些研究人员认为NO2的生成是NH3-SCR过程的决速步骤[95];但后续研究发现,实验测得NO2的生成速率远大于NH3-SCR的速率[31],因此,NO2的具体作用还存在争议;(3)铜物种在反应中的具体氧化还原反应路径还不清楚;(4)分子筛上Brönsted酸位点是否与Cu2+离子起金属-酸中心的协同催化作用。
目前,具有CHA结构的Cu/SSZ-13被用于NH3-SCR反应中活性位点的研究较多,其重要原因是结构中仅存在一个晶体学等效位点,结构较为简单。Gao等[96]通过离子交换法改变铜物种的引入含量,采用EPR结合ICP的方法探究了Cu/SSZ-13催化剂中铜分布随铜含量的变化规律,发现在低铜含量的分子筛上,独立Cu2+通过与两个骨架Al原子相连的氧原子配位而存在于六元环的离子交换位点;随着铜离子交换水平的提高,分子筛内形成了稳定的双氧桥联二聚铜物种,其位于CHA笼内八元环附近的离子交换位点。此外,Verma等[97]
发现,在Si/Al=4.5的Cu/SSZ-13催化剂上,六元环处的独立Cu2+存在密度极限值,铜引入浓度一旦超过此值,部分铜物种就会聚集形成二聚态的铜物种。以上研究表明,分子筛中金属活性物种的分布与金属引入量有关,调控金属活性物种分布的关键在于匹配分子筛载体的硅铝比与金属引入量。
目前,研究者普遍认为,独立Cu2+物种是铜基分子筛在 NH3-SCR 反应中的活性位点[79, 98, 99],这是由Korhonen等[80]率先提出的,后来Deka等[79]基于同步辐射原位X射线衍射(XRD)和吸收技术(XAFS)的表征结果进行DFT计算,证实了位于六元环平面上或稍微偏离中心位置的离子交换位点的Cu2+离子是Cu/SSZ-13上催化NH3-SCR反应的活性位点。Song等[100]采用H2-TPR结合EPR的表征方法对Cu/SSZ-13上铜物种进行研究,发现催化剂上存在两种独立Cu2+物种:Cu2+-2Z和[Cu(OH)]+-Z(Z代表分子筛)。由于Cu2+-2Z在热力学上更稳定,其H2-TPR还原温度约为400 ℃,而[Cu(OH)]+-Z更容易被还原,其还原温度约250 ℃。基于此,Yu等[72]采用原位电子顺磁共振(EPR)技术证实了Cu2+的作用:他们发现,当催化剂在270 ℃下暴露在NH3氛围下时Cu2+被还原为Cu+,再向体系中通入NOx后吸附态的NH3被消耗,而被还原的Cu2+得到再生。Xue等[101]采用EPR、H2-TPR、CO吸附红外等表征手段,对不同铜负载量的Cu/SAPO-34上铜物种进行了定性和定量表征,发现Cu/SAPO-34分子筛中存在四种铜物种:外表面CuO团簇、独立Cu2+、纳米尺寸的CuO和Cu+;此外,独立Cu2+物种的浓度与NH3-SCR反应中的NOx转化率具有正相关关系;进一步,通过动力学研究发现,在100−200 ℃不同铜负载量的Cu/SAPO-34催化剂上的独立Cu2+的转换频率(TOF)几乎保持不变,这证实了独立Cu2+是NH3-SCR反应中的主要活性位点。
此外,也有文献表明,低温下二聚态的Cu2+物种为主要活性物种,而高温下独立Cu2+物种为活性物种。Gao等[96]通过EPR结合ICP的方法,对具有不同铜含量(0.065%–5.15%)的Cu/SSZ-13分子筛上铜物种的分布进行了测定,发现不同温度下NH3-SCR反应活性中心存在差异:低于250 ℃时,脱硝反应速率与铜负载量的平方成正比,证实二聚态Cu2+物种是低温下标准NH3-SCR反应的活性中心;但由于Cu2+二聚体不稳定,随着温度升高该物种分解为独立Cu2+物种,并且迁移到分子筛六元环表面成为主要的NH3-SCR反应的活性中心。
最近,许多研究指出活性位点不单是Cu2+物种,Cu+物种在NH3-SCR反应中(尤其在低温下)同样起重要的催化作用。因此,活性铜物种是包含Cu+物种和Cu2+物种的混合物,这是由于Cu+/Cu2+之间的氧化还原循环对于NH3-SCR反应非常重要[102]。Mcewen等[103]利用原位扩展X射线吸收精细结构谱(XANES),探究了Cu/SSZ-13分子筛中铜物种在真实NH3-SCR反应过程中的变化,发现在快速 NH3-SCR(气氛为 NO2/NOx= 0.5)和 NO2-SCR(NO2/NOx= 1)反应中,Cu/SSZ-13 上的活性中心主要是四配位的Cu2+物种;而在标准NH3-SCR(NO2/NOx= 0)反应中,Cu+和 Cu2+物种同时存在,说明Cu2+物种部分被还原为Cu+,两者共同起催化作用。Chen等[104]发现,由于骨架密度更大,相比于较大孔径的ZSM-5和Beta分子筛,小孔径的SSZ-13分子筛上铜物种与分子筛之间的静电效应更强,更易于形成高稳定性的Cu+,因此能促进铜物种在低温(< 200 ℃)下的氧化还原循环,降低反应活化能,增强反应活性。Zhao等[105]发现,在Cu-Mn/SAPO-34 上进行低温(< 200 ℃)NH3-SCR 反应时,Cu+物种与八面体Cu2+物种之间的氧化还原循环,是NH3-SCR反应发生的主要途径,而与四面体Cu2+物种的之间的氧化还原循环较难发生,导致活性较低。
综上,铜基分子筛催化剂上金属活性物种的分布与金属的引入量有关,实现活性物种分布的高效调控在于匹配分子筛载体的硅铝比与金属引入量。NH3-SCR反应中,位于分子筛离子交换位点的独立Cu2+(如在Cu/SSZ-13上,其占据结构中六元环平面上或稍微偏离中心位置)是该反应的主要活性位点,并且八面体配位的Cu2+与Cu+物种间的氧化还原循环在该反应中起主要催化作用,因此Cu+物种同样承担着重要的作用,尤其在低温下Cu+浓度较高的分子筛具有更加优异的低温反应活性。因此,改善铜基分子筛上铜物种的分布、增加NH3-SCR反应活性中心物种浓度,对拓宽催化剂的活性温度窗口、增强水热稳定性具有重要意义。
2.3 反应路径
铜基分子筛上的NH3-SCR反应与铁基分子筛类似,有 Eley-Rideal(E-R)与 Langmuir-Hinshelwood(L-H)两种反应途径。多数研究者[72, 106]认为,Cu/SAPO-34上的NH3-SCR反应以L-H机理为主:NH3吸附在Cu2+活性位点与酸位点上(Brönsted酸与Lewis酸),与Cu2+氧化NO生成的硝酸盐或亚硝酸盐结合产生中间体,硝酸盐类中间体分解产生N2O,而亚硝酸盐类中间体分解产生N2和H2O。但是,Xin等[107]通过原位红外表征技术研究了Cu/SAPO-44上的NH3-SCR反应机理,发现向反应体系通入 NO + O2后,Lewis酸位上的 NH3吸收峰立即消失,说明吸附态的NH3能与气态NOx反应,因此该反应也遵从E-R机理。因此,对铜基分子筛上的NH3-SCR反应途径的主要争议在于:ER机理是否与L-H机理同时存在[83]。
此外,铜基分子筛上,Brönsted酸与Lewis酸位点在NH3-SCR反应中的作用还存在争议。大部分研究者认为[108],反应中间体主要形成于Lewis酸位点上,而Brönsted酸位点仅起存储NH3的作用,不会直接参与反应。Yu等[72]通过原位EPR技术、原位NH3及NO吸附实验探究了Cu/SAPO-34上NH3-SCR反应中这两类酸位点的作用,他们发现,在反应开始的 3 min Lewis酸位点(主要为Cu2+位点)上吸附的NH3最先被消耗,之后5 min Brönsted酸位点(主要为骨架羟基位点)上的NH3才被消耗,生成硝酸盐或亚硝酸盐类物种,证实了Lewis酸位点在NH3-SCR反应中的重要作用。然而,也有研究者认为,Brönsted酸与Lewis酸均在NH3-SCR中发挥重要的作用。Schwidder等[102]通过调节ZSM-5分子筛的Si/Al比研究了Brönsted酸(主要位骨架羟基数目)对此反应的影响,发现由于Brönsted酸能促进催化反应的中间步骤(如亚硝酸盐类物种的分解反应),从而利于NH3-SCR反应的进行,因此,Brönsted酸浓度高的样品反应活性高。此外, Brandenberger等[109]还发现,由于静电稳定作用,分子筛上铝氧四面体形成的带负电Brönsted酸中心,还能促进带正电荷的金属离子在分子筛上的分散,从而有利于独立Cu2+物种的生成。因此,Brönsted酸与Lewis酸位点在NH3-SCR反应中都具有重要作用,Lewis酸位点上进行主要的反应中间体形成,而不直接参与反应的Brönsted酸在储存及运输NH3和促进中间反应等方面同样起到重要作用。
研究表明,NH3-SCR反应过程中,反应中间体主要有两大类:硝酸盐和亚硝酸盐类[3]。大部分研究认为,起主要活性的中间体是亚硝酸盐类中间体,而硝酸盐会导致N2O副产物的生成。Ruggeri等[110]通过程序升温脱附实验和离线红外表征等手段研究了Fe/ZSM-5分子筛上进行NH3-SCR反应时的中间体的形成过程,证实了亚硝酸盐/HONO中间体的生成,且其为标准NH3-SCR反应中生成氮气和水的重要中间体。Tyrsted等[111]通过NO吸附原位红外研究了Cu/CHA上的NH3-SCR反应中间体,发现NO和O2生成NO2后,可歧化得到双齿硝酸盐,后者又可以被NO还原为双齿亚硝酸盐(速度慢),从而生成氮气和水。Wang等[108]采用原位红外光谱,对Cu/SAPO-34催化剂上,NH3-SCR反应的活性中间体的进行详细表征,他们观测到了硝酸盐类中间体的生成,却并没有检测到亚硝酸盐类物质,但他们认为,这可能是由于NH4NO2的反应活性太高,无法观测到,并不能排除NH3-SCR过程中此类物种的生成。Su等[37]采用原位红外光谱与程序升温表面反应技术,研究了Cu/SSZ-13催化剂上NH3-SCR的反应动力学,提出了Cu/SSZ-13上硝酸盐与亚硝酸盐类中间体的形成与分解的反应机理(图4)。他们认为,Lewis酸位点上与NH3反应的物质主要是,而的生成难度较大,这是由于NH4NO2的高反应活性,其容易生成N2和H2O而很难被O2氧化为;此外,硝酸盐生成后,容易分解形成N2O副产物。因此,硝酸盐的主要作用是与NO反应生成亚硝酸盐活性物质(被普遍认为是NH3-SCR反应中的重要中间体),其本身并不是活性物质,但亚硝酸盐活性物质不稳定,因此不易捕捉;此外,硝酸盐还容易导致N2O的生成,形成副产物,对反应不利[72]。

图4 Cu/SSZ-13 上硝酸盐与亚硝酸盐类中间体的形成与分解[37]Figure 4 Formation and decomposition of nitrate and nitrite intermediates on Cu/SSZ-13[37](with permissions from ACS publications)
除了催化剂上酸性中心的影响外,Cu负载分子筛催化剂上的NH3-SCR反应路径和中间体还受反应温度的影响。Ma等[112]使用原位红外技术对Cu/SSZ-13和Cu/SAPO-34分子筛上,NH3-SCR反应过程中产生的活性中间体进行在线测量,发现高温下(≥ 390 ℃)的反应路径与低温(< 390 ℃)下完全不同:低温下,表面氨与硝酸盐反应生成的NH4NO3是关键中间体,被气相NO进一步还原生成N2和H2O;而在高温下,气相NO2是NH3-SCR反应中的重要中间体,预吸附氨与气相NO2反应生成中间体NH4NO2,形成最终产物N2和H2O。
反应过程中分子筛内铜物种的氧化还原过程,也是NH3-SCR反应路径研究的重要课题。氧气对铜的再氧化是一个缓慢的过程,是NH3-SCR反应的决速步骤[113],再生得到的Cu2+与H2O水合形成较为稳定的[Cu-OH]+。Gao等[21]采用低温动力学实验结合DFT理论计算,发现Cu/SSZ-13上进行NH3-SCR反应时,低温下的氧化半循环由两个独立Cu+物种参与,通过形成[CuI(NH3)2]+-O2-[CuI(NH3)2]+中间体来进行,是低温下氧化还原循环的决速步;而高温下,NH3脱附后暴露的Cu+与分子筛骨架存在静电平衡作用,Cu+被氧化为Cu2+的氧化半循环可以在独立Cu+上完成。Gao等[114]对Cu/SSZ-13催化剂进行了标准NH3-SCR动力学研究,发现只有在反应过程中,XANES光谱上才会出现Cu+特征峰,他们通过原位红外吸收光谱提出了 Cu2+与 Cu+的氧化还原循环机制(式 (18)−(20)):NO2(ads)生成后发生歧化反应(式 (21))生成 NO+,其与NH3继续反应,最终生成N2和H2O。Paolucci等[115]通过原位XAFS结合DFT计算的手段,提出了Cu/SSZ-13上独立Cu2+活性位点的完整NH3-SCR反应机理:吸附在Lewis酸位点上的NH3与被活化后的NO反应生成中间体[CuⅠ-NO-NH2]+,分解生成N2和H2O;O2和NO再生活性位点后与吸附的NH3反应生成亚硝酸盐中间体,该中间体同样分解生成N2和H2O,完成NH3-SCR氧化还原循环。
总体来说,铜基分子筛上NH3-SCR反应路径的研究结论主要包括以下三个方面:(1)Brönsted酸与Lewis酸位点在NH3-SCR反应中都具有重要作用。反应过程中,中间体形成主要在Lewis酸位点上进行,而不直接参与反应的Brönsted酸在储存及运输NH3和促进中间反应等方面同样起到重要作用。(2)在NH3-SCR反应中,起主要活性的中间体是亚硝酸盐类中间体,但由于该类物质反应性较强,相对难以捕捉。而硝酸盐会导致N2O副产物的生成,且该物质是能提供反应关键物种的前驱体。(3)温度区间的差异导致催化剂上NH3-SCR的反应路径、反应中间体及反应活性位点等均存在差异。低温下,二聚态的Cu2+物种为主要活性物种,而NO能还原催化剂表面硝酸盐类物质生成亚硝酸盐,进而分解为N2和H2O;高温下气态NO2为反应中较为重要的反应中间体,主要活性物种为独立Cu2+物种。
3 密度泛函理论研究 NH3-SCR 反应机理
目前,在NH3-SCR反应中,由于原子水平的动态和瞬时实验检测存在局限性,部分反应机理仍未得到合理的解释,如NO在反应中如何被活化,氧气在什么阶段参与反应,反应中间体的种类及具体生成路径等。此外,在NH3-SCR体系中,存在多个的基元反应,这使得具体反应路径非常复杂,采用实验手段往往难以区分和研究。而基于量子化学的理论计算能较精确的计算体系的结合能,通过计算分子势能的变化获得最优的过渡态分子结构,从而获得最可能的反应路径。其中,密度泛函理论(Density functional theory,DFT)是最重要的研究方法之一,该理论充分考虑了电子的相关势能,计算精确度较高且速度较快,因此,常用于金属基分子筛催化剂在NH3-SCR反应中活性位点、反应物吸附形式、反应中间体物种及反应路径的研究中。
NH3-SCR反应主要发生在活性金属位点上,因此,对反应路径的密度泛函理论计算从活性物种在分子筛上的最优位置开始。Mao等[116]基于HSE06能带理论,计算了Cu2+引入SAPO-34上不同离子交换位后体系的结合能,发现SAPO-34上存在五种铜离子交换位点,而位于六元环平面上或稍微偏离中心位置的Cu2+的结合能最低,是最稳定的分布位置;该位点的Cu2+与分子筛六元环上的四个氧原子配位,平均距离为2.08 Å,为Cu/CHA类分子筛上NH3-SCR反应的主要活性位点。Deka等[79]通过基于密度泛函理论的第一性原理计算,获得了Cu/SSZ-13上不同离子交换位点上Cu2+的配位键长和键角参数,发现位于CHA结构中六元环平面上的Cu2+(图5(a))最稳定,这与原位EXAFS实验数据结果一致。此外,他们发现在125 ℃ 的标准 NH3-SCR 气氛下,NH3会与 Cu2+结合,导致活性位点的局域结构从平面正方型变为扭曲的四面体(图5(b));这种几何变化在较高(> 250 ℃)的温度下是可逆的(图5(c)),且 Cu2+周围的化学键长度和角度都有轻微的变化,表明此位点在反应条件下处于活性状态,为NH3-SCR反应的主要活性位点。
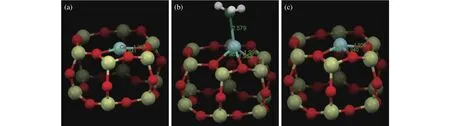
图5 Cu/SSZ-13 的六元环平面上的 Cu2+化学环境变化[79]Figure 5 Changes of the local copper environment in d6r subunit of Cu/SSZ-13[79](with permissions from ACS publications)
在某一金属活性位点上,通过计算反应分子在活性位点上的吸附能、生成活性中间体的吉布斯自由能变化情况,以及反应路径的活化能垒大小,可获得反应分子参与反应的具体形式,判断NH3-SCR反应的路径和具体机制。Christopher等[117]基于DFT理论,计算了Cu/SSZ-13上NH3、NO、O2及H2O的吸附能,发现在200 ℃、标准NH3-SCR环境下,NH3与H2O会竞争吸附在位于六元环中的Cu2+活性位点上,而由于吸附能太大,NO不会吸附至活性位点上;基于此,计算了NH3的解离过程,发现随着产物[CuⅡ-NH2/H+]的形成,Cu的氧化态减小到+1.55,但该过程活化能垒太大,不太可能在200 ℃下发生。最终,他们提出了NO辅助NH3解离吸附的机理:NH3吸附至Cu2+位点后与NO生成NH2NO中间体及一个Brönsted酸位点,而Cu2+被还原为 Cu+,该过程很容易发生(ΔG≈ −9 kJ/mol);随后,NH2NO中间体分解为N2和H2O,该过程可自发进行(ΔG≈ −288 kJ/mol)。因此,[CuⅠ-H2NNO/H+]为Cu/SSZ-13上NH3-SCR反应还原半循环的反应中间体,反应生成 CuⅠ/H+、N2和 H2O。
在NH3-SCR反应中,CuⅠ的氧化半循环涉及到反应中间体的形成与分解,是反应路径中的决速步。Christopher等[117, 118]通过 DFT理论,计算了200 ℃下Cu/SSZ-13中位于六元环中CuⅠ位点上NH3、NO、O2及H2O的吸附能,结果发现,仅NH3与CuⅠ/H+具有强的结合能力(ΔG≈ −47 kJ/mol),NO 与 O2仅存在弱吸附(ΔG≈ −5 kJ/mol),但单个反应物的吸附无法解释CuⅠ的再氧化过程。因此,进一步计算了其他反应物在该位点上的吸附情况,发现NO2具有更高的吸附强度(ΔG≈ −90 kJ/mol),且吸附后铜的氧化态由+1变为+2,形成吸附态亚硝酸盐物种。因此,他们提出,CuⅠ的氧化半循环通过NO2氧化途径进行,该路径的反应中间体为[CuⅡ-NO2/NH4+],CuⅡ活性位点被再生且产生N2和H2O。
Mao等[116]基于HSE06泛函理论,计算了NH3-SCR反应中,Cu/SAPO-34上的NO及CuⅠ氧化过程,并充分考虑分子筛中各原子间的范德华相互作用力,得到三条可能存在的路径(图6)。他们发现,由于CuⅡ被还原为CuⅠ/H+后吸附氧气的能力显著提升(ΔG由+0.52变为~0 eV),三条反应路径中Z-NH4的反应活化能垒(+0.86 eV)明显低于ZH(+1.06 eV)和 Z(+3.65 eV)。基于此,他们提出了Cu/SAPO-34上NH3-SCR反应中CuⅠ氧化半循环的反应路径(式 (22)−(23))。
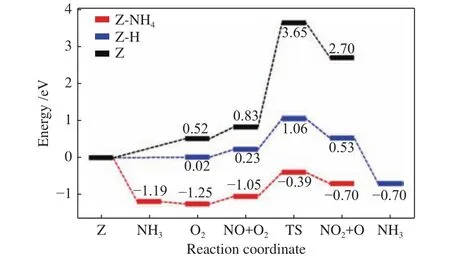
图6 Cu/SAPO-34 上不同反应路径的自由能变化[116]Figure 6 Free energy diagrams of different reaction paths on Cu/SAPO-34[116](with permissions from ACS publications)
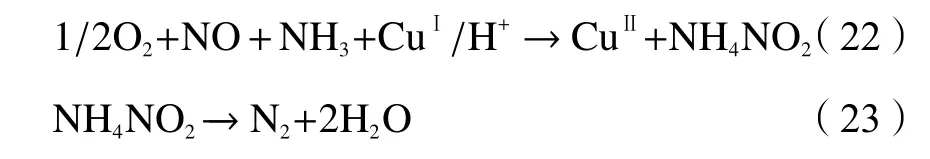
综上,由于NH3-SCR反应的复杂性和原子层面的原位实验手段的局限性,密度泛函理论是研究金属基分子筛催化剂上NH3-SCR具体反应机理重要方法。根据分子筛模型中金属占据不同离子交换位点后体系的结合能的大小,可判断活性位点的稳定性,从而获得活性反应位点的最优空间位置;根据不同状态下的活性位点在反应中化合键参数(键长、键角及键能等)的变化情况,可获得反应中金属离子的局域环境信息;根据各反应物分子在分子筛模型中吸附能的大小及分子活化势能的变化情况,可判断反应物参与NH3-SCR反应的具体途径;通过设计和计算不同反应路径,计算反应中间体的生成能垒,可判断最优的过渡态分子结构及活化能垒最小的反应路径,从而推测最可能的NH3-SCR反应机理。
4 本征动力学研究
对催化反应的动力学研究,有助于深刻认识催化反应机理及催化剂的作用特征,同时还为工业催化过程确定最佳生产条件、反应器的设计提供理论依据。本征动力学是指消除传热、传质、流体流动等影响因素(排除内外扩散等限制),只研究表面反应部分,因此,更能反映催化反应本身的特性,如催化反应的速率常数可用来比较催化剂活性的高低,表观活化能可用来判断催化活性中心的变化情况,指前因子可来判断反应过程的活性中心数量的变化情况,这些参数都是改进现有催化剂及设计新型催化剂的依据。
通常,为了获得金属负载型分子筛催化剂在NH3-SCR反应中的动力学参数,首先需要测定各反应物的反应级数以及不同温度下的反应速率常数,从而构建催化反应动力学模型,最终计算得到反应活化能及指前因子。对于稳态标准NH3-SCR反应,通常使用幂函数模型方程式(式(24))计算反应速率[119]:
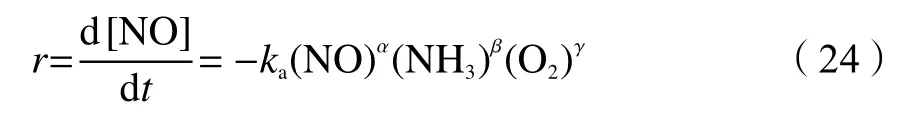
式中,r为 NH3-SCR的总反应速率,mol/(g·min);ka为表观反应速率常数,L/(g·min);t为空时(即反应气体穿过固定床反应器床层的时间,用W/V表示),单位为(g·min)/L,与表观反应速率常数单位相反;V为进料气总流量,L/min;W为催化剂的质量,g;α、β、γ分别是NO、NH3、O2的反应级数。
大 量 文 献 研 究 表 明[73, 76, 96, 101], 标 准 NH3-SCR 反应中,NO、NH3、O2的反应级数约为 1、0、0.5;此外,O2在原料气中一般是过量的,因此,其浓度对反应过程的影响可以忽略不计。基于此,式(24)可简化为式(25),对其两端同时积分并简化后可得式(26),最后将t和x(x为 NOx的转化率, %,x=1−[NO]1/[NO]0)带入式(26)中可得式(27):
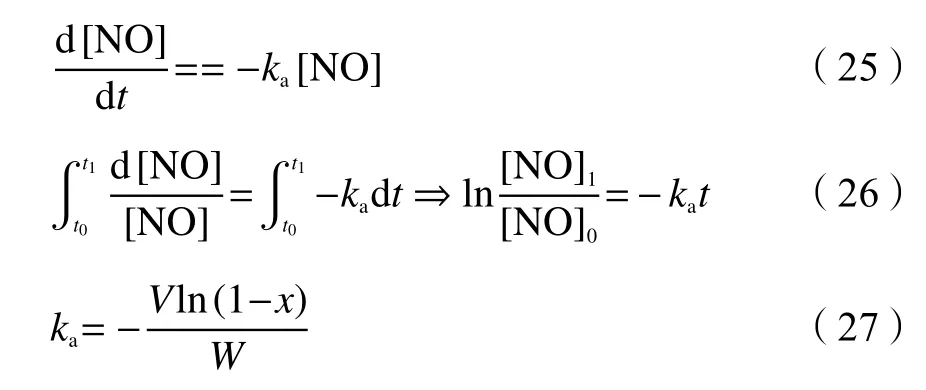
因此,可通过测定同一空时t、不同反应温度T下的转化率x,根据式(27)获得不同反应温度T下的反应速率常数ka,再带入阿伦尼乌斯公式(28)中,在 lnka和 1/T的线性区间内,通过式(28)拟合得到表观活化能Ea和指前因子A。

式中,Ea为表观活化能,J/mol;A为指前因子,L/(g·min);R为理想气体常数,取 8.314 J/(mol·K);T为反应温度,K。
Kovarik等[76]采用本征动力学实验,研究了NH3-SCR反应中,Fe/SSZ-13分子筛水热老化前后的表观活化能与指前因子的变化情况,发现800 ℃水热老化后,样品的指前因子从 1500 s−1下降到 140 s−1,而表观活化能从 52.9 kJ/mol下降到 43.8 kJ/mol),指前因子的下降是由于老化过程中活性铁物种含量下降,导致活性碰撞概率降低引起的;而活化能的下降则说明老化过程使得催化剂上铁物种的分布发生了改变,活性铁物种种类有了明显的变化。进一步,结合活性位点的定量表征,他们发现,老化过程中部分活性铁物种发生了迁移和聚集,最终与分子筛上的非骨架铝形成了几乎无NH3-SCR活性的铁铝氧化物种,从而导致活化能和指前因子的下降,以及催化活性的降低。
参考文献[101],不同研究者获得的Cu/SSZ-13分子筛在NH3-SCR反应中的表观活化能差距很小(40−43 kJ/mol),这说明同一催化剂体系下反应活性位点存在相似性。但研究者通过对NH3-SCR反应过程的详细动力学研究发现,NH3-SCR反应对温度敏感,不同的反应温度范围内,反应机理、活性位点和活化能都存在较大的差异。Brandenberger等[64]采用详细的表征手段结合动力学实验,研究了不同反应温度下,各种铁物种对Fe/ZSM-5分子筛上的NH3-SCR反应活性的影响,他们发现低温下(< 300 ℃)独立 Fe3+为主要活性位点,对应Ea=36.3 kJ/mol; 而 高 温 下 (> 500 ℃ ) 二 聚 Fe3+物 种([HO-Fe-O-Fe-OH]2+)为主要活性位点,此时Ea为77 kJ/mol,这说明表观活化能能反映催化剂上活性物种的变化情况,并从侧面反映反应路径的变化。
表3统计了文献中报道的具有代表性的铁基和铜基分子筛催化剂上,NH3-SCR反应的表观动力学参数结果。由表3可知,铜基分子筛的表观活化能为 29−58.9 kJ/mol,而铁基分子筛上的表观活化能为46−58 kJ/mol,这说明不同的分子筛载体中,由于分子筛孔道结构与活性金属位点的作用力不同,使得活性金属物种的局域环境和氧化还原活性发生改变,从而使得其催化性能存在差异。此外,表3中,尽管各Cu基分子筛催化剂的表观活化能测定的温度范围均为低温范围(100−250 ℃),但也存在差异,这也是导致其表观活化能不一致的原因之一。而Fe基分子筛是测试温度范围比 Cu 基分子筛更高(200−400 ℃),这是由于Fe物种的氧化还原温度更高引起的[4],这也解释了铁基分子筛良好的中高温活性。
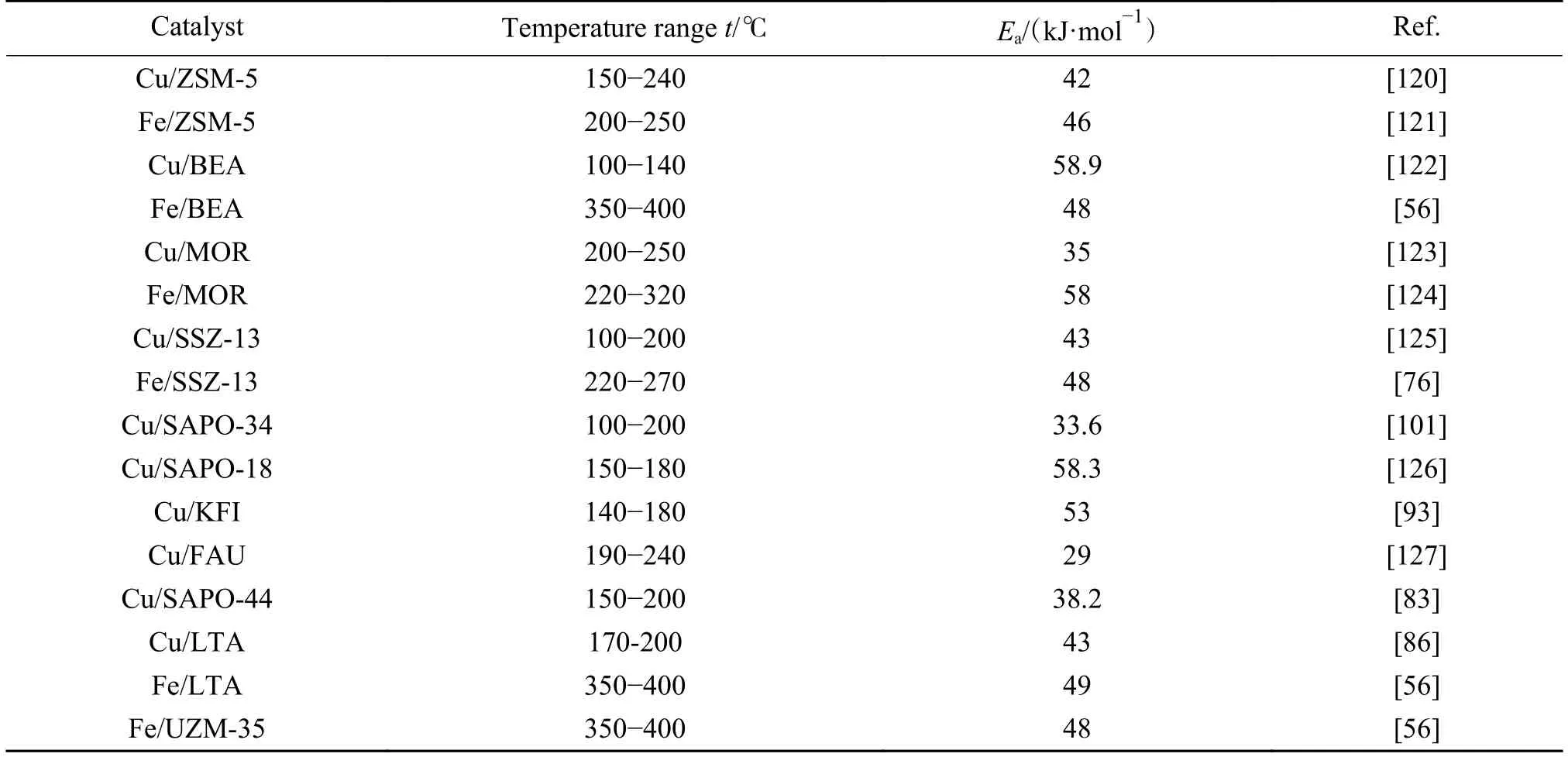
表3 各铁基和铜基分子筛催化剂上标准NH3-SCR反应的表观反应活化能Table 3 Apparent activation energy values of standard NH3-SCR reactions over Fe- and Cu-based zeolite catalysts
总体来说,指前因子代表催化过程中活化分子碰撞概率,指前因子的大小间接反映了催化剂上活性中心数目的多少,可用来判断催化剂中活性位点数目的变化。而表观活化能则反映催化剂上活性位点的性质,表观活化能的大小变化,可用来间接判断催化剂上活性位点种类和分布行为的变化[76]。
5 总结与展望
在NH3-SCR反应中,由于与NO、NH3和O2等反应分子和产物H2O分子之间的配位作用、亲和性能等的差异,铜基分子筛具有明显的低温(< 300 ℃)催化优势,但其水热稳定性往往较差;而铁基分子筛催化剂具有高温催化优势(300−550 ℃),以及相对更高的水热稳定性。此外,在铁基和铜基分子筛催化剂的NH3-SCR研究中,与中孔和大孔分子筛相比,小孔分子筛催化剂的催化活性、水热稳定性等性能均较为优越;但后续研究发现,催化剂的制备方式和分子筛载体的物理化学性质,也显著影响催化剂的NH3-SCR活性,因此,高活性催化剂的制备并不一定依赖于小孔分子筛催化剂。
铁基分子筛催化的NH3-SCR反应中,低温下的主要活性中心为[Fe(OH)]+,在高温下主要活性中心为独立Fe3+物种。而铜基分子筛中,NH3-SCR活性中心以位于分子筛离子交换位点的独立Cu2+为主,但有研究者认为Cu+物种同样起重要催化作用。此外,活性物种的空间分布和配位环境也是影响其催化反应活性的重要因素,实现活性物种分布的高效调控在于匹配分子筛载体的硅铝比与金属含量,对拓宽催化剂的活性温度范围、增强水热稳定性具有重要意义。
提高金属负载型分子筛催化剂的NH3-SCR性能可从以下三点着手:(1)选择具有合适拓扑结构的分子筛载体,从而优化活性金属物种的分布,并增加其稳定性,进而拓宽催化剂的NH3-SCR温度窗口和水热稳定性;(2)改进催化剂的制备方法,如采用一锅法等方法优化活性铁物种的分布;(3)改良现有催化剂,如引入第二种阳离子(Cu或Mn),或采用Cu基和Fe基分子筛的混合,从而拓宽温度窗口,提高催化活性和水热稳定性等。
目前,研究者对于金属基分子筛催化剂在NH3-SCR反应中的具体催化机制,还存在争议,主要体现在以下三点:(1)反应路径是L-H还是ER机制,还是两种机制都存在?反应的中间体的捕捉?一般认为,低温下更倾向于L-H机制,高温下E-R机制更容易发生,但由于反应催化剂体系和反应条件的差异,以及中间体捕捉的困难性,研究者往往会得到不同的结论。(2)Brönsted和Lewis酸中心在反应中的具体催化作用?目前,大部分研究者认为,反应中间体主要在Lewis酸位点上形成,而Brönsted酸中心不直接参与反应,主要起储存及运输NH3和间接促进中间反应,如亚硝酸铵分解等作用。(3)金属活性位点的氧化半循环如何发生?金属活性位点的氧化反应,受其结构特点、空间环境和反应条件如温度、氧化剂的影响。综合文献,Fe基分子筛中,与独立Fe2+物种相比,二聚的Fe2+物种更容易被O2氧化,因此,选择性的提高催化剂中二聚铁物种的浓度,有利于NH3-SCR的氧化半循环发生,从而提高催化剂的反应活性。此外,向反应气氛中添加适量的NO2,也有利于二价铁物种的氧化,并提供新的反应途径,从而加速NH3-SCR反应的发生。Cu基分子筛中,低温下的氧化半循环必须在两个Cu+物种的参与下进行,而高温下,氧化半循环可以在独立Cu+上完成,因此,提高独立铜物种的浓度,有利于低温下氧化半循环的发生,从而提高低温催化活性。
以上NH3-SCR反应机理问题的研究,可以通过以下方法进行:(1)首先,构建合适的金属负载型分子筛催化剂体系,并通过详细的表征手段(UV-vis、H2-TPR 、XPS、CO-IR 、NO-IR 、EPR、Mössbauer、XAFS等)分析催化剂上活性金属物种的含量和分布,并获得催化剂的酸性质和物理化学性质特征。需要注意的是,为避免反应机理的复杂化,以及活性金属物种的定性和定量困难,催化剂体系需尽可能简单,如金属含量不宜过高(< 2%),金属种类相对简单等。(2)通过原位实验研究,捕捉活性中间体,推测具体反应路径。如通过原位NH3吸附、NO+O2吸附红外实验,探究Brönsted酸与Lewis酸位点在NH3-SCR反应中的变化情况,并捕捉反应中间体,从而判断反应路径和催化机制;通过原位EXAFS实验,研究活性金属物种在真实NH3-SCR反应过程中的配位状态、结构等化学环境的变化情况,从而推断具体氧化还原反应途径等。(3)通过反应动力学研究,进一步研究表面反应本征催化机制。通过对反应动力学参数的测定,并结合对活性金属位点的定性和定量表征,获得活性金属位点的主要特征,从而判断其反应机理。需要注意的是,对反应动力学的研究,需要在本征动力学反应区域内进行,因此,需首先优化反应条件,排除内外扩散的影响,尽量在低温、副反应较少的情况下进行,这样能更准确的研究表面反应的本征反应机制。
NH3-SCR反应机理的研究,需要建立在对金属活性物种有准确的认识基础上,需要依赖于多种表征手段。此外,离线表征手段,往往无法准确的反映金属活性物种在真实NH3-SCR反应气氛中存在状态,以及其与反应物和产物的作用形式。因此,对NH3-SCR反应机理的进一步研究,需要借助于多种原位表征手段,如原位红外、原位EXAFS、原位EPR等,并结合理论计算和详细的反应动力学研究,从而准确地获得催化剂上活性物种的活化、反应途径,进而推断其具体反应机制,为更深入理解NH3-SCR反应过程提供理论支持,并指导进一步开发新一代的高效NH3-SCR催化剂。
此外,工业实际NH3-SCR反应气氛中,还存在SO2和H2O等组分[128]。低温下,SO2会与氨、O2反应,在催化剂表面沉积形成硫酸铵盐类,覆盖表面活性位点;此外SO2还会与催化剂上活性铜或铁物种反应,形成稳定的硫酸盐类化合物,导致催化剂发生硫中毒从而失活[45]。而高温水蒸气反应气氛下,金属基分子筛催化剂容易发生结构破坏(分子筛骨架坍塌),以及活性铜或铁物种的迁移和聚集(形成低催化活性的CuOx或FexOy,以及CuAlOx或FeAlOx等氧化物团簇),最终导致催化剂水热失活[129]。而在催化剂体系中加入其他过渡金属(如Ce和Mn[55])作为助剂,可提高催化剂的抗水、抗硫中毒能力,但其具体促进机制仍需进一步研究。因此,探究水、硫中毒过程中催化剂结构和活性物种的变化行为,深入了解催化剂的失活机制,有助于开发出高效、高抗水抗硫性能的NH3-SCR催化剂,以满足实际工业应用需求。

